新型異亮氨酸雙加氧酶及其重組大腸桿菌合成羥基異亮氨酸
付敏杰, 聶堯, 穆曉清, 徐巖,2, 肖榮
(1江南大學生物工程學院工業(yè)生物技術教育部重點實驗室,江蘇 無錫 214122;2江南大學食品生物技術國家重點實驗室,江蘇 無錫 214122;3羅格斯大學高級生物技術與醫(yī)學中心,新澤西州 08854,美國)
新型異亮氨酸雙加氧酶及其重組大腸桿菌合成羥基異亮氨酸
付敏杰1, 聶堯1, 穆曉清1, 徐巖1,2, 肖榮3
(1江南大學生物工程學院工業(yè)生物技術教育部重點實驗室,江蘇 無錫 214122;2江南大學食品生物技術國家重點實驗室,江蘇 無錫 214122;3羅格斯大學高級生物技術與醫(yī)學中心,新澤西州 08854,美國)
異亮氨酸雙加氧酶(IDO)可特異性的轉化底物L-異亮氨酸(L-Ile)生成4-羥基-L-異亮氨酸(4-HIL),該產物具有促進胰島素分泌的功能,可用于抗糖尿病、降膽固醇等。本研究結合了酶標顯色和薄層層析(TLC)的方法從自然界中篩到了具有IDO活性的菌株,并將該菌株中的目的基因ido克隆到大腸桿菌中,獲得重組表達菌株,并且驗證該菌具有IDO的轉化功能。本研究優(yōu)化了轉化反應體系和條件,同時通過30℃過夜溫育菌體細胞的方法,使該菌株全細胞轉化合成4-HIL的產率達到85%以上。
異亮氨酸雙加氧酶;異亮氨酸;羥基異亮氨酸; 生物轉化; 重組表達
4-羥基-L-異亮氨酸(4-HIL)是一種新型胰島素分泌促進劑,可用于治療Ⅱ型糖尿病。而關于4-HIL的合成已有一些相關報道,Wang等[1]研究了一種有效的八步合成4-HIL的方法,其轉化總產率為39%,該方法的關鍵步驟是利用Geotrichum candidum生物轉化2-甲基乙酰乙酸乙酯生成(2S,3R)-2-甲基-3-羥基丁酸已酯,接著將上述反應的產物作不對稱斯特雷克爾合成(是一種從α-羥基腈制備氨基酸的合成法)。Rolland-Fulcrand等[2]研究了有6個步驟完全控制立體化學酶合成4-HIL的方法,該方法最后一步是利用商業(yè)化應用的固定化青霉素酰化酶G酶解拆分(N)-苯乙酰內酯衍生物。Smirnov等[3-4]利用4-羥基-3-甲基-2-酮基-戊酸鹽醛縮酶和支鏈氨基酸氨基轉移酶的雙酶偶聯(lián),經過兩步反應將乙醛、α-酮基丁酸鹽和L-谷氨酸轉化生成4-HIL。
Haefelé等[5]發(fā)現(xiàn)在葫蘆巴種子中4-羥基-L-異亮氨酸的合成過程中有雙加氧酶,當有Fe2+、α-酮戊二酸(α-KG)、抗壞血酸和氧氣存在時,該酶可一步催化合成4-HIL,此后關于該酶的研究才開始逐漸深入。Kodera等[6]從Bacillus thuringiensis中發(fā)現(xiàn)了可一步催化合成4-HIL的L-異亮氨酸雙加氧酶(IDO),即L-異亮氨酸羥基化酶,探索該酶催化合成4-HIL的路線,如圖1所示,IDO催化底物L-異亮氨酸發(fā)生羥基化,生成4-HIL;該研究通過質譜分析發(fā)現(xiàn),芽孢桿菌產羥基化酶催化底物L-異亮氨酸,轉化產物為4-HIL。
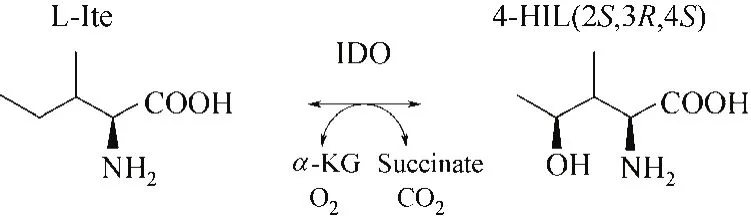
圖1 合成4-羥基-L-異亮氨酸的新型路徑
Ogawa等[6-9]篩選得到了一株產IDO的蘇云金芽孢桿菌,并對該菌中IDO的酶學性質和生物轉化代謝過程進行了研究,進而將該酶的基因ido克隆到E. coli中進行表達,并從基因水平對表達進行了調控,最終使得IDO催化Ile生產4-HIL的產率最高達82%。
雖然已有開展生物催化轉化羥基異亮氨酸研究的相關報道,但能夠羥基化脂肪族氨基酸的雙加氧酶的資源仍然有限。目前,只有日本的一個研究小組有此方面相關報道,而且其在基因水平上調控的克隆菌株的轉化反應水平也較為有限。本研究致力于開發(fā)新型催化劑,設計新的篩菌方案,結合酶標顯色檢測和薄層層析檢測兩種篩選方法,從自然界篩選有雙加氧酶基因的菌株,并對其功能基因進行克隆,通過誘導使重組酶獲得表達,得到的重組菌用于全細胞不對稱轉化,并對轉化條件和體系進行優(yōu)化,使得無基因修飾的原始重組菌的轉化水平高于已有的報道,探索得到了更經濟的生物轉化條件。
1 材料和方法
1.1 材料
1.1.1 菌種和質粒
含雙加氧酶基因的菌株Bacillussp.從各地采集的土樣中篩選得到;大腸桿菌E. coliJM109、BL21 (DE3)感受態(tài)細胞由本文作者所在實驗室保藏。
pET-28a(+)質粒,本文作者所在實驗室保藏。
1.1.2 主要試劑與儀器
LATaqDNA Polymerase、T4 DNA Ligase、限制性內切酶SalI和NcoI、DNA marker,TaKaRa公司;Isopropylβ-D-1-Thiogalactopyranoside(IPTG),上海生工生物工程公司;細菌基因組提取試劑盒,北京天根生化科技有限公司;質粒提取試劑盒、膠回收試劑盒,OMEGA BIO-TEK。引物由上海生工生物工程公司合成。
標準品L-異亮氨酸(L-Ile)、4-羥基-L-異亮氨酸(4-HIL)為色譜純;乙腈、甲醇為色譜級;其他試劑藥品均為分析純。
恒溫水浴鍋,上海華連醫(yī)療器械有限公司;PCR儀、DNA電泳儀、蛋白電泳儀、凝膠成像儀,購自Bio-Rad公司;酶標儀,Thermo公司;高效液相色譜儀,Waters公司。超聲清洗機SB-25-12D,寧波新芝生物科技股份有限公司。
1.1.3 培養(yǎng)基
LB培養(yǎng)基:蛋白胨10g/L,酵母提取物5g/L,NaCl 10g/L,pH7.0(固體培養(yǎng)基加入15%瓊脂)。
營養(yǎng)瓊脂培養(yǎng)基:牛肉膏3g/L,蛋白胨10g/L,NaCl 5g/L,瓊脂15%,pH7.0。
發(fā)酵培養(yǎng)基:可溶性淀粉4g/L,酵母提取物4g/L,麥芽提取物10g/L,底物L-Ile 2g/L,pH7.0。
IDO肉湯培養(yǎng)基:可溶性淀粉4g/L,葡萄糖4g/L,MgSO4·7H2O 0.11g/L,CaCl20.11g/L,底物L-Ile 2,pH7.0。
1.2 菌株篩選方法
1.2.1 芽孢桿菌的篩選
將從各地采集的10份土樣各取0.5g于5 mL生理鹽水中充分打散,制成懸浮液,在70~80℃水浴中熱處理15~20min后,將懸浮液靜置取上清為100梯度,再將其稀釋成10-1、10-2梯度,這3個梯度的土壤懸液涂布到營養(yǎng)瓊脂平板上,37℃培養(yǎng)。挑取單菌落,即為芽孢桿菌,作進一步篩選。
1.2.2 酶標顯色檢測方法
根據(jù)文獻[10],加氧酶生物轉化的產物經過酸化后轉化成的酚,可與Gibbs試劑作用顯色,并且有明顯的吸收光譜,因此可通過酶標板用Gibbs試劑對加氧酶活性進行篩選。本研究根據(jù)這一原理設計了如下檢測方法。
接種針挑取芽孢桿菌單菌落接種到含500μL發(fā)酵培養(yǎng)基的96孔酶標板中,37℃、200r/min振蕩培養(yǎng)2 天,然后加入500μL溶有15mmol/L氯苯的發(fā)酵培養(yǎng)基,用膜包住板,于37℃、200r/min振蕩培養(yǎng),12 h后將板離心,取上清100μL加入到酶標板孔中,再加入100μL 0.1mmol/L HCl,將酶標板于37℃靜置30min,然后分別加入20μL 1mol/L Tris-HCl(pH8.5)和25μL 0.4% Gibbs乙醇溶液,于室溫下反應40min后,用酶標儀檢測在652nm下的吸光度值。
1.2.3 薄層層析(TLC)檢測方法
根據(jù)氨基酸薄層層析茚三酮顯色方法的原理,本研究采用硅膠板薄層分配層析來分離檢測氨基酸,當展開劑隨著點過樣的層析板遷移時,由于樣品中不同氨基酸在展開劑中的分配系數(shù)不同,遷移速度也不同,從而達到分離的目的。層析結束后,將層析板置于烘箱中烘干至板上出現(xiàn)氨基酸斑點。
將篩到的芽孢桿菌接種到96孔板中的1mL發(fā)酵培養(yǎng)基中,28℃、200r/min振蕩培養(yǎng)2 天,培養(yǎng)液離心,取上清0.25μL點樣進行層析。展開劑∶正丁醇∶乙酸∶水=4∶1∶0.5(質量比),顯色劑為0.3%茚三酮,溶于展開劑中。
1.3 基因組DNA提取和質粒的提取
芽孢桿菌基因組的提取參照細菌基因組提取試劑盒說明書方法(北京天根生化科技有限公司)。
質粒提取參照質粒提取試劑盒說明書的方法(TaKaRa公司)。
1.4 目的基因ido的克隆
根據(jù)已報道的IDO雙加氧酶基因(GenBank Accession No. KC884243.1),在NCBI上BLAST后,根據(jù)相關基因的同源性設計了以下簡并引物。
上游引物I-F-NcoⅠ為
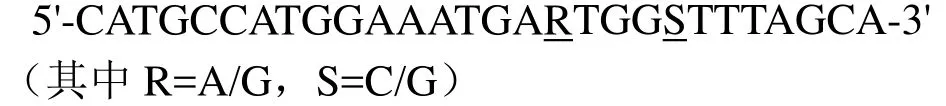
下游引物I-R-SalⅠ為
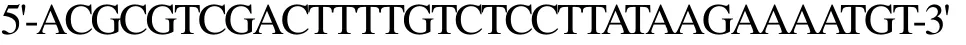
以篩選到的芽孢桿菌基因組為模板,采用PCR方法擴增ido基因,擴增條件為:95℃預變性5min; 95℃ 1min,56℃ 1min,72℃ 1min,進行30個循環(huán);72℃延伸10min。取5μL PCR產物,用1%瓊脂糖凝膠電泳檢測。PCR產物經膠回收純化后與pMD19-T在16℃下連接4 h,連接產物用熱激發(fā)轉化到E. coliJM109感受態(tài)細胞中,轉化細胞經培養(yǎng)后,提取質粒酶切驗證,獲得陽性重組質粒pMD19-T-ido。基因測序由上海生工生物工程公司完成。
1.5 重組表達載體的構建
根據(jù)上述測序結果,設計以下表達引物用于PCR。
上游引物I-F-NcoⅠ為

下游引物I-R-SalⅠ為
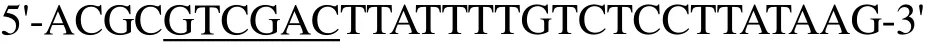
PCR產物純化后用限制性內切酶NcoI和SalI酶切,同時雙酶切載體pET-28a,膠回收pET-28a的線性質粒和目的基因,用T4 DNA Ligase連接載體和目的基因在16℃下過夜,連接產物轉化E. coliBL21(DE3)感受態(tài)細胞,涂布卡那抗生素平板,通過對轉化子酶切驗證和測序,確認獲得陽性克隆E. coliBL21/pET-28a-ido。
1.6 目的基因ido誘導表達
重組菌的單菌落接種到含有卡那抗生素的3mL LB液體培養(yǎng)基中,37℃、200r/min振蕩培養(yǎng)過夜。取1mL種子液轉接至含有卡那抗生素的LB液體培養(yǎng)基中,于37℃、200r/min振蕩培養(yǎng)至OD600約為0.6~0.8。向培養(yǎng)基中加入終濃為0.5mmol/L的IPTG,于30℃、200r/min進行誘導培養(yǎng)過夜。細胞總蛋白和胞內蛋白含量經SDS-PAGE檢測。
1.7 重組菌生物轉化反應
發(fā)酵獲得的菌體,經生理鹽水洗滌2次后,用50mmol/L pH8.0的Tris-HCl緩沖液懸浮備用。
生物轉化反應體系(2mL):20%的濕菌體,10mmol/L L-Ile底物,10mmol/Lα-KG,0.5mmol/L FeSO4·7H2O,10mmol/L 抗壞血酸,50mmol/L pH8.0 的Tris-HCl緩沖液。
生物轉化條件:28℃,200r/min反應1 h。
1.8 生物轉化反應條件優(yōu)化
1.8.1 轉化反應體系優(yōu)化
分別對1.7節(jié)中所述反應體系各物質進行單因素考察,單因素分別為菌體細胞(0~50%)、α-KG (0~50mmol/L)、FeSO4·7H2O(0~2mmol/L)、抗壞血酸(0~50mmol/L)、L-Ile(0~120mmol/L)。
1.8.2 轉化反應條件優(yōu)化
保持1.7節(jié)中反應體系成分不變的情況下,分別從不同反應pH值(7.5、8.0、8.5、9.0、9.5、10)和不同反應時間(1 h、5 h、10 h、15 h、20 h、25 h)上來比較重組酶IDO酶活水平,尋找最佳轉化條件。
1.8.3 轉化反應優(yōu)化策略
根據(jù)文獻[11],不同溫度處理過的菌體用來作反應,轉化效果更好。本研究將菌體懸浮液分別在20℃、30℃、37℃溫育12 h,然后再做反應,同時將反應體系的物質濃度提高2倍,考察轉化情況。
1.9 底物與產物的分析檢測方法
1.9.1 反應液衍生化
反應結束后,反應液離心,取250μL上清轉移到5mL離心管中,加入250μL 2mol/L pH9.2的硼酸緩沖液,再加入500μL 5倍過量的芴甲氧羰酰氯(Fmoc-Cl)乙腈溶液,待衍生化反應完成后加入500μL對Fmoc-Cl兩倍過量的2-氨基金剛烷(ADAM)的乙腈/水(1∶1,體積比)溶液,阻止過量的Fmoc-Cl水解。溶液用0.22μm的有機膜過濾后用HPLC檢測。1.9.2 HPLC檢測條件
Diomansil C18柱(250mm×4.6mm),流速1.0mL/min,紫外檢測器263nm,流動相A為50mmol/L 的NaAc-HAc 緩沖體系,pH值為4.2,流動相B為乙腈。采用50∶50等度洗脫。
2 結果與討論
2.1 產雙加氧酶菌株的篩選
根據(jù)文獻,產雙加氧酶的微生物種類較多,如Rhodococcus[12]、Pseudomonas[13-15]、Klebsiella[16]、Exophiala[17]、Bacillus[6,18-19]、Aspergillus[20]等,因為芽孢桿菌中的雙加氧酶在轉化羥基化方面酶活較高,轉化性能較好[6,21-22],因此本研究利用專一性篩選芽孢桿菌的方法從土樣中篩選獲得芽孢桿菌,按1.2.1節(jié)的方法從自然界土樣中共得到芽孢桿菌579株。
將得到的芽孢桿菌分別按照酶標顯色檢測和TLC檢測兩種篩選方法進行進一步的篩選,結果如圖2所示。通過酶標顯色方法共得到364株菌株,顯色為深藍色[如圖2(a)所示,顯色越深,吸光度值越大];將這364株菌株再通過TLC檢測,共得到56株候選菌株。從以上篩選得到的菌株中選取酶標儀檢測值高,且TLC檢測目的產物斑較大的菌株[如圖2(b)所示],可初步確定其具有加氧酶酶活。
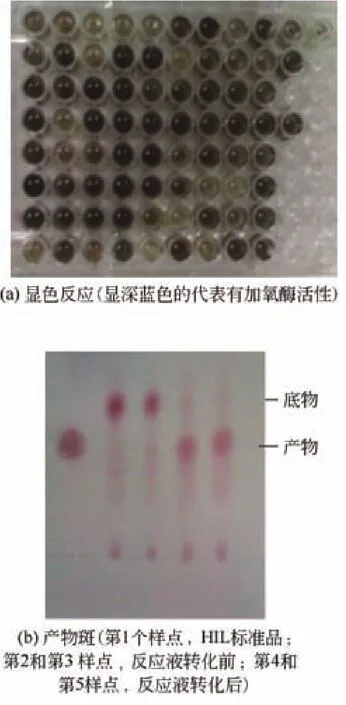
圖2 酶標板的反應顯色和TLC檢測的產物斑
2.2 加氧酶基因的克隆與表達
以篩選到的芽孢桿菌中篩選現(xiàn)象最明顯的菌株基因組DNA為模板,用設計的簡并引物進行PCR,PCR后得到的目的條帶經純化與pMD19-T載體連接,經酶切鑒定,獲得重組質粒pMD19-T-ido。基因測序結果顯示基因長度723 bp,編碼240個氨基酸;IDO氨基酸序列比對結果如圖3所示,與其他7個類似蛋白的氨基酸序列一致性達96.65%。目的基因表達產物的序列分析表明,本研究篩選獲得的菌株含有一種新型的潛在雙加氧酶。
用表達引物通過PCR從重組質粒pMD19-T-ido中調取ido基因,構建重組的表達質粒pET 28a-ido,并將其轉化至E. coliBL21(DE3)感受態(tài)細胞中。重組菌經IPTG誘導,SDS-PAGE分析可知,重組菌在接近29 kDa處比對照多出一條蛋白條帶,表明重組酶IDO在大腸桿菌中獲得表達,其相對分子質量約為31 kDa。對IPTG的濃度進行優(yōu)化可知,當IPTG濃度為0.5mmol/L時,可溶性蛋白表達量較大,在0.5mmol/L IPTG的誘導情況下,誘導溫度的優(yōu)化結果如圖4所示,由圖4可知,在30℃時的可溶性蛋白表達量最大。因此該重組菌誘導表達的最佳溫度定為30℃,IPTG濃度定為0.5mmol/L。

圖3 加氧酶氨基酸序列比對結果
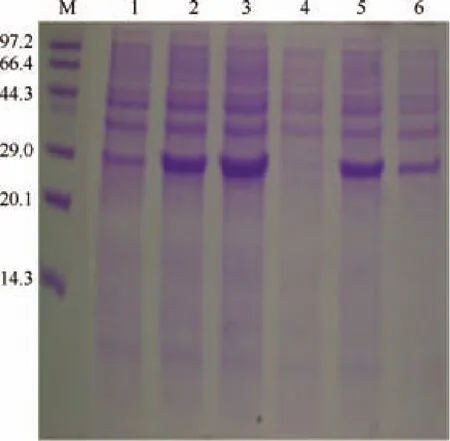
圖4 重組蛋白的誘導表達
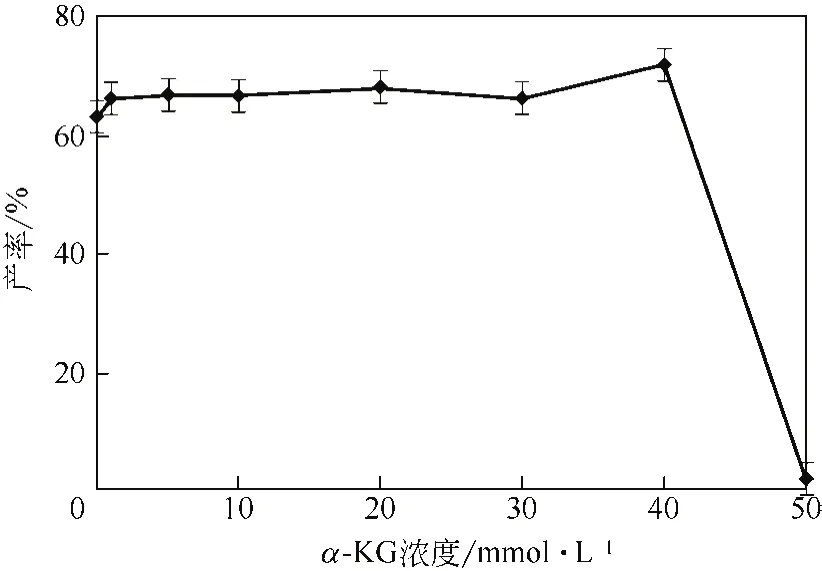
圖5 α-KG濃度對產率的影響
2.3 重組菌轉化反應
2.3.1 反應體系組成對轉化效率的影響
根據(jù)實驗結果,發(fā)現(xiàn)全細胞轉化產率總體優(yōu)于粗酶液轉化體系,因此本實驗選取全細胞轉化體系進行下一步的優(yōu)化。反應體系和反應條件的優(yōu)化結果如下。
由于雙加氧酶IDO催化Ile羥基化生成4-HIL的過程與α-KG生成琥珀酸的過程相偶聯(lián),所以α-KG是作為該催化反應的輔底物參與上述反應,由圖5可知當α-KG的濃度在0~40mmol/L變化時,轉化產率變化不大,超過40mmol/L,產率急劇下降至0。根據(jù)文獻[6],α-KG是該轉化反應所必需的,從圖5可以發(fā)現(xiàn),當不添加α-KG時,轉化反應的產率也在60%以上,這與已有報道酶液反應體系不同,可能是由于細胞內源的α-KG在參與反應,解決了酶液反應體系所不能克服的輔底物α-KG的循環(huán)再生、Ile羥基化反應與α-KG轉化為琥珀酸反應的偶聯(lián)等問題,體現(xiàn)了全細胞反應體系的優(yōu)勢。
抗壞血酸并不是雙加氧酶IDO轉化反應所必需的,但卻可以極大地促進反應速率[6],因此由圖6可看出,其對反應產率的影響不大,抗壞血酸濃度在0~50mmol/L變化時,產率都維持在60%左右,但總體呈現(xiàn)先上升后維持不變的趨勢,因此全細胞轉化體系只需在反應前期補充少量抗壞血酸即可滿足反應所需,與已報道的酶液反應體系相比,該轉化體系在資源消耗方面更經濟。
根據(jù)文獻[23],多數(shù)雙加氧酶催化反應時要利用鐵離子金屬中心與底物等物質發(fā)生作用,因此亞鐵離子是該酶促反應所必需的。由圖7可知,隨著亞鐵離子濃度的增大,產率也逐漸增大,當亞鐵離子濃度為0.5mmol/L時,產率達到最大,且之后隨著亞鐵離子濃度的增大,產率基本保持不變。
作為該轉化反應的關鍵底物,Ile的影響尤為重要。由圖8可知,底物濃度對產率的影響呈罩鐘形,隨著底物濃度的增大,產率先增大后減小,在底物濃度為10mmol/L左右達到最大。當?shù)孜餄舛却笥?0mmol/L時,體系表現(xiàn)出明顯的底物抑制。
2.3.2 反應條件對轉化效率的影響
由圖9知該重組菌的全細胞轉化體系在pH值中性左右產率變化不大,在pH值為7.5時產率相對其他略微偏高,隨著pH值的增大,產率逐漸下降。有文獻報道[11],在堿性條件下,構成細胞細胞膜的雙脂層可能被部分溶解,擴大了細胞通道,有利于產物可底物的進出細胞,從而使細胞表現(xiàn)出更高的酶活性,這可能是導致pH值為9.5時產率較高的原因。
反應體系溫度影響菌體細胞所產酶的催化活性[24],由圖10知溫度對該轉化反應影響不大,產率隨著溫度的上升總體呈現(xiàn)先上升后下降的趨勢,在28℃時,轉化反應產率相對較高。
2.3.3 細胞質量分數(shù)對轉化效率的影響
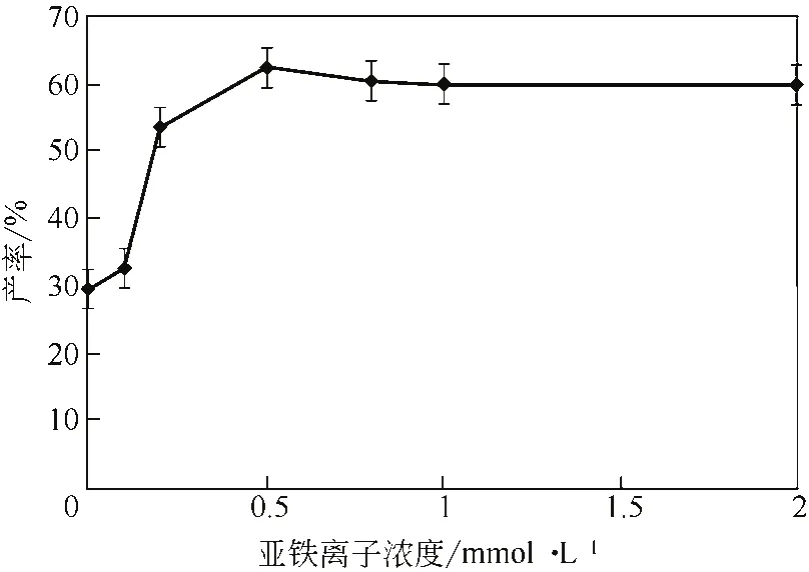
圖7 亞鐵離子濃度對產率的影響
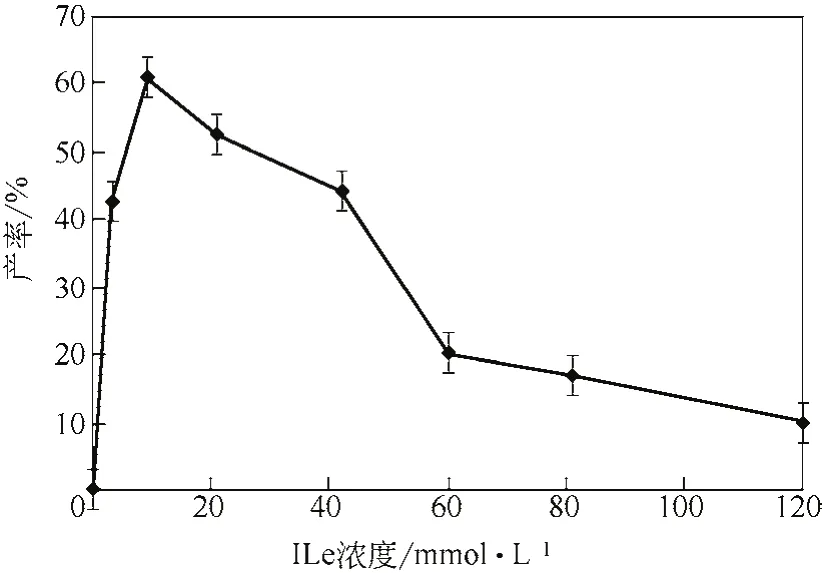
圖8 異亮氨酸濃度對產率的影響

圖9 反應體系pH值對產率的影響
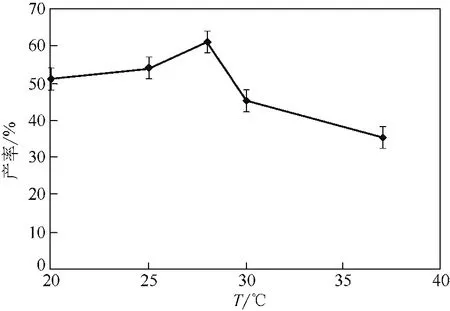
圖10 反應體系溫度對產率的影響
雙加氧酶IDO催化的反應需要氧氣參與,體系中細胞的多少影響著氧氣的利用速率和效果,進而影響反應的產率。由圖11所示,細胞質量分數(shù)對產率的影響與常規(guī)反應現(xiàn)象不同的是,在細胞質量分數(shù)5%時產率已達最高,可達84%,隨著細胞質量分數(shù)的增大,因反應體系黏度過大,物質傳遞以及氧氣供應都受限,產率急劇下降。
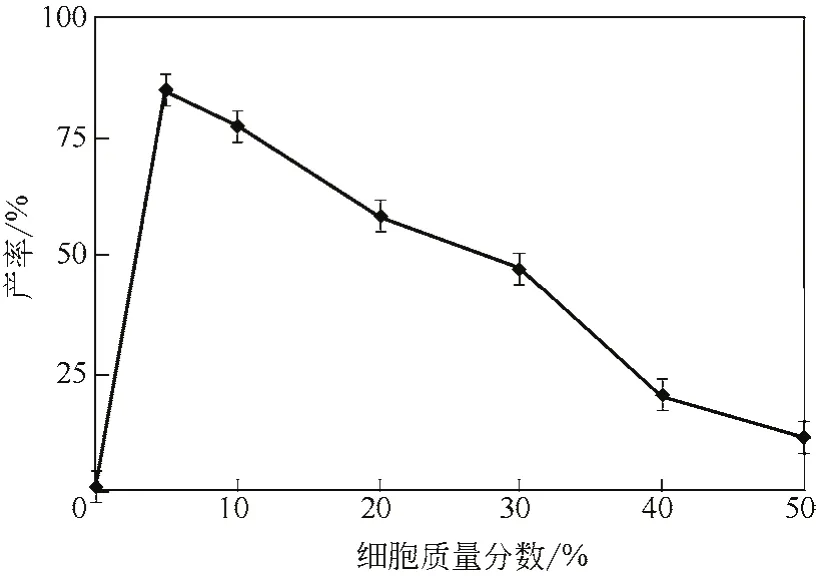
圖11 細胞質量分數(shù)對產率的影響
2.3.4 過夜溫育細胞對轉化效率的影響
根據(jù)文獻[11],在不同溫度(低于酶失活溫度)下處理過的菌體,其細胞結構可能發(fā)生變化,致使部分酶擴散至細胞外,部分消除了物質進出細胞的擴散限制,從而使這種細胞的轉化效果更好。從圖12可以看出,在底物濃度為20mmol/L時,經過20℃、30℃溫育后,體系的轉化產率明顯高于對照組,且在30℃溫育后的菌體的轉化產率達85%以上,因此本研究利用該方法在全細胞轉化體系的底物濃度為20mmol/L時,將轉化率提高至85%以上。
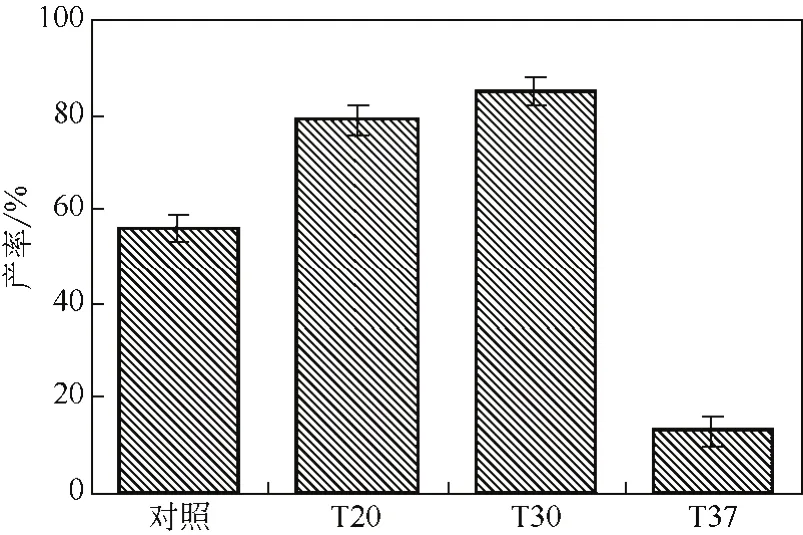
圖12 不同溫度溫育后的菌體的轉化產率
3 結 論
本研究以異亮氨酸Ile為底物,從自然界土樣中篩選得到的芽孢桿菌出發(fā),通過酶標顯色篩選和薄層層析(TLC)篩選得到一株有雙加氧酶IDO活性的菌株,可將L-Ile特異性的轉化成4-羥基-L-異亮氨酸(4-HIL)。通過PCR獲得新型雙加氧酶基因ido,并將其克隆表達,獲得重組菌,對該重組菌的誘導條件進行優(yōu)化,確定最佳誘導條件為0.5 mmol/L的IPTG濃度和30℃的誘導溫度。重組菌誘導表達后獲得的菌體用于全細胞體系的生物轉化反應,檢測到IDO酶特異性催化L-Ile形成的4-HIL,驗證了重組酶的活性。對以上全細胞轉化的反應條件和反應體系進行優(yōu)化,發(fā)現(xiàn)細胞濃度、底物L-Ile、FeSO4·7H2O的配比為5%、10mmol/L、0.5mmol/L,在pH 值為7.5、28℃條件下,轉化效果最好;且當?shù)孜餄舛容^低時,不加α-KG和抗壞血酸即可滿足反應所需,當?shù)孜餄舛容^高時,可適量補充這兩種物質。為增大底物量,本研究采取30℃溫育過夜的細胞來轉化反應,在底物L-Ile 濃度為20mmol/L時,可以達到85%以上的產率。本研究對ido基因的篩選和克隆表達以及對重組菌的轉化反應優(yōu)化、不對稱合成4-HIL的應用提供了基礎。
[1] Wang Q,Ouazzani J,Sasaki N A,et al. A practical synthesis of (2S,3R,4S)-4-hydroxyisoleucine:A potent insulinotropicα-amino acid from fenugreek[J].Eur. J. Org. Chem.,2002,5:834-839.
[2] Rolland-Fulcrand V,Rolland M,Roumestant M L,et al. Chemoenzymatic synthesis of enantiomerically pure (2S,3R,4S)-4-hydroxyisoleucine,an insulinotropic amino acid isolated from fenugreek seeds[J].Eur. J. Org. Chem.,2004,4:873-877.
[3] Ogawa J,Yamanaka H,Mano J,et al. Synthesis of 4-hydroxyisoleucine by the aldolase–transaminase coupling reaction and basic characterization of the aldolase fromArthrobacter simplexAKU 626[J].Bioscience,Biotechnology,and Biochemistry,2007,71(7):1607-1615.
[4] Smirnov S V,Samsonova N N,Novikova A E,et al. A novel strategy for enzymatic synthesis of 4-hydroxyisoleucine:identification of an enzyme possessing HMKP (4-hydroxy-3-methyl-2-keto-pentanoate) aldolase activity[J].FEMS Microbiol. Lett.,2007,273(1):70-77.
[5] Haefelé C,Bonfils C,Sauvaire Y. Characterization of a dioxygenase fromTrigonella foenum-graecuminvolved in 4-hydroxyisoleucine biosynthesis[J].Phytochemistry,1997,44(4):563-566.
[6] Kodera T,Smirnov S V,Samsonova N N,et al. A novel l-isoleucine hydroxylating enzyme,l-isoleucine dioxygenase from Bacillus thuringiensis,produces (2S,3R,4S)-4-hydroxyisoleucine[J].Biochem. Biophys. Res. Commun.,2009,390(3):506-510.
[7] Hibi M,Kawashima T,Kodera T,et al. Characterization ofBacillus thuringiensisL-isoleucine dioxygenase for production of useful amino acids[J].Appl. Environ. Microbiol.,2011,77(19):6926-6930.
[8] Ogawa J,Kodera T,Smirnov S V,et al. A novel l-isoleucine metabolism inBacillus thuringiensisgenerating (2S,3R,4S)-4-hydroxyisoleucine,a potential insulinotropic and anti-obesity amino acid[J].Appl. Microbiol. Biotechnol.,2011,89 (6):1929-1938.
[9] Smirnov S V,Kodera T,Samsonova N N,et al. Metabolic engineering ofEscherichia colito produce (2S,3R,4S)-4-hydroxyisoleucine[J].Appl. Microbiol. Biotechnol.,2010,88(3):719-726.
[10] Joern J M,Sakamoto T,Arisawa A,et al. A versatile high throughput screen for dioxygenase activity using solid-phase digital imaging[J].Journal of Biomolecular Screening,2001,6(4):219-223.
[11] 趙玉巧,許建和. 不動桿菌靜息細胞催化拆分外消旋環(huán)戊酮醇乙酸酯反應條件的優(yōu)化[J]. 催化學報,2003,8(24):613-618.
[12] Matsumura E,Ooi S,Murakami S,et al. Constitutive synthesis,purification,and characterization of catechol 1,2-dioxygenase from the aniline-assimilating bacteriumRhodococcussp. AN-22[J].J. Biosci. Bioeng.,2004,98(2):71-76.
[13] Wang C L,You S L,Wang S L. Purification and characterization of a novel catechol 1,2-dioxygenase fromPseudomonas aeruginosawith benzoic acid as a carbon source[J].Process Biochem.,2006,41 (7):1594-1601.
[14] Yeo C C,Wong M V M,F(xiàn)eng Y,et al. Molecular characterization of an inducible gentisate 1,2-dioxygenase gene,xlnE,fromPseudomonas alcaligenesNCIMB 9867[J].Gene,2003,312:239-248.
[15] Zhou N Y,F(xiàn)uenmayor S L,Williams P A.naggenes ofRalstonia(formerlyPseudomonas) sp. strain U2 encoding enzymes for gentisate catabolism[J].J. Bacteriol.,2001,183(2):700-708.
[16] Suárez M,F(xiàn)errer E,Martín M. Purification and biochemical characterization of gentisate 1,2-dioxygenase fromKlebsiella pneumoniaeM5a1[J].FEMS Microbiol. Lett.,1996,143(1):89-95.
[17] Gunsch C K,Cheng Q,Kinney K A,et al. Identification of a homogentisate-1,2-dioxygenase gene in the fungus Exophiala lecanii-corni:Analysis and implications[J].Appl. Microbiol. Biotechnol.,2005,68(3):405-411.
[18] Gopal B,Madan L L,Betz S F,et al. The crystal structure of a quercetin 2,3-dioxygenase from Bacillus subtilis suggests modulation of enzyme activity by a change in the metal ion at the active site (s)[J].Biochemistry,2005,44(1):193-201.
[19] Smirnov S V,Sokolov P M,Kodera T,et al. A novel family of bacterial dioxygenases that catalyse the hydroxylation of free l-amino acids[J].FEMS Microbiol. Lett.,2012,331(2):97-104.
[20] Fusetti F,Schr?ter K H,Steiner R A,et al. Crystal structure of the copper-containing quercetin 2,3-dioxygenase fromaspergillus japonicus[J].Structure,2002,10(2):259-268.
[21] Que L,Widom J,Crawford R. 3,4-Dihydroxyphenylacetate 2,3-dioxygenase. A manganese (Ⅱ) dioxygenase fromBacillus brevis[J].Journal of Biological Chemistry,1981,256(21):10941-10944.
[22] Wolgel S,Dege J,Perkins-Olson P,et al. Purification and characterization of protocatechuate 2,3-dioxygenase fromBacillus macerans:A new extradiol catecholic dioxygenase[J].J. Bacteriol.,1993,175(14):4414-4426.
[23] 聶堯,付敏杰,徐巖. 不同微生物來源的加氧酶及其催化反應特征的研究進展[J]. 生物加工過程,2013,11(1):87-93.
[24] 張笮晦,劉雄民,馬麗,等. 生物催化肉桂醇制備3-苯丙醇[J]. 化工進展,2010,29(12):2368-2372.
A novel isoleucine dioxygenase and its expression in recombinant Escherichia coli for synthesis of 4-hydroxyisoleucine
FU Minjie1,NIE Yao1,MU Xiaoqing1,XU Yan1,2,XIAO Rong3
(1School of Biotechnology,Key Laboratory of Industrial Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122,Jiangsu,China;2State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,
Jiangsu,China;3Center for Advanced Biotechnology and Medicine,Rutgers University,New Jersey 08854,USA)
:Isoleucine dioxygenase (IDO) could hydroxylyze L-isoleucine (L-Ile) to produce 4-hydroxy-L-isoleucine (4-HIL),which increases glucose-induced insulin release and is usually used in pharmaceuticals with antidiabetic and cholesterol-reducing properties. The strain with dioxygenase activity was screened from natureviacombination of reaction coloration assayed by spectrophotometer and thin-layer chromatography (TLC). The gene encoding IDO (ido) was cloned and expressed inEscherichia coliand the constructed recombinant strain exhibited the function of isoleucine hydroxylation. The reaction conditions were optimized and the yield of transformation with the recombinant whole cells was increased to more than 85% by incubating the cells overnight at 30℃. The newly identified IDO and involved recombinant whole cells would be promising to prepare 4-HIL with high efficiency.
isoleucine dioxygenase; isoleucine; hydroxyl isoleucine; biotransformation; recombinant expression
Q 815
A
1000-6613(2014)11-3037-08
10.3969/j.issn.1000-6613.2014.11.034
2014-02-27;修改稿日期:2014-03-24。
國家重點基礎研究發(fā)展計劃(2011CB710800)、國家高技術研究發(fā)展計劃(2011AA02A209、2011AA02A210)、國家自然科學基金(21376107、21336009)、高等學校學科創(chuàng)新引智計劃(111計劃)(111-2-06)、高端外國專家項目(GDW20133200113)及江蘇高校優(yōu)勢學科建設工程項目。
付敏杰(1988—),女,碩士研究生。E-mail jieminfu@yeah. net聯(lián)系人:聶堯,教授,博士生導師,研究方向酶技術。E-mail ynie@ jiangnan.edu.cn。徐巖,教授,博士生導師。E-mail yxu@jiangnan.edu.cn。

