黃芩素對宮頸癌Hela細胞增殖的抑制作用及機制探討
盧科蓮,喻小蘭,夏紀毅,毛熙光
(1瀘州市婦幼保健院,四川瀘州646000;2瀘州市龍馬潭區婦幼保健院;3瀘州醫學院;4瀘州醫學院藥物與功能性食品研究中心;5瀘州醫學院附屬醫院)
宮頸癌是全球女性發病率僅次于乳腺癌的惡性腫瘤,嚴重影響婦女的健康[1]。宮頸癌的發生與發展、浸潤與轉移的過程非常復雜,其中又涉及多種基因的調控。黃芩素是中藥黃芩的主要成分之一,具有抗炎、抗氧化、免疫調節以及抑制腫瘤等作用[2]。Wang 等[3]發現,黃芩素可以有效抑制MDA-MB-231細胞的黏附、轉移及侵襲。黃芩水提物可以明顯抑制宮頸癌Hela細胞的體外生長,與藥物的作用時間和濃度呈正相關[4]。2013年6~11月,我們觀察了黃芩素對宮頸癌Hela細胞增殖的抑制作用,并探討其可能機制。
1 材料與方法
1.1 材料 宮頸癌Hela細胞株(瀘州醫學院附屬醫院醫學實驗中心惠贈),DMEM高糖培養基(Hyclone公司),黃芩素(Chengdu Must Bio-Techology公司),細胞周期檢測試劑盒(南京凱基公司),明膠(Sigma公司),其余SDS-PAGE膠成分(北京索萊寶公司),5×上樣緩沖液、4×上樣緩沖液、考馬斯藍、脫色液、裂解液RIPA(強)及小鼠抗人β-actin抗體(碧云天公司),蛋白酶抑制劑及磷酸化蛋白酶抑制劑(Roche公司),兔抗人MMP-2抗體、兔抗人MMP-9抗體、兔抗人Ras抗體、兔抗人CyclinD1抗體及兔抗人Integrinβ1抗體(CST公司),RT-PCR 試劑盒(天根公司)。MMP-2、MMP-9、Ras、細胞周期素D1(CyclinD1)及整合素β1(Integrinβ1)引物由上海生工公司合成。
1.2 細胞培養 用含有100 mL/L滅活胎牛血清及100 mol/mL青霉素、100 μg/mL鏈霉素的DMEM高糖培養基培養Hela細胞。置于37℃、50 mL/L CO2細胞孵箱常規培養。
1.3 細胞分組及干預 ①取對數生長期的細胞,用2.5 g/L胰酶消化后接種到直徑為10cm的一次性培養皿中(接種數量1.5×106個/皿),等待細胞貼壁生長24 h后,換無血清DMEM高糖培養基培養同步化處理24 h,用含有不同濃度(0、100、200、300 μmol/L)黃芩素的無血清DMEM高糖培養基培養12、24、48 h。②相差顯微鏡下觀察,與C組相比較,干預12 h時,各干預組的細胞數量、形態變化不大;干預24 h時,300 μmol/L組細胞大量死亡,病死率約90%;48 h時,各干預組細胞大量死亡,病死率80% ~90%,無實驗意義,最終選擇以下3組,A組加入100 μmol/L黃芩素,B組加入200 μmol/L黃芩素,C組加入不含黃芩素的無血清DMEM高糖培養基,每組設3個復孔。
1.4 細胞形態及數量變化觀察 相差顯微鏡下觀察細胞形態及數量的變化。同1.2及1.3培養細胞后,含不同終濃度(0、100、200 μmol/L)的黃芩素無血清DMEM高糖培養基培養24 h。通過顯微鏡觀察其形態及數量的變化。為了防止其他因素的影響,實驗培養3次,觀察3次實驗結果是否一致。
1.5 細胞周期檢測 采用流式細胞技術。采用南京凱基細胞周期檢測試劑盒進行檢測,與細胞培養時消化細胞一致,消化細胞后,用1 mL無菌PBS重新懸浮細胞,2 000 r/min,5 min離心,小心移去上清液;加入 0.5 mL Solution Buffer輕輕懸浮細胞,2 000 r/min,5 min離心,小心移去上清液;再加入0.5 mL Solution Buffer輕輕懸浮細胞,2 000 r/min,5 min離心,小心移去上清液;加入250 μL Solution A,輕輕懸浮細胞,25℃孵育10 min;在此溶液中加入200 μL的Solution B,輕輕懸浮細胞,25℃孵育10 min;最后加入 200 μL Solution C,輕輕懸浮細胞,4℃避光10 min;上機檢測(儀器為BD Verse),記錄激發波長488 nm處紅色熒光。使用儀器自帶專用軟件成圖及數據,然后進行數據的統計分析。
1.6 細胞培養基中MMP-2、MMP-9活性檢測 采用明膠酶譜法。黃芩素干預24 h后,統一收集各組細胞的細胞培養基,100 μL/管進行分裝,置于-80℃保存、備用。每組取12 μL上清與4 μL的4×上樣緩沖液均勻混合,靜置于室溫10 min后,電泳。電泳結束后把膠放入含10%TRITON X-100的復性液中恢復活性2次,20 min/次;超純水漂洗膠2次,20 min/次;加入孵育液,置于37℃水浴鍋中,恒溫、過夜。考馬斯藍染色1 h后,脫色2 h。膠放入Bio-Rad成像儀中成像后,Quantity One軟件分析其灰度值,以條帶平均光密度值(MOD)表示。
1.7 細胞 MMP-2、MMP-9、Ras、CyclinD1、Integrinβ1 mRNA表達檢測 采用RT-PCR法。所有操作根據試劑盒操作步驟進行。Quantity One軟件分析其灰度值,以條帶平均光密度值表示,以β-actin平均光密度值進行標準校正。
1.8 細胞 MMP-2、MMP-9、Ras、CyclinD1、Integrinβ1蛋白表達檢測 采用Western blotting法。宮頸癌Hela細胞用預冷、無菌PBS液沖洗3次后,加入裂解液提取總蛋白,沸水變性5 min,-20℃保存備用。10%SDS-PAGE膠電泳,電泳結束后進行轉膜,時間約60 min。封閉1 h,用1×TBST輕柔漂洗5 min,一抗4℃孵育過夜(一抗 MMP-2、MMP-9稀釋比例為1∶500,Ras稀釋比例為1∶600,CyclinD1 稀釋比例為 1∶800,Integrinβ1 稀釋比例為 1∶1 000,βactin稀釋比例為1∶2 000),取出PVDF膜充分漂洗2次,20 min/次。放入二抗中(分為 HRP羊抗兔IgG(H+L)及HRP羊抗小鼠IgG(H+L),二抗稀釋比例均為1∶2 000),室溫孵育1 h。漂洗 4次,5 min/次。放入 Bio-Rad成像儀進行成像并使用Quantity One軟件分析。其灰度值以條帶平均光密度值表示,以β-actin平均光密度值進行標準校正。
1.9 統計學方法 采用SPSS16.0統計軟件。計量資料以±s表示,采用單因素方差分析,組間兩兩比較采用LSD分析。P≤0.05為差異有統計學意義。
2 結果
2.1 細胞數量及形態變化比較 與C組相比較,A、B組細胞數量減少,細胞形態發生變化,從不規則類圓形轉變為多角梭形。
2.2 細胞周期變化比較 A、B、C組S期細胞百分比分別為 24.58%、19.41%、34.05%,G1期百分比分別為 72.67%、79.17%、64.88%,A、B 組與 C 組比較,P 均 <0.05。
2.3 細胞培養基中MMP-2、MMP-9活性比較 結果見表1。
表1 各組細胞培養基中MMP-2、MMP-9活性比較(±s)

表1 各組細胞培養基中MMP-2、MMP-9活性比較(±s)
注:與 C 組比較,*P <0.05,△P <0.01
組別 MMP-2活性 MMP-9活性A 組 32.651±0.571 33.217±0.660*B 組 28.987±1.033* 29.277±0.868△C組36.127±1.184 39.613±0.318
2.4 細胞 MMP-2、MMP-9、Ras、CyclinD1、Integrinβ1 mRNA表達比較 結果見表2。
表 2 各組細胞 MMP-2、MMP-9、Ras、CyclinD1、Integrinβ1 mRNA 表達比較(±s)
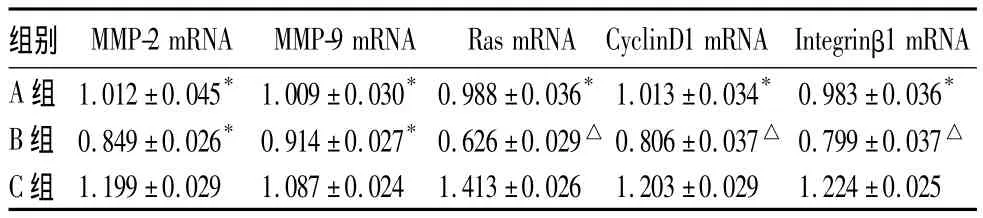
表 2 各組細胞 MMP-2、MMP-9、Ras、CyclinD1、Integrinβ1 mRNA 表達比較(±s)
注:與C 組比較,*P <0.05,△P <0.01
組別 MMP-2 mRNA MMP-9 mRNA Ras mRNA CyclinD1 mRNA Integrinβ1 mRNA A 組 1.012±0.045* 1.009±0.030*0.988±0.036*1.013±0.034* 0.983±0.036*B 組 0.849±0.026* 0.914±0.027*0.626±0.029△ 0.806±0.037△ 0.799±0.037△C 組 1.199±0.029 1.087±0.024 1.413±0.026 1.203±0.029 1.224±0.025
2.5 細胞 MMP-2、MMP-9、Ras、CyclinD1、Integrinβ1 蛋白表達比較 結果見表3。
表 3 各組細胞 MMP-2、MMP-9、Ras、CyclinD1、Integrinβ1 蛋白表達比較(±s)

表 3 各組細胞 MMP-2、MMP-9、Ras、CyclinD1、Integrinβ1 蛋白表達比較(±s)
注:與C 組比較,*P <0.05,△P <0.01
組別 MMP-2蛋白 MMP-9蛋白 Ras蛋白 CyclinD1蛋白 Integrinβ1蛋白A 組 0.693±0.025* 0.886±0.032*1.127±0.028*1.061±0.028* 1.159±0.031*B 組 0.326±0.022△ 0.754±0.024*0.782±0.183*0.321±0.027△ 0.481±0.028△C 組 1.914±0.031 1.487±0.016 1.323±0.303 1.816±0.025 1.467±0.036
3 討論
宮頸癌的發生、發展是一個緩慢的漸進過程,也是一個由多因素相互作用的連續而復雜的過程。涉及細胞無序生長、細胞外基質(ECM)被降解、原發瘤細胞突破基底膜侵入間質、瘤細胞在間質中移行并接觸脈管、瘤細胞突破血管內皮及其下基底膜進入血流,并在血中存活、瘤細胞穿出血管后在組織中存活增殖,形成轉移灶。所以,浸潤和轉移是宮頸癌療效差、預后不良的重要因素。其侵襲和轉移過程中必需穿透一系列天然組織屏障:如基底膜和ECM,合成及分泌大量基質降解酶,降解ECM是腫瘤細胞侵襲、轉移的重要步驟[5]。只有完成了對ECM的降解才使腫瘤細胞突破ECM構成的結構屏障,向周圍組織侵襲或進入血循環或淋巴系統[6]。
MMPs是迄今為止發現與腫瘤侵襲和轉移關系最密切的一類蛋白水解酶,能降解ECM的絕大多數成分。大量研究表明,在食管癌、胃癌、膀胱癌、卵巢癌、前列腺癌等腫瘤中MMPs的表達明顯高于正常組織,而MMPs家族中以明膠酶類的MMP-2、MMP-9尤為重要,與腫瘤的侵襲和轉移密切相關[7,8]。李現東[9]認為,黃芩素可以抑制肺癌細胞A549的增殖遷移并誘導其凋亡。王洪飛等[10]發現,黃芩素不但對人乳腺癌細胞株MCF-7的增殖活性具有抑制作用并促進其凋亡,它的這種作用還呈時間—劑量依賴性。
CyclinD1是細胞周期的正調節因子,跟細胞周期G1期緊密相關,其表達的增加與細胞增殖失控有關。它與細胞周期蛋白依賴性激酶結合后,促使細胞從G1期順利進入S期,使細胞發生分裂與增殖,因此CyclinD1蛋白的過度表達會使增殖周期不斷進行,導致腫瘤的發生[11]。研究[11~13]發現,在宮頸癌中 CyclinD1表達高于正常組織,在宮頸癌的發生、發展中起到重要的作用,其表達水平與臨床分期、病理分級及淋巴結轉移密切相關。另有研究[14,15]認為,CyclinD1基因的擴增和過表達與肝癌的侵襲性和較高的腫瘤分期有關。同時研究[16~18]顯示,Ras癌基因可以通過上調CyclinD1的表達加速細胞周期的進程,同時激活的Ras信號通路使CyclinD1積聚,導致細胞進入靜息狀態,提示Ras誘導腫瘤發生的作用機制之一可能是通過對細胞周期素的調控改變細胞周期的進程實現的。是否Ras及CyclinD1參與了黃芩素干預宮頸癌Hela細胞增殖抑制的過程?Ras和CyclinD1之間是否仍存在相互作用關系?我們的前期實驗結果表明,黃芩素干預宮頸癌Hela細胞后,將細胞阻滯于G1期,下調Ras和CyclinD1 mRNA、蛋白表達水平,與喻小蘭等[19]實驗結果相符。
Integrin β1在多種腫瘤細胞和實體瘤中高表達,并且與腫瘤細胞的浸潤和轉移密切相關,整合素的細胞內片段通過紐蛋白、輔肌蛋白、踝蛋白及整合素連接激酶與細胞骨架鏈接,參與細胞運動。抗Integrinβ1抗體明顯抑制腫瘤細胞對膠原蛋白Ⅳ的黏附,而膠原蛋白Ⅰ、Ⅳ是ECM的重要組成部分,這提示Integrinβ1在腫瘤細胞與ECM的黏附過程中必不可少。所以研究黃芩素對宮頸癌Hela細胞的浸潤、侵襲的影響,就需要研究與ECM聯系緊密的Integrinβ1。
本研究顯示,A、B組細胞數量較C組減少,細胞形態發生變化,從不規則類圓形轉變為多角梭形,提示黃芩素可致細胞增生受到抑制,受抑制程度與黃芩素干預濃度呈正相關。A、B組S期細胞百分比較C組少,G1期百分比較C組多,提示細胞周期G1期受到阻滯,阻滯程度與黃芩素干預濃度相關。A組MMP-9活性及B組MMP-2、MMP-9活性低于C組,提示MMP-2和MMP-9活性明顯受到抑制。A、B組 MMP-2、MMP-9、Ras、CyclinD1、Integrinβ1 mRNA 水平低于 C 組,提示MMP-2、MMP-9、Ras、CyclinD1 及 Integrinβ1 mRNA 表達隨黃芩素濃度的增加而降低,降低程度與黃芩素濃度相關。A、B 組 MMP-2、MMP-9、Ras、CyclinD1、Integrinβ1蛋白水平低于 C 組,提示 MMP-2、MMP-9、Ras、CyclinD1及Integrinβ1蛋白水平的表達明顯受到抑制,受抑制程度與黃芩素濃度相關。
[1]王淑珍,羅好曾.武威市宮頸癌發病率分析[J].中國腫瘤,2008,17(2):96-97.
[2]許杜鵑,陳敏珠.黃芪總提物抗腫瘤作用及機制的研究[J].中華中醫雜志,2006,21(12):771-772.
[3]Wang L,Ling Y,Chen Y,et al.Flavonoid baicalein suppresses adhesion,migration and invasion of MDA-MB-231 human breast cancer cells[J].Cancer Letters,2010,297(1):42-48.
[4]張曉金,歸綏琪.宮頸癌發病機制的研究進展[J].中國婦幼健康研究,2008,19(1):56-59.
[5]馮樹,宋今丹.參與腫瘤侵襲和轉移的細胞外基質降解酶[J].腫瘤防治研究,1999,26(1):72-76.
[6]薛洋,周清華,張尚福,等.MMP-2/MMP-9在肺癌中的表達及其與肺癌轉移后預后關系的研究[J].華西醫學,2008,23(2):225-228.
[7]Zhang M,Zhu GY,Gao HY,et al.Expression of tissue level of matrix metalloproteinases and tissue inhibitors of metalloproteinases in gastric adenocarcinoma[J].J Surg Oncol,2011,103(3):243-247.
[8]Wang L,Ling Y,Chen Y,et al.Flavonoid baicalein suppresses adhesion,migration and invasion of MDA-MB-231 human breast cancer cells[J].Cancer Letts,2010,297(1):42-48.
[9]李現東.漢黃芩素對肺癌細胞株A549的體外作用研究[J].重慶醫科大學學報,2011,36(7):790-792.
[10]王洪飛,肖秀麗.黃芩素對人乳腺癌細胞株MCF-7體外增殖和凋亡的影響[J].瀘州醫學院學報,2012,4(1):43-46.
[11]郭艷萍,楊廣英,王建君,等.PTEN、STAT3和CyclinD1蛋白在宮頸癌中的表達及意義[J].中國婦幼保健,2012,27(15):2344-2346.
[12]劉文鳳,王言奎,呂艷,等.宮頸癌組織CyclinD1和P27表達及意義[J].齊魯醫學雜志,2011,26(5):405-408,411.
[13]王一娜,童亞非.CyclinD1與P27在宮頸鱗狀細胞癌組織中的表達及相關性[J].泰山醫學院學報,2013,34(11):816-819.
[14]Azechi H,Nishida N,Fukuda Y,et al.Disruption of the p16/cyclin D1/retinoblastoma protein pathway in the majority of humanhepatocellular carcinomas[J].Oncology,2001,60(4):346-354.
[15]Choi YL,Park SH,Jang JJ,et al.Expression of the G1-S modulators in hepatitis B virus-related hepatocellular carcinoma and dysplasticnodule:association of cyclin D1 and p53 proteins with the progression of hepatocellular carcinoma[J].J Korean Med Sci,2001,16(4):424-432.
[16]Akuwa N,Takuwa Y.Regulation of cell cycle molecules by the Ras effector system[J].Mol Cell Endocrinol,2001,177(1):25-33.
[17]Ktas H,Cai H,Cooper GM.Ras links growth factor signaling to the cell cycle machinery via regulation of cyclin D1 and the Cdk inhibitor p27KIP1[J].Mol Cell Biol,1997,17(7):3850-3857.
[18]Coleman ML,Marshall CJ,Olson MF,et al.Ras promotes p21(Waf1/Cip)1protein stability via a cyclin D1-imposed block in proteasome-mediated degradation[J].Emboj,2003,22(9):2036-2046.
[19]喻小蘭,盧科蓮,夏紀毅,等.Ras、CyclinD1在宮頸癌腫的表達及黃芩素對其表達的影響[J].繼續醫學教育,2014,28(2):19-22.

