“鲆優1號”牙鲆和親本群體的表型及遺傳性狀變異分析
田永勝,齊文山,2,姜靜,2,王磊,3,張英平,2,劉萬軍,3,陳紅林,2,陳松林*
(1.中國水產科學研究院黃海水產研究所,海洋漁業可持續發展重點實驗室,山東青島 266071;2.上海海洋大學水產與生命學院,上海,201306;3.中國海洋大學海洋生命學院,山東青島 266003)
“鲆優1號”牙鲆和親本群體的表型及遺傳性狀變異分析
田永勝1,齊文山1,2,姜靜1,2,王磊1,3,張英平1,2,劉萬軍1,3,陳紅林1,2,陳松林1*
(1.中國水產科學研究院黃海水產研究所,海洋漁業可持續發展重點實驗室,山東青島 266071;2.上海海洋大學水產與生命學院,上海,201306;3.中國海洋大學海洋生命學院,山東青島 266003)
牙鲆是我國及大西洋沿岸天然捕撈和養殖的主導品種,對其遺傳資源保護及養殖新品種開發具有重要的意義。本文對人工培育的牙鲆養殖新品種“鲆優1號”(ZJ)、其父本韓國牙鲆群體(KS)、母本F0750家系(JX)的18個表型性狀進行測量,利用SSPS程序進行方差分析和多重比較,發現體長/體寬,頭長/眼徑,頭長/眼間距、眼徑/眼間距,側線鱗和尾鰭條6個性狀與父本或母本具有顯著性差異(p<0.05),可做為鑒別“鲆優1號”的標志性表型性狀。“鲆優1號”與母本無顯著差異(p>0.05)性狀占50%。與父本無顯著性差異(p>0.05)性狀占33.33%。篩選了24個多態性微衛星引物對KS、JX、ZJ和FJ的遺傳多樣性進行分析,總共擴增出143個等位基因。4個群體的平均等位基因數(Na)大于平均有效等位基因數(Nae),平均觀測雜合度大于平均期望雜合度,多態信息含量(PICa)分析顯示:KS>JX>FJ>ZJ,說明人工選育導致了遺傳雜合度的降低。24個微衛星位點在4個牙鲆群體中的遺傳偏離指數(D)在-0.759 7到0.188 4之間,在KS、JX、ZJ和FJ群體中分別有10、16、11和17個位點顯著(p<0.05)或極顯著(p<0.01)偏離Hardy-Weinberg平衡。24個基因位點的遺傳分化系數(Fst)在0.076 7~0.258 6之間,平均為0.146 8,表明14.68%的變異來自種群間,85.32%的變異來自種群內。Nei's遺傳距離顯著,KS和FJ遺傳距離最近(0.282 5),遺傳相似系數最大(0.753 9);ZJ 與JX遺傳距離最大(0.420 5),遺傳相似系數最小(0.656 7)。本文研究表明:“鲆優1號”具有明顯的表型和遺傳特征,與父母本及反交群體比較發生了一定程度的種內和種群間遺傳分化,為“鲆優1號”的種質鑒別提供了理論依據。
牙鲆,鲆優1號,表型性狀,衛微星標記,遺傳多樣性
1 引言
牙鲆Paralichthys olivaceus是我國主要養殖和捕撈魚類,年產量達到26 477.5 t(2009年),排在鲆鰈魚類產量第二位[1]。但是由于牙鲆苗種養殖成活率低、病害多,極大的限制了養殖產業的發展。為了改善牙鲆的養殖現狀,培育生長快、抗病力強的牙鲆新品種,從21世紀初開始不斷從黃渤海海域收集了當地野生牙鲆群體,利用人工選擇方法篩選出抗鰻弧菌牙鲆群體[2],并從日本、韓國引進了牙鲆群體,構建了牙鲆育種基礎群體。通過家系建立和篩選、抗病力測定、后裔鑒定、家系間雜交等方法[3],于2010年培育出一個生長快、成活率高的牙鲆新品種“鲆優1號”[4]。但是對“鲆優1號”牙鲆的生物學性狀及分子遺傳性狀的研究至今還未有研究,為了查明“鲆優1號”標志性表型特征,以及與其父母本的遺傳區別,本文對“鲆優1號”群體、韓國牙鲆群體、優良家系F0750群體及其反交后代群體的表型性狀和微衛星標記遺傳性狀進行了研究。
表型性狀被大量應用于魚類傳統分類,但近年來相關研究報告極少,在牙鲆形態性狀研究方面,劉永新和劉金海對牙鲆家系早期形態性狀進行了分析[5],在魚類分類和種質鑒別方面,近年來人們大都傾向于利用分子標記對魚類種群進行鑒定和分析。其中微衛星標記被廣泛應用于遺傳圖譜構建、QTL定位、親子鑒定、群體遺傳結構分析等方面,趙瑩瑩等利用微衛星標記對6個虹鱒群體的遺傳多樣性進行了分析[6],全迎春等利用微衛星標記對4個鯉魚群體的遺傳多樣性進行了分析[7],Kang等利用180個微衛星標記和31個EST分子標記構建了牙鲆遺傳連鎖圖譜[8],Song等利用1 624個微衛星標記構建了高密度的牙鲆遺傳連鎖圖譜[9]。Fuji等利用微衛星標記選育出一個抗淋巴囊腫病的牙鲆新品種[10]。可見微衛星標記在魚類種質鑒別、遺傳分析和新品種輔助選育方面具有重要的應用價值,本文試圖將牙鲆育種群體的表型性狀與微衛星標記性狀結合起來,對牙鲆育種群體進行分析,為牙鲆新品種的培育和鑒定探索新的技術途徑。
2 材料和方法
2.1 樣本來源
實驗用牙鲆4個群體樣本均取自山東海陽黃海水產有限公司,“鲆優1號”樣本(ZJ)為2010年建立的優良家系,其父本為韓國牙鲆群體(KS),母本為F0750家系群體(JX);“鲆優1號”具有生長快、成活率高的優點,近年來已經在山東威海、海陽,福建東山等地大面積推廣養殖。韓國群體(KS)為2008年從韓國濟州島收集的牙鲆群體。F0750家系群體(JX)為2007年建立和篩選出的生長快優良家系。鲆優1號反交家系(FJ)是利用KS為母本,F0750為父本建立的全同胞家系。
2.2 牙鲆群體表型性狀測量和分析
2010年10月對生長到2齡的F0750、4齡的韓國牙鲆及當年的“鲆優1號”群體的18個生物學性狀進行了測定,生物學性狀如表2。利用SSPS統計軟件對獲得的表型性狀數據進行單因素方差分析(One-Way ANOVA),采用Student-Newman-Keuls進行多重比較和差異顯著性分析,p<0.05表示具有顯著性差異,p>0.05表示差異不顯著,表型性狀值為平均值±標準差。
2.3 4個牙鲆群體遺傳材料的收集和DNA的提取
以上4個群體各隨機選取30個個體,剪取鰭條后,分別保存于無水乙醇中,-20℃下保存備用。基因組DNA提取按常規酚/氯仿提取方法,將提取的DNA調整濃度至100 ng/μL備用。
2.4 牙鲆基因組DNA的微衛星分析
從牙鲆微衛星引物中挑選24條多態性較高的引物(見表1),由華大基因合成。采用15μL反應體系,含1μL模板DNA,上下游引物各0.4μL,其中1.5 μL 10×PCR緩沖液(TIANGEN,含Mg2+),0.5μL dNTP(CWBIO,2.5 mmol/L),0.1μLTaq DNA聚合酶(TIANGEN,5 U/μL),用滅菌的雙蒸水補充至15 μL。在PCR儀(AB,Alpha-SE)上進行PCR反應,反應程序為:95℃預變性5 min,35個循環(95℃變性30 s,按每對引物的實際退火溫度反應30~40 s,72℃延伸40 s),72℃延伸10 min,4℃保溫。PCR產物經6%的聚丙烯酰胺凝膠電泳后,銀染顯色。
2.5 遺傳數據分析與處理
對照PBR322分子量標準確定每個個體的基因型,利用Popgene軟件計算4個群體的等位基因數(No)、有效等位基因數(Ne)、平均等位基因數(Na)、平均有效等位基因數(Nae)、觀測雜合度(Ho)和期望雜合度(He)。同時計算了各群體的遺傳相似指數、遺傳距離、近交系數(Fis)、遺傳分化指數(Fst)和基因流(Nm)、香農指數(I)和多態信息含量(PIC),并進行Hardy-Weinberg遺傳偏離指數(D)的計算。采取UPGMA方法構建進化樹。
3 結果
3.1 牙鲆不同群體生物學性狀比較
在測量的18個生物學性狀中“鲆優1號”體長/體寬顯著大于父母本,頭長/眼徑顯著小于父母本(p<0.05),頭長/眼間距和眼徑/眼間距顯著大于父母本(p<0.05),側線鱗和尾鰭條顯著多于父母本(p<0.05)。可以將這幾個性狀做為鲆優1號的特征性狀(表2)。
“鲆優1號”的體長/尾柄長、尾柄長/尾柄寬、背鰭條3個性狀與母本F0750無顯著性差異(p> 0.05),但與父本韓國牙鲆有顯著性差異(p<0.05)。其他性狀與父母本都無顯著性差異,“鲆優1號”有9個性狀與母本無顯著差異(p>0.05),占全部性狀的50%。“鲆優1號”有6個性狀與父本無顯著性差異(p>0.05),占全部性狀的33.33%。說明“鲆優1號”與母本的相似性大于父本。
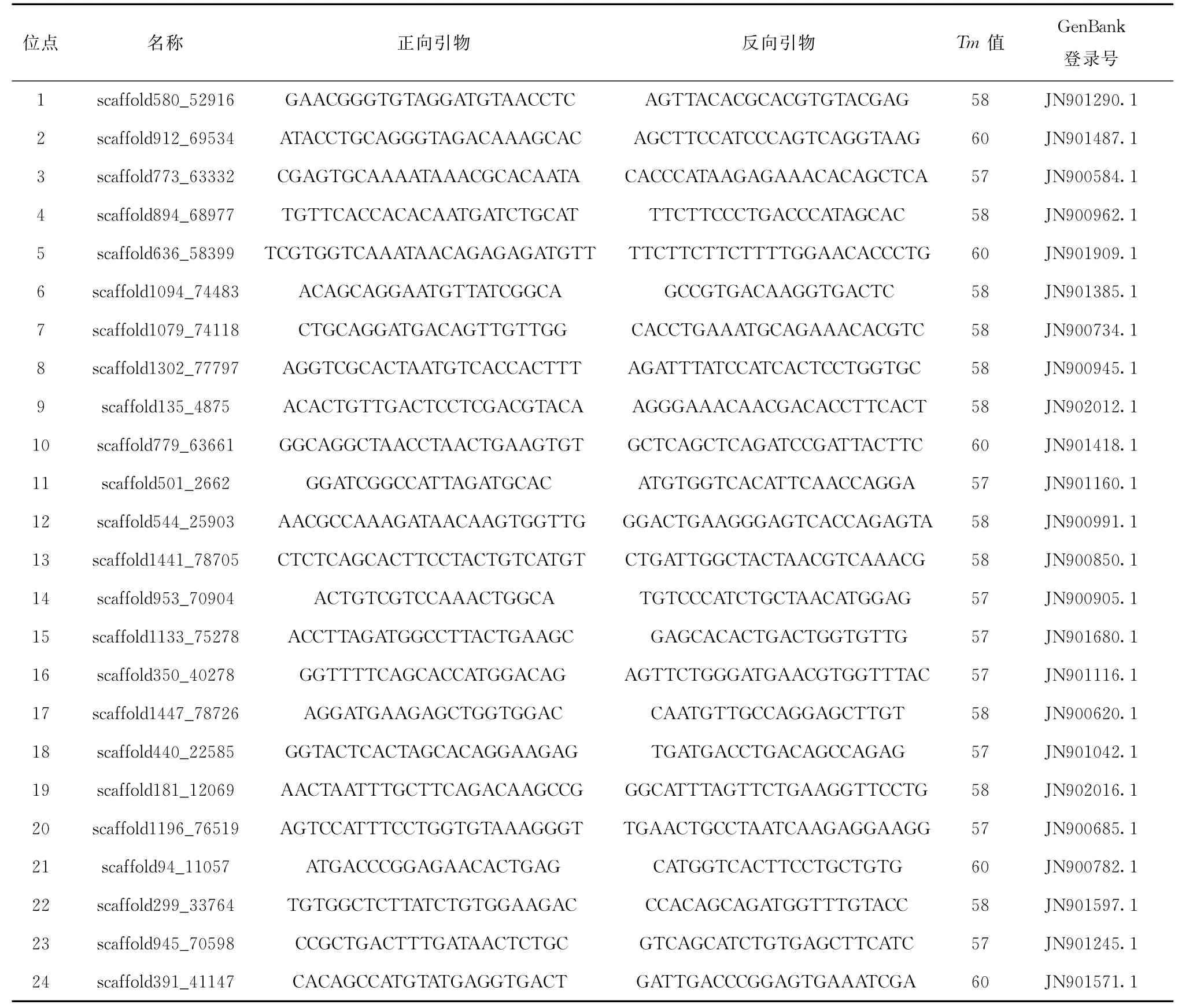
表1 本文中24對SSR位點信息

表2 鲆優1號(ZJ)與F0750家系(JX)、韓國牙鲆(KS)群體生物學性狀比較

續表2

續表2
3.2 微衛星位點的多態性
試驗所用24對微衛星引物均能在的DNA樣品能穩定地擴增出相應條帶,引物scaffold773_63332在4個牙鲆群體中的擴增結果見圖1。各微衛星引物在24個微衛星位點中有19個在4個牙鲆群體中均顯示出了多態性(見表3),而位點5和21在ZJ群、位點9 和19在FJ群、位點15在JX群中僅有1個等位基因,主要原因是由于采集樣本中大部分為全同胞家系個體造成的。24個微衛星位點在KS群中均表現出多態性。24對微衛星標記總共擴增出143個等位基因,等位基因最多的是位點10和21,有9個等位基因,而位點19等位基因最少,有2個等位基因,KS群、JX群、ZJ群和FJ群平均等位基因數(Na)分別為5.833 3、3.583 3、3.291 7和2.791 7;平均有效等位基因數(Nae)分別為3.693 0、2.738 3、2.276 4和2.428 9(見表4),所有位點的有效等位基因數都不大于觀察到的等位基因數。

圖1 位點3(scaffold773_63332)在4個群體中的擴增結果
3.3 牙鲆4個群體遺傳多樣性
在24個微衛星位點中,平均觀測雜合度在0.189 2~1.000 0之間,平均期望雜合度在0.241 6~0.841 5之間(見表5)。KS、JX、ZJ和FJ群體平均觀測雜合度分別為3.693 0、2.738 3、2.276 4和2.428 9,平均期望雜合度分別為0.690 4、0.577 3、0.490 0 和0.527 2。4個群體的Shannon's多樣性指數Ia分別為3.693 0、1.000 0、0.827 0和0.859 9(見表4);24個位點在4個牙鲆群體中大部分表現為中度或高度多態,只有位點19在KS群體,2、7、18位點在ZJ群中表現為低度多態。4個群體的平均多態信息含量PICa分別為0.637 0、0.525 9、0.460 1和0.487 9(見表4),4個群體都屬于高度多態,但“鲆優1號”多態性相對較低。以上數據表明,經過人工選擇后的3個群體(JX,ZJ和FJ)基因多樣性要遠低于韓國群體(KS),且正交和反交群體的基因多樣性要低于父母本群體。
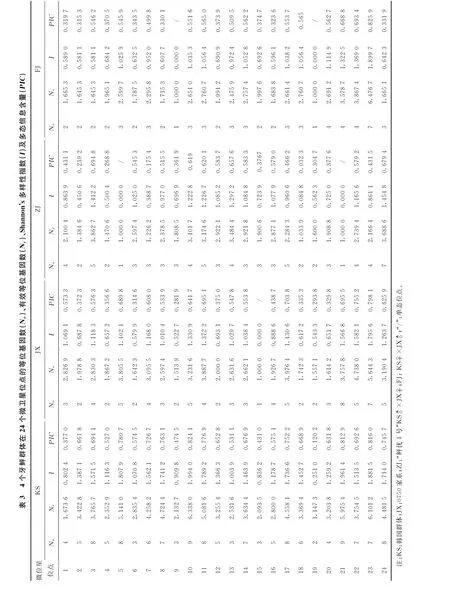

表4 4個牙鲆群體在24個微衛星基因座上的平均等位基因數(Na)、平均有效等位基因數(Nae)、觀測雜合度(Hao)、期望雜合度(Hae)、Nei氏期望雜合度(Nei)、Shannon's多樣性指數(Ia)以及多態信息含量(PICa)
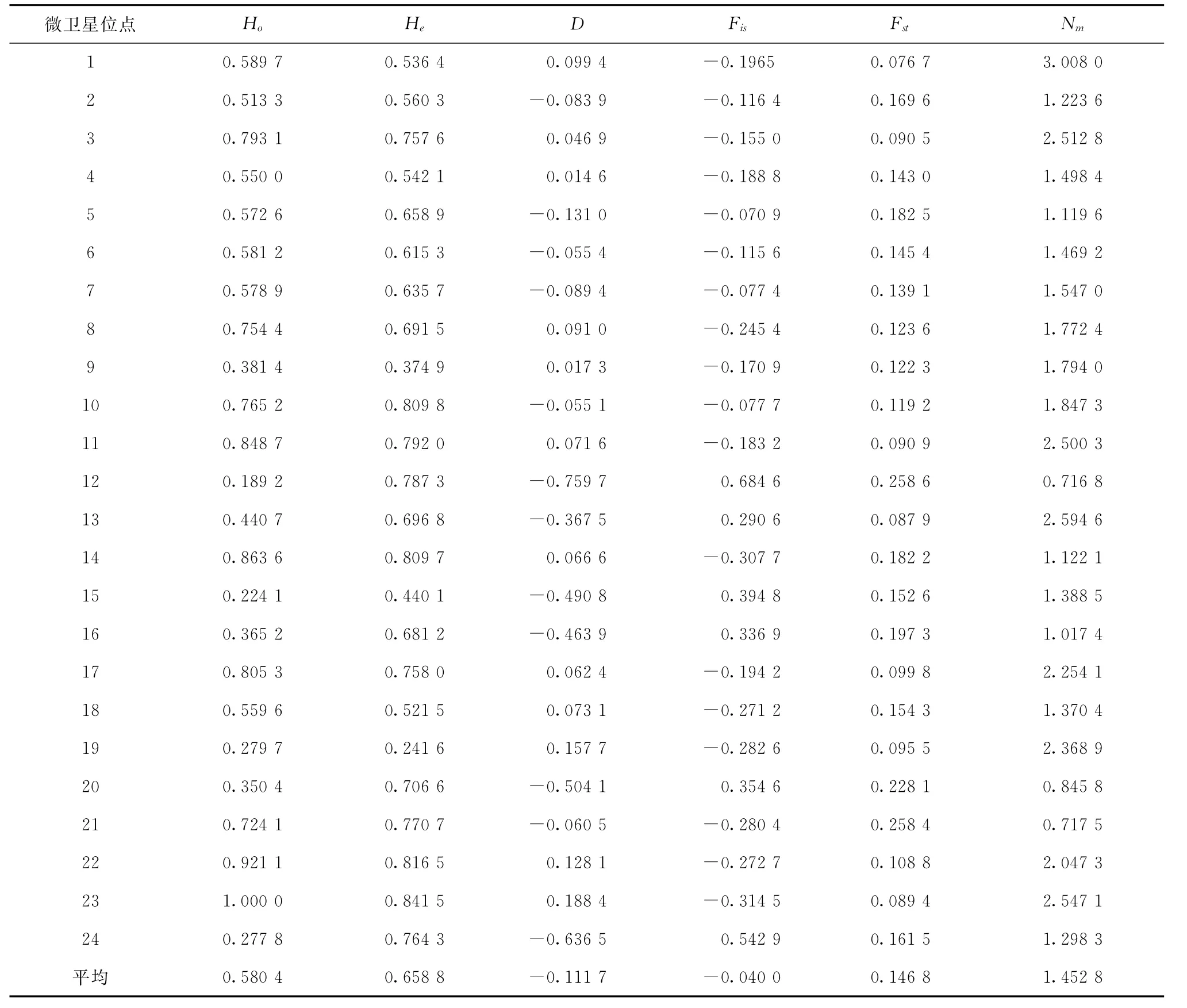
表5 24個微衛星位點在4個牙鲆群體的觀測雜合度(Ho)、期望雜合度(He)、Hardy-Weinberg遺傳偏離指數(D)、遺傳分化信息(Fis,Fst,Nm)
3.4 基因位點遺傳變異
24個基因位點的遺傳分化系數(Fst)和基因流(Nm)分析結果顯示(表5),Fst在0.076 7~0.258 6之間,表明群體間遺傳分化在中等水平以上,其中在位點1遺傳分化最低,在位點12和21遺傳分化最高,各位點的平均遺傳分化指數為0.146 8,表明僅有14.68%的變異由種群間分化導致,而85.32%的變異來自種群內分化。各位點的Nm在0.716 8~3.008 0之間,其數值越大,表明遺傳分化程度越低,因此,這同樣說明位點1在各群體間的遺傳分化程度最低,在位點12和21遺傳分化最高。
3.5 Hardy-Weinberg平衡分析
對24個微衛星位點分別進行等位基因頻率Hardy-Weinberg平衡卡方檢驗和遺傳偏離指數(D)計算。在KS、JX、ZJ和FJ群體中分別有10、16、11和 17個位點顯著(p<0.05)或極顯著(p<0.01)偏離Hardy-Weinberg平衡,F0750(JX)和反交群體(FJ)偏離位點最多。只有位點2(scaffold912_69534)在各群體中符合Hardy-Weinberg平衡(表6)。24個微衛星位點在4個牙鲆群體中的遺傳偏離指數(D)在-0.759 7到0.188 4之間,其中12個位點表現為雜合子過剩(d>0),其余位點均表現為雜合子缺失(d<0)(見表5)。
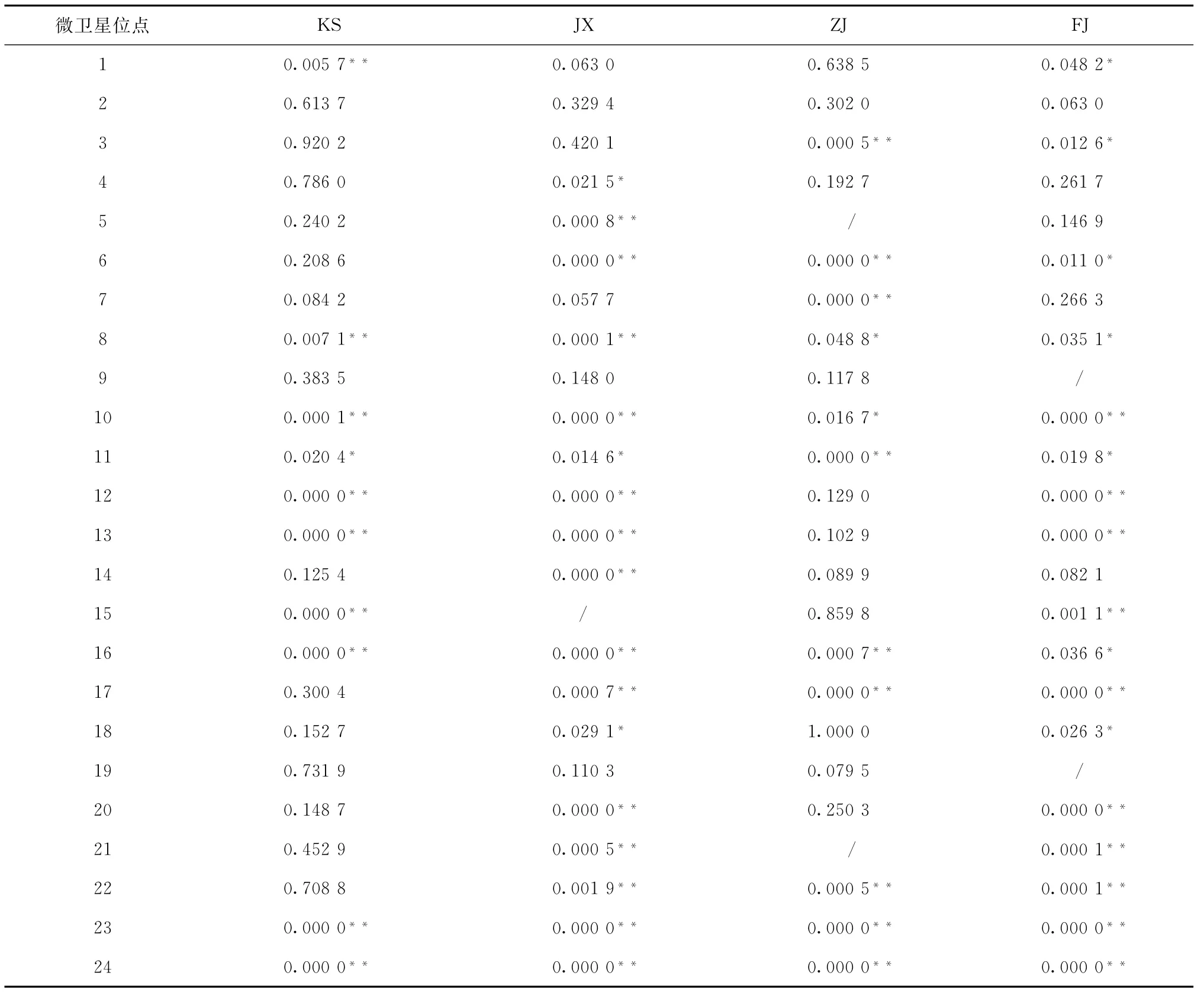
表6 4個牙鲆群體在24個微衛星位點Hardy-Weinberg平衡的卡方檢驗
3.6 牙鲆群體間遺傳距離
各群體間Nei's遺傳距離在0.282 5~0.420 5,平均0.336 7;相似性指數在0.656 7~0.753 9,平均0.714 8(見表7)。KS群體和FJ群體的遺傳距離最近為0.282 5,遺傳相似系數最大為0.753 9;ZJ群體與JX群體的遺傳距離最遠達到0.420 5,其相似性遺傳指數最小0.656 7。根據各群體之間的遺傳距離,采用UPGMA法對4個牙鲆群體進行聚類(見圖2)。結果表明KS群體首先和FJ群體聚為一支,它們再與JX聚為一支,最后與ZJ聚合。

表7 4個牙鲆群體間的Nei's遺傳距離(下)及相似性指數(上)

圖2 牙鲆4個群體UPGMA聚類圖
4 討論
牙鲆主要分布于渤海、黃海、東海、南海及朝鮮、日本、俄國遠東沿岸[11],是這些國家主要捕撈和養殖魚類。分布在我國海域的牙鲆被認為有兩個生態種群,北種群(黃渤海群)1-2月份分布于33°30′~37° 30′N和122°30′~124°0′E,南種群(東海群)1-2月份分布于27°~27°30′N和121°30′~122°30′E[12]。在牙鲆雜交品種“鲆優1號”的培育過程中,最初利用黃海牙鲆種群,日本牙鲆種群,韓國濟州島牙鲆種群,以及利用人工感染鰻弧菌后篩選出的抗病牙鲆群體[2—3]。分布于太平洋西岸的牙鲆在分類上屬于同一個種,但由于地理上的分割,不同的地理群體在外形特征上表現出一定的差異。濟州島牙鲆群體的體色近似于沙灘色,日本牙鲆群體體背具有較大的白色花瓣狀花紋,而黃海牙鲆體背具有白色點狀花紋。形態上的差異是長期地理隔離和環境選擇的結果。利用不同地理群體進行選擇和雜交育種,使不同地理群體的優良性狀得到重組,從而培育出符合人們需求的養殖新品種,是魚類育種主要途徑之一。“鲆優1號”的培育充分利用了分布在太平洋西岸不同環境下牙鲆種群的優良性狀,經過大量家系建立和篩選,從而培育出一個具有生長快、成活率高的牙鲆優良養殖品種。經過幾年來在山東海陽、福建東山島等養殖公司的大量推廣養殖,“鲆優1號”體現出生長快、成活高的優良特點,與當地普通牙鲆相比較,可將苗種養殖生長速度提高20%以上,成活率提高30%以上[4],深受養殖用戶的好評。
表型性狀是判斷一個物種或品種區別于其他品種最直觀的特征,在魚類表型性狀的描述中為了避免不同年齡造成的生長性狀差異,采用了體長/體寬、頭長/眼徑等比例性狀,可有效的減小年齡因素造成的誤差,本文中分析牙鲆4個群體的表型性狀時也采用了這一傳統的方法。表型性狀對于魚類育種群體的篩選和應用可提供直觀的信息,例如對牙鲆11個家系后裔不同時期生長性狀的分析發現,全長貢獻率是形態性狀中最高的[5]。對大菱鲆4個地理群體的生長性能進行分析,發現在生長速度上依次為法國、英國、丹麥和挪威群體[13]。對90日齡大菱鲆全長、體長、頭長、吻長、體高、尾柄高、尾柄長和體質量等8項性狀進行分析,發現其中7個測量性狀與體重的相關系數達到極顯著水平[14],為育種方案的制定提供了一定的依據。本文對“鲆優1號”及其父本韓國牙鲆、母本F0750(日本牙鲆♂×抗病牙鲆♀的雜交后代)的18個生物學性狀進行測量和比較分析,由于韓國牙鲆和F0750都為篩選出的優良親本,在育種中相當珍貴,在測量時只采集了10尾樣本,但經過分析發現其可量性狀和可數性狀的變動已很小,說明此樣本量已能較準確的反映群體的表型性狀。研究發現“鲆優1號”體長/體寬,頭長/眼徑,頭長/眼間距、眼徑/眼間距,側線鱗和尾鰭條6個性狀與父本或母本具有顯著性差異,從此為“鲆優1號”的鑒別找到了標志性的表型性狀。
分子標記在魚類種質鑒別中的應用愈來愈廣;利用RAPD技術分析了奧利亞羅非魚♀×尼羅羅非魚♂正反雜交子代與親本的遺傳相似系數,顯示其反交后代與母本極其相似,而其正交群體的性狀介于親本之間[15]。4個尼羅羅非魚群體Oreochromis niloticus的種群內遺傳相似度為0.745 8~0.815 8[16]。本文利用牙鲆18個表型性狀通過多重比較和顯著性分析,發現“鲆優1號”與母本F0750有50%的性狀無顯著差異(p>0.05),與父本有33.33%的性狀無顯著性差異(p>0.05),說明鲆優1號與母本的相似性大于父本。遺傳距離分析和聚類圖顯示反交群體與父本韓國牙鲆的遺傳距離最近,其次是母本F0750,而正交群體“鲆優1號”與父本遺傳距離相對較遠,與母本遺傳距離相對較近,這一點與表型性狀研究結果具有相似性。利用24個微衛星標記分析顯示“鲆優1號”與母本為遺傳相似性指數反而小于父本。相反“鲆優1號”親本的反交后代與父本韓國牙鲆群體的遺傳距離最近,與母本F0750遺傳距離較遠。是由于分析方法的不同,還是所采用的微衛星標記與表型性狀相關性較低造成,有待于進一步研究。
利用16個微衛星位點對丹東、北戴河、威海、青島、榮成5個牙鲆群體進行遺傳分析,顯示5個群體遺傳多樣性差異不顯著,群體間基因分化系數(GST)為0.099 1,各群體之間存在中度遺傳分化[17]。利用10對微衛星引物對牙鲆普通群體、感病群體和抗病群體進行遺傳分析,顯示2個選擇性養殖群體遺傳多樣性降低[18]。利用9對多態性微衛星引物對韓國沿海5個野生牙鲆群體和3個養殖群體的遺傳多樣性進行了分析,顯示野生群體與養殖群體具有明顯的遺傳分離,東、西和南部的野生群體聚為一支,而養殖群體聚為一支[19]。利用11個微衛星位點對日本沿海周圍的7個牙鲆群體進行分析,7個群體的遺傳分化系數相當低(Fst=0.002 5)[20],可以認為是同一個地理群體。從以上的遺傳分析可以認為本文應用韓國牙鲆群體、日本牙鲆群體應當為代表性群體。而本文中涉及4個牙鲆群體的遺傳分化系數為0.076 7~0.258 6,分化系數相對較高,主要原因是由于“鲆優1號”父本為韓國群體,母本F0750的父母本分別為日本群體和從養殖群體中人工篩選而來的抗病群體,其遺傳背景較為豐富,4個群體之間產生了中度的遺傳分化,分化水平分別高于日本牙鲆和中國沿海養殖群體。
觀測雜合度(Ho)和期望雜合度(He)是分析種群內遺傳變異的2個重要指標,日本海區7個牙鲆種群的平均等位基因No為15.2~18.2,期望雜合度He為0.74~0.78[20],韓國沿海牙鲆野生種群平均有效等位基因AR為10.9~16.1,觀測雜合度Ho為0.820 ~0.888[19]。中國北部沿海5個牙鲆養殖群體的觀測雜合度Ho為0.220 0~0.800 0,期望雜合度He為0.206 1~0.818 7[17],本文4個群體的觀測雜合度Ho為0.538 3~0.619 3,期望雜合度He為0.490 0~0.690 4,本文中牙鲆群體的遺傳多樣性低于日本和韓國自然群體,但遺傳多樣性高于國內沿海養殖群體,主要原因是由于本文中群體是從以上群體選育而來,因此遺傳多樣性低于原產地養殖群體,但經過幾代選育,和本地養殖群體相比遺傳多樣性有所提高。
等位基因數(Na)或有效等位基因數(Ne)易受到外部環境(選擇、漂變、遺傳瓶頸等)因素的影響[22],適合于評價群體遺傳變異[23]。本文4個牙鲆群體的平均有效等位基因數(Nae)小于平均等位基因數(Na),其原因主要是由于群體選育及針對性的家系選育造成的。Locus5、Locus21在ZJ群體中,Locus9 和Locus19在FJ群體中出現了只有1個等位基因的現象,主要是由于ZJ和FJ群體為一對父母本交配產生的全同胞家系群體。而韓國群體為引進的養殖群體,因此利用24個衛微星標記進行檢測時,韓國群體在每個位點表現為多態性,而在其ZJ和FJ家系群體中出現了單態現象。
多態信息含量是衡量位點多樣性的較好指標,一般認為在某一群體中,當PIC>0.5時該位點表現為高度多態,當0.25<PIC<0.5時該位點表現為中度多態,當PIC<0.25時該位點表現為低度多態[21]。中國北部沿海牙鲆野生群體的30個位點多態信息含量為PIC為0.709~0.892,平均為0.832[23]。本文中4個牙鲆群體的PICa為0.460 1~0.637 0,平均為0.527 7,相對于野生群體較低,但都表現為高度多態,表明這4個牙鲆群體種群內遺傳變異較大,信息含量較高,多態信息含量從大到小依次為:韓國牙鲆、F0750、鲆優1號反交群體和鲆優1號。
Hardy-Weinberg遺傳偏離指數(d)反映了Ho和He兩者之間的平衡關系[24]。北部沿海野生牙鲆群體的遺傳偏離指數d變化范圍從-0.247到0.512[23],本文中24個微衛星位點在4個牙鲆群體中的遺傳偏離指數(D)在-0.759 7到0.188 4之間,其中50%的位點雜合子過剩(d>0),其余為雜合子缺失(d<0)。4個群體中F0750(JX)和反交群體(FJ)顯著的偏離位點最多,分別達到16和17個。主要原因是由于奠基者效應(founder effect)和瓶頸效應(bottle effect)造成[25]。韓國牙鲆(KS)是從國外引進,種群數量有限,選育群體F0750(JX)是一個生長快成活率高的家系,父母本為一對個體。鲆優1號(ZJ)和其反交群體(FJ)樣本都采自建立的家系群,因而發生了大部分基因位點的偏離。
綜上所述,人工培育的牙鲆雜交新品種“鲆優1號”與其父母本相比較,在6個表型性狀上具有顯著性差異;遺傳性狀分析顯示4個群體之間產生了中度的遺傳分化,而且種群內也產生了較大的遺傳變異。說明人工培育的“鲆優1號”在表型和遺傳上具有一定的特質,這些特點為鑒別“鲆優1號”提供表型和遺傳標志,同時為其優良的生產性狀(生長快、成活率高)提供了一定的遺傳依據。
[1] 楊正勇,王春曉.全球視野下中國鲆鰈類養殖業的發展[J].中國漁業經濟,2009,6(27):115-127.
[2] 陳松林,田永勝,徐田軍,等.牙鲆抗病群體和家系的建立及其生長和抗病性能初步測定[J].水產學報,2008,32(5):665-674.
[3] 田永勝,徐田軍,陳松林,等.三個牙鲆育種群體親本效應及遺傳參數估計[J].海洋學報,2009,31(6):119-129.
[4] 陳松林,田永勝.全國水產技術推廣總站-2010水產新品種推廣指南[M].北京:中國農業出版社,2011:242-268.
[5] 劉永新,劉海金.牙鲆不同家系早期形態性狀差異比較[J].東北農業大學學報,2008,39(8):82-88.
[6] 趙瑩瑩,朱曉琛,孫效文.虹鱒6個養殖群體遺傳多樣性的微衛星分析[J].遺傳,2006,28(8):956-962.
[7] 全迎春,孫效文,梁利群.應用微衛星多態分析四個鯉魚群體的遺傳多樣性[J].動物學研究,2005,26(6):595—602.
[8] Kang J H,Kim W J,Lee W J.Genetic linkage map of olive flounder,Paralichthys olivaceus[J].Int J Biol Sci,2008,4(3):143-149.
[9] Song W T,Pang R Y,Niu Y Z,et al.Construction of high-density genetic linkage maps and mapping of growth-related quantitative trail loci in the Japanese flounder(Paralichthys olivaceus)[J].Plos One,2012,7(11):e50404.
[10] FujiK,Hasegawa O,HondaK,et al.Marker-assisted breeding of a lymphocystis disease-resistant Japanese flounder(Paralichthysolivaceus)[J]. Aquaculture,2007,272:291-295.
[11] 田永勝,陳松林,嚴安生.牙鲆胚胎玻璃化冷凍技術研究[J].高技術通訊,2005,15(3):105-110.
[12] 李思忠,王惠民.中國動物志:硬骨魚綱-鰈形目[M].北京:科學出版社,1995:116-123.
[13] 王新安,馬愛軍,侯仕營,等.大菱鲆4個不同地理群體生長性能的比較[J].漁業科學進展,2010,31(1):34-39.
[14] 于飛,張慶文,孔杰,等.大菱鲆測量性狀對體重的影響效果分析[J].海洋水產研究,2008,29(60):33—40.
[15] 夏德全,曹螢,楊弘,等.羅非魚雜交F代與親本的遺傳關系及其雜種優勢的利用[J].水產科學,1999,6(4):29-32.
[16] 杜誠,盧邁新,葉星,等.5個羅非魚群體的遺傳分析與分子標記[J].大連海洋學院學報,2005,20(1):25-28.
[17] 劉海金,朱曉琛,孫效文,等.牙鲆5個養殖群體的遺傳多樣性分析[J].中國水產科學,2008,15(1):30-38.
[18] 劉云國,陳松林,李八方,等.牙鲆選擇性養殖群體遺傳結構的微衛星分析[J].高技術通訊,2006,16(1):94-99.
[19] Kim W J,KimKK,Han H S,et al.Population structure of the olive flounder(Paralichthys olivaceus)inKorea inferred from microsatellite marker analysis[J].J Fish Biol,2010,76:1958-1971.
[20] Sekino M,Hara M.Application of microsatellite markers to population genetics studies of Japanese flounder Paralichthysolivaceus[J].Mar Biotechnol(NY),2001,3:572-589.
[21] Li D,Kang D,Yin Q,et al.Microsatellite DNA marker analysis of genetic diversity in wild common carp(Cyprinuscarpio L.)populations[J].J Genet Genomics,2007,34:984-993.
[22] Nei M,Maruyama T,Chakraborty R.The bottleneck effect and genetic variability in populations[J].Evolution,1975,29(1):1-10.
[23] Wang L,Zhang L D,Wan Y M,et al.Isolation of microsatellite markers from Paralichthysolivaceus and its application in genetic structure analysis[J].Yi Chuan,2010,32:1057-1064.
[24] 李鵬飛,劉萍,柳學周,等.漠斑牙鲆引進種群同工酶的遺傳多態性分析[J].中國水產科學,2006,13(1):13-19.
[25] Suci A,Uthairat N N,WorawutK.Study of genetic diversity of orange spotted grouper,Epinepheluscoioides from Thailand and Indonesia using microsatellite markers[J].Mar Biotechnol,2005,8:17-26.
Analysis of phenotype and genetic variation of on“Flounder No.1”Paralichthys Olivaceus and their parental populations
Tian Yongsheng1,Qi Wenshan1,2,Jiang Jing1,2,Wang Lei1,3,Zhang Yingping1,2,Liu Wanjun1,3,Chen Honglin1,2,Chen Songlin1
(1.Key Laboratory of Sustainable Development of Marine Fisheries,Ministry of Agriculture,Yellow Sea Fisheries ResearchInstitute,Chinese Academy of Fishery Sciences,Qingdao 266071,China;2.College of Fisheries andLife Science,Shanghai Ocean University,Shanghai 201306,China;3.School of Marine life Sciences,0cean University of China,Qingdao 266003,China)
Japanese flounder(Paralichthys olivaceus)is one of the most popularspecies for fishing and breeding in China and the Atlantic coast,so it is of great importance for the protection of genetic resources and the development of new species.In present study,18 phenotypic traits of“Flounder No.1”(ZJ),a newly breeding species of Japanese flounder,as well as its male(theKorean Japanese flounder stock,KS)and female parents(F0750 family,JX),were measured.The data were compared by ANOVA and SPSS software.The results showed that there were significant differences(p<0.05)between“flounder No.1”and its parents regarding 6 traits,e.g.body length/body width,head length/eye diameter,head length/eye spacing,eye diameter/eye spacing,lateral line scales and caudal fin ray which can be used as typical characters for identification of“Flounder No.1”.In“Flounder No.1”,50%of the traits showed no significant differences(p>0.05)bcompared to its female parent,while the value decreased to 33.3%between“flounder No.1”and its male parent.A total of 24 microsatellite primers were designed to screen the genetic diversity ofKS,JX,ZJand FJ(reciprocal cross offspring),and 143 alleles were identified.For four populations,KS,JX,ZJ and FJ,their mean allelic number(Na)was higher than the effective mean number of alleles(Nae),the mean heterozygosity was higher than the predicted value.The polymorphism information content (PICa)showed thatKS>JX>FJ>ZJ,indicating that the artificial breeding caused the reduction of the genetic heterozygosity.Among the four populations,the genetic deviation index(D)of 24 above mentioned microsatellite loci ranged from-0.759 7 to 0.188 4.And inKS,JX,ZJ and FJ,10,16,11 and 17 loci were significantly(p<0.05)or extremely(p<0.01)deviated from Hardy-Weinberg equilibrium,respectively.The genetic-differentiation-index(Fst)of 24 loci ranged from 0.076 7 to 0.258 6,with the mean value 0.1468,which suggests that 14.68%of the variations result from the interspecies,while 85.32%are intraspecific variations.Furthermore,there was significant difference for Nei's genetic distance among four populations.The nearest genetic distance occured betweenKS and FJ(0.282 5),togehter with the highest genetic similarity coefficient(0.753 9).While the furthest(0.420 5)one was found between ZJ and JX with the lowest(0.656 7)genetic similarity coefficient.In this study,the observation indicated:“flounder No.1”has the obvious phenotypic and genetic characteristics,shows a certain degree of genetic differentiation in intraspecies and interspecies in comparison to its parents and reciprocal cross offspring,which provides the theoretical basis for the germplasm identification of“Flounder No.1”.
Paralichthys Olivaceus;“Flounder No.1”;phenotypic traits;microsatellite markers;genetic diversity
Q959.486
A
0253-4193(2014)06-0075-12
2013-04-18;
2014-02-17。
“863”高技術研究發展計劃(2012AA10A408);山東省泰山學者建設工程專項資助。
田永勝(1964-),男,甘肅省會寧縣人,研究員,博士,主要從事魚類低溫生物學及遺傳育種研究。E-mail:tianys@ysfri.ac.cn
*通信作者:陳松林(1960-),男,研究員,博士,主要從事水產生物技術研究。E-mail:chensl@ysfri.ac.cn
田永勝,齊文山,姜靜,等.“鲆優1號”牙鲆和親本群體的表型及遺傳性狀變異分析[J].海洋學報,2014,36(6):75—86,
10.3969/j.issn.0253-4193.2014.06.010
Tian Yongsheng,Qi Wenshan,Jiang Jing,et al.Analysis of phenotype and genetic variation of on“Flounder No.1”Paralichthys Olivaceus and their parental populations[J].Acta Oceanologica Sinica(in Chinese),2014,36(6):75—86,doi:10.3969/j.issn.0253-4193.2014.06.010

