miR-31對人皮膚鱗狀細胞癌生長的影響及作用機制的研究
陳 凱 常東方 段紹坤 李渝涼
皮膚鱗狀細胞癌(鱗癌)是我國常見的皮膚惡性腫瘤,具有高度的侵襲能力,可能與紫外照射損傷、免疫抑制及其他皮膚疾病有關[1]。因此,尋找其發生過程中發揮關鍵作用的分子對其治療是必要的。研究發現微小RNA(microRNA,miRNA)在腫瘤的發生發展中起著重要的作用[2]。
miRNA是一類比較保守的單鏈非編碼小RNA分子,主要通過與靶基因mRNA 3'UTR結合,在轉錄后水平調控基因的表達[3,4]。miRNA參與一系列的生理過程,如生長、發育、分化及凋亡[5]。研究發現約50%miRNA基因定位于染色體上腫瘤基因相關區域,并且在腫瘤中經常伴隨著miRNA的異常表達[6]。關于miRNA與皮膚鱗癌的研究在國內外報道甚少,有研究表明在皮膚鱗癌中miR-125b通過靶定MMP-13抑制鱗癌細胞的生長和侵襲遷移[7]。此外,通過對皮膚鱗癌和其他皮膚腫瘤患者中miRNA表達水平的分析,發現miR-31在皮膚鱗癌中高表達[8]。然而,關于miR-31在皮膚鱗癌中的作用還未明確。
本研究探索了miR-31對細胞增殖以及腫瘤生長的影響,并對其靶基因進行驗證。
1 材料與方法
1.1 材料
本研究20對皮膚鱗癌和癌旁正常組織來自2011年1月至2013年6月重慶醫科大學永川醫院收治患者,并得到患者的知情同意。鱗癌細胞A431和SLC-1的培養液是含有10%FBS的DMEM(Gibco公司)。脂質體LipofectamineTM2000購自Invitrogen公司,ASO和siRNA購自上海吉瑪公司。兔抗LATS2和GAPDH抗體購自Abcam公司。RNA提取試劑盒購自Qiagen公司,反轉錄酶購自Fermentas公司,實時定量PCR的2×SYBR Green Master Mix購自Takara公司。
1.2 方法
1.2.1 細胞轉染 按照脂質體的說明進行。細胞轉染4 h后,換含有血清的培養液,在37℃、5%CO2的孵箱中繼續培養。
1.2.2 平板克隆形成實驗 將轉染的細胞種到12孔板,每隔3天換液至到大部分克隆形成。用PBS清洗后5%濃度結晶紫染色,并進行計數。
1.2.3 體外成瘤實驗 裸鼠購自北京維通利華有限責任公司(動物合格證號:SCXK(京)2013-0002),并得到動物管理委員會的許可。裸鼠在無菌的條件下正常飲食,將106個轉染的鱗癌細胞重懸在100 μL無血清培養液中,經皮下注射途徑植入裸鼠。大概3周后,將小鼠麻醉處死取出腫瘤組織,并量取體積。體積=(長×寬2)/2。
1.2.4 Western印跡 細胞中轉染LATS2的siRNA(20 nM)以及對照,48 h后提取蛋白進行Western印跡分析LATS2的水平。轉染48 h后,用PBS洗細胞后用RIPA緩沖液裂解細胞。利用BCA法進行蛋白濃度測定,取20 μg蛋白進行SDS-PAGE膠分析。最后利用ECL顯影,并分析條帶的強度。以GAPDH作為內參。
1.2.5 RNA提取和實時定量PCR 利用RNA提取試劑盒進行RNA提取,采用NanoDrop ND-1000分光光度計測定RNA的濃度。取500 ng RNA進行cDNA的合成后進行PCR反應。反應條件是:95℃30 s,之后40個循環95℃ 30 s,57℃ 30 s,72℃ 30 s。以U6 RNA和β-actin作為內參。
1.2.6 免疫組織化學 將石蠟包埋的組織切片進行脫蠟水合處理,3%H2O2室溫孵育5 min。蒸餾水沖洗,PBS浸泡5 min后,用5%山羊血清封閉10 min,滴加一抗工作液孵育1 h。然后用生物素標記的二抗工作液37℃孵育10 min。最后滴加辣根酶標記的鏈霉卵白素工作液,37℃孵育30 min。PBS沖洗后顯色劑顯色3 min,在顯微鏡下觀察。
1.2.7 GFP報告載體實驗 將含有miR-31結合位點的LATS2 3'UTR克隆到pcDNA3/GFP載體的GFP下游。在細胞中共轉染miR-31 ASO和LATS2 3'UTR,同時轉染RFP質粒作為內參。轉染48 h后,用RIPA裂解細胞提取蛋白,熒光分光光度計檢測細胞GFP熒光強度。
1.3 統計學處理
用SPSS 18.0軟件進行統計分析,比較兩組數據間的差異采用雙側樣本的Student's t檢驗,比較相關性采用Pearson相關系數分析。P<0.05被認為是差異具有統計學意義。
2 結果
2.1 平板克隆形成實驗分析miR-31對細胞生長的影響
將miR-31 ASO以及對照轉染A431和SLC-1細胞,利用平板克隆形成實驗檢測細胞生長的情況。轉染miR-31 ASO的A431細胞克隆數較對照組減少約50%,且差異具有統計學意義(P<0.05);在SLC-1細胞中也得到了類似的結果。
2.2 體外成瘤實驗分析miR-31對腫瘤生長的影響
將轉染miR-31 ASO以及對照的細胞經皮下注射入裸鼠體內,利用體內成瘤模型檢測miR-31對腫瘤生長的影響。結果顯示轉染miR-31 ASO的鱗癌細胞成瘤能力降低,腫瘤體積明顯小于對照組(圖1),且差異具有統計學意義(P<0.05)。
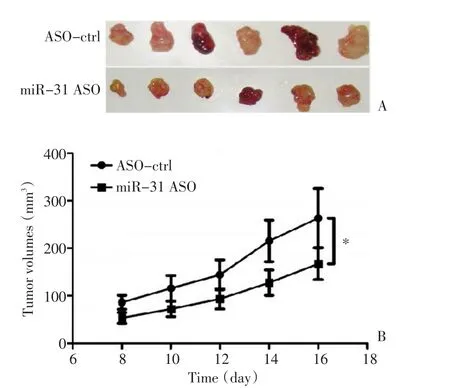
圖1 體外成瘤實驗檢測miR-31對鱗癌生長的影響Figure 1 In vitrotumor formation assay indicates that miR-31 inhibition suppresses cSCC growth
2.3 Western blot印跡檢測miR-31對LATS2蛋白水平的影響
研究證實miR-31可以靶定抑癌基因LATS2和PPP2R2A[9]。為了檢測在皮膚鱗癌中miR-31是否也通過這兩個基因發揮作用,首先通過Western印跡檢測miR-31 ASO對LATS2和PPP2R2A表達水平的影響。實驗顯示鱗癌細胞轉染miR-31 ASO后使LATS2的水平升高約1.5倍,差異具有統計學意義(圖2,P<0.05),而對PPP2R2A的表達水平無影響(P>0.05)。
2.4 生物信息學預測miR-31的候選靶基因
利用生物信息學方法(TargetScan以及Pictar預測網站)對miR-31與候選靶基因的結合位點進行驗證,圖3顯示miR-31與候選靶基因LATS2 3'UTR的結合位點互補。
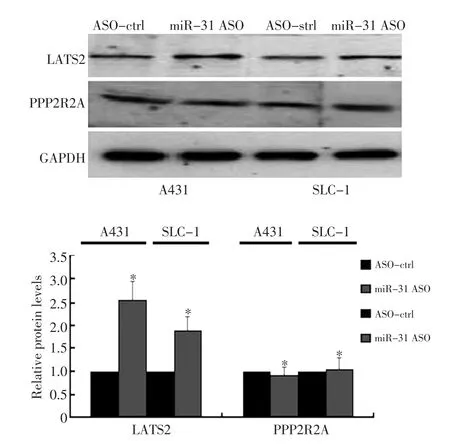
圖2 Western blot檢測miR-31對候選靶基因蛋白表達的影響Figure 2 Western blot shows that miR-31 inhibition increases LATS2 protein levels
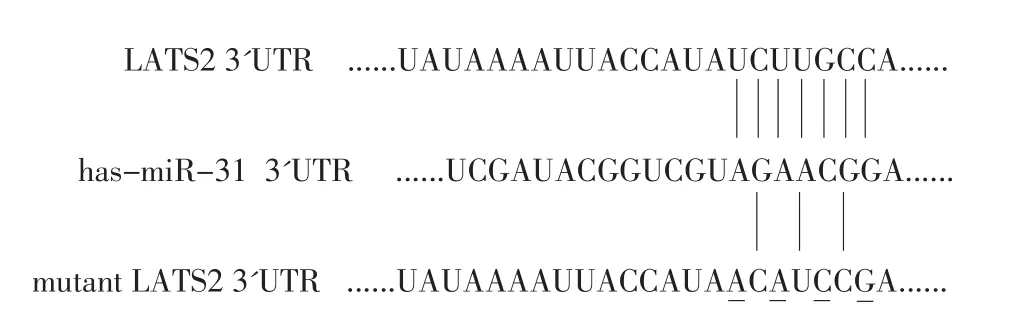
圖3 生物信息學預測miR-31的靶基因Figure 3 Bioinformatics indicates that LATS2 3'UTR has binding sites with miR-31
2.5 GFP報告載體實驗驗證miR-31的靶基因
在A431和SLC-1細胞中共轉染miR-31 ASO和野生型或者突變型的LATS2 3'UTR(突變位點如圖3所示),通過GFP報告載體實驗檢測miR-31對LATS2 3'UTR熒光強度的影響。結果顯示轉染miR-31 ASO的細胞中LATS2 3'UTR的熒光強度較對照組增強50%(圖4),且差異具有統計學意義(P<0.05),且在兩種鱗癌細胞中結果一致。然而miR-31 ASO對突變的3'UTR熒光強度無明顯影響(P>0.05,圖4)。
2.6 Western blot檢測siRNA對LATS2表達水平的影響
在A431和SLC-1細胞中轉染LATS2 siRNA以及對照,轉染48 h后利用Western blot檢測細胞中LATS2蛋白水平。結果顯示轉染LATS2 siRNA的細胞中LATS2的水平較對照組降低約80%,且差異具有統計學意義(圖5,P<0.05)。
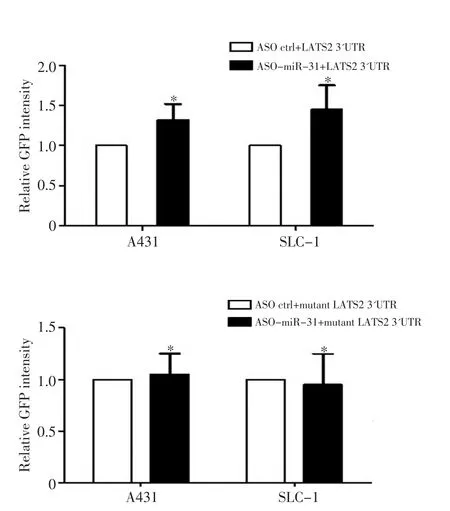
圖4 GFP報告實驗驗證miR-31的靶基因Figure 4 GFP reporter assay shows that miR-31 inhibition increases the GFP intensity of LATS2 3'UTR
2.7 平板克隆形成實驗分析LATS2對細胞生長的影響
在A431和SLC-1細胞中轉染LATS2 siRNA以及對照,利用平板克隆形成實驗檢測細胞的生長情況,結果顯示轉染LATS2 siRNA的細胞克隆數分別升高約70%和1.3倍,且差異具有統計學意義(圖6,P<0.05)。
2.8 實時定量PCR分析miR-31的表達水平
利用實時定量PCR檢測miR-31和靶基因在鱗癌以及癌旁正常組織中的表達水平。圖7顯示,與癌旁正常組織相比,鱗癌組織中miR-31的水平升高約2.5倍,差異具有統計學意義(P<0.05),并且miR-31與LATS2的表達呈負相關(P<0.05)。
2.9 免疫組織化學法檢測LATS2在鱗癌組織中的表達
利用免疫組織化學檢測LATS2在鱗癌組織和癌旁正常組織中的表達水平。圖8顯示,與正常組織相比,皮膚鱗癌組織中LATS2的表達水平明顯降低。
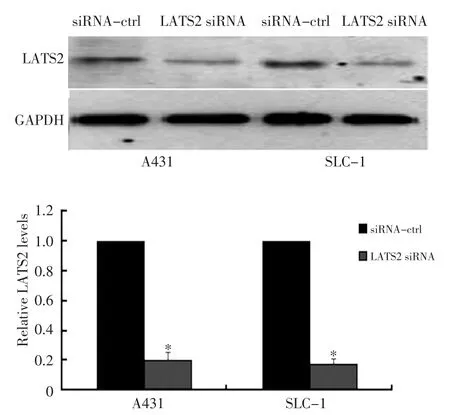
圖5 Western blot檢測LATS2的表達以及平板克隆形成實驗檢測細胞生長Figure 5 Western blot shows that LATS2 expression is repressed by in?troduction of siRNA against LATS2
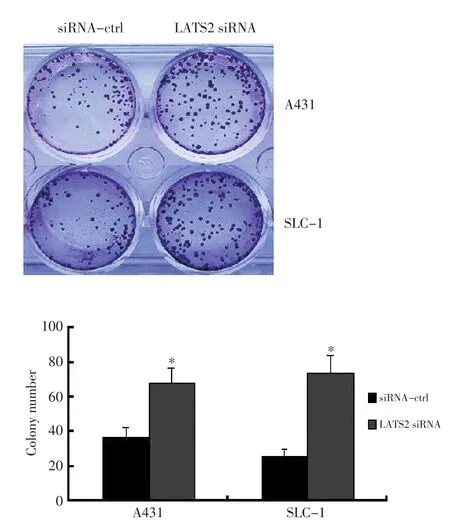
圖6 平板克隆形成實驗檢測LATS2對細胞生長的影響Figure 6 Colony formation assay shows that knocking down of LATS2 in?creases the number of colonies
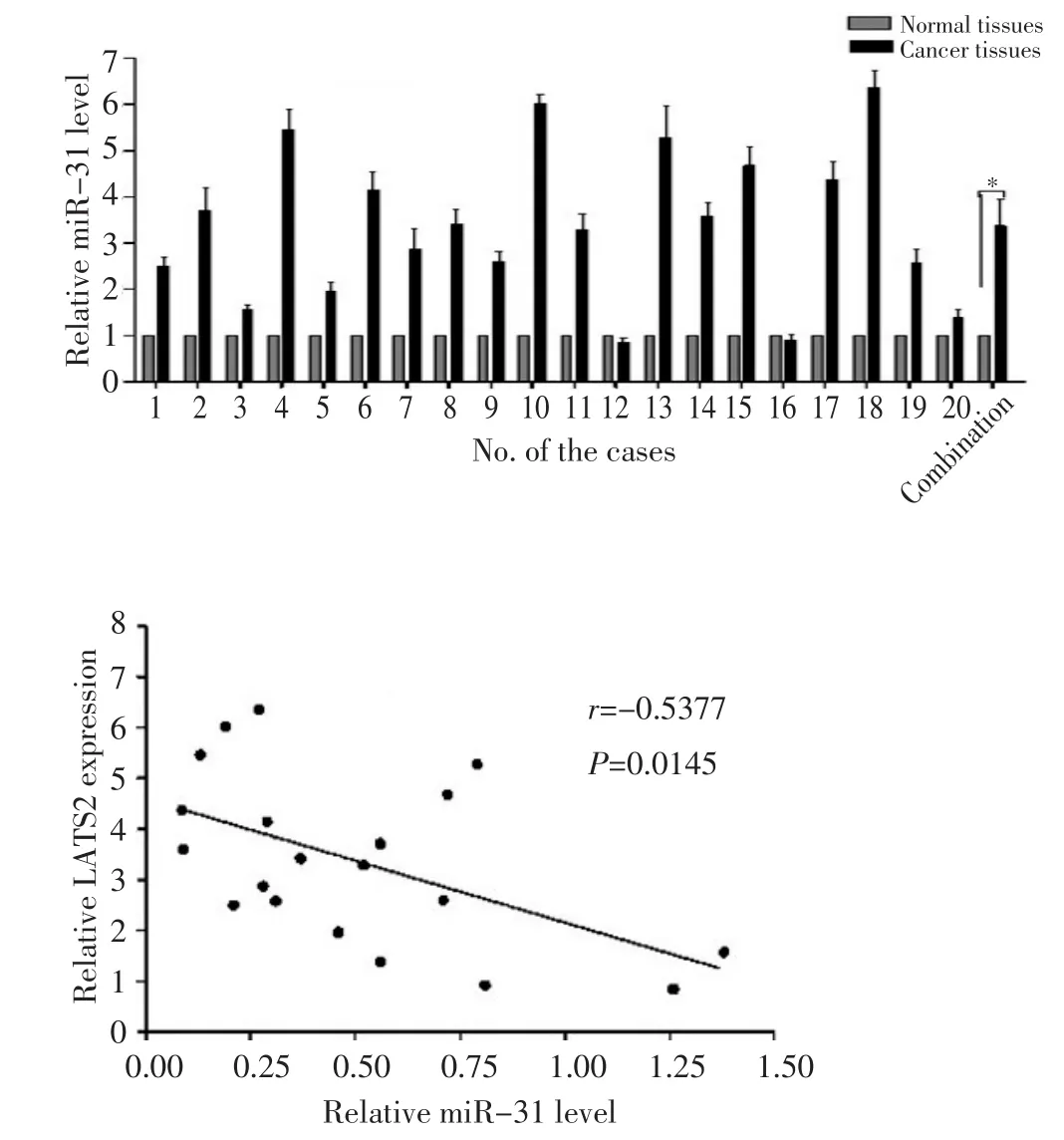
圖7 實時定量PCR檢測miR-31和LATS2在鱗癌組織和正常對照中的表達水平Figure 7 Real-time PCR shows that miR-31 is upregulated in cSCC tis?sues,and an inverse relationship exists between miR-31 and LATS2 ex?pression levels
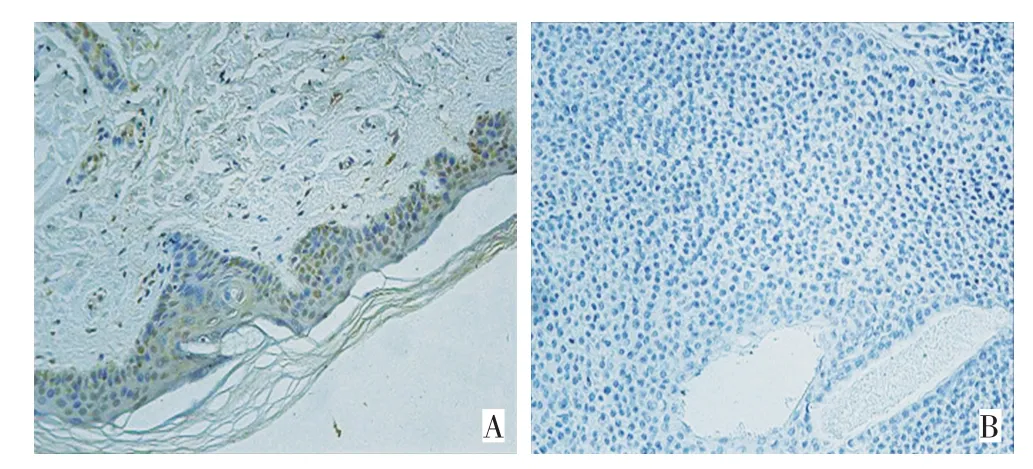
圖8 免疫組織化學檢測LATS2在鱗癌組織和正常對照中的表達水平(SP×200)Figure 8 Immunohistochemistry shows that LATS2 is downregulated in cSCC tissues(SP×200)
3 討論
本研究結果發現miR-31在鱗癌組織中高表達,抑制miR-31的表達后細胞克隆形成能力下降,腫瘤生長受抑制。已有研究發現miR-31可促進血管平滑肌細胞生長[10]。此外,在食管鱗癌和結腸癌中,miR-31也是高表達,并且與腫瘤的進展程度相關[11-12],這些均提示miR-31發揮著癌基因的角色。
miRNA與靶基因3'UTR的不完全互補,是導致一個miRNA調控多個靶基因表達的原因之一[13]。研究證實在肺癌和血管平滑肌細胞中miR-31可以通過靶定PPP2R2A和LATS2參與細胞的生長。在本研究中,抑制miR-31的表達后,LATS2蛋白水平升高,而PPP2R2A的表達不受影響。這可能是PPP2R2A的3'UTR在不同的腫瘤細胞中有差異,導致miRNA的抑制作用消失。此外,通過GFP報告實驗進一步驗證LATS2是miR-31的直接靶基因,miR-31通過與其3'UTR直接結合而抑制其表達。
LATS2定位于13號染色體,可編碼絲氨酸蘇氨酸蛋白激酶。研究發現該酶屬于Hippo腫瘤抑制信號途徑的成員,可以通過磷酸化的形式使癌基因YAP失活,從而抑制惡性間皮瘤細胞的生長[14]。在胃癌中,癌基因miR-372可以通過抑制LATS2的表達從而抑制細胞的生長,促進細胞凋亡[15]。說明LATS2在抑制腫瘤細胞生長中起著重要的作用。本研究通過免疫組織化學及實時定量PCR發現LATS2在皮膚鱗癌組織中表達降低。敲除LATS2的表達后細胞的克隆形成能力增強,與抑制miR-31的作用相反,進一步證實LATS2是miR-31的靶基因。
總之,本研究在皮膚鱗癌中miR-31通過抑制LATS2的表達調控鱗癌的生長,發揮著癌基因的作用,可為皮膚鱗癌的分子治療提供更多的依據和理論基礎。
1 Garcia-Zuazaga J,Olbricht SM.Cutaneous squamous cell carcino?ma[J].Adv Dermatol,2008,24:33-57.
2 Du B,Wang Z,Zhang X,et al.MicroRNA-545 Suppresses Cell Proliferation by Targeting Cyclin D1 and CDK4 in Lung Cancer Cells[J].PloS One,2014,9(2):e88022.
3 Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
4 Dalmay T.Mechanism of miRNA-mediated repression of mRNA translation[J].Essays Biochem,2013,54:29-38.
5 Ambros V.The functions of animal microRNAs[J].Nature,2004,431(7006):350-355.
6 Calin GA,Sevignani C,Dumitru CD,et al.Human microRNA genes are frequently located at fragile sites and genomic regions in?volved in cancers[J].Proc Natl Acad Sci U S A,2004,101(9):2999-3004.
7 Xu N,Zhang L,Meisgen F,et al.MicroRNA-125b down-regu?lates matrix metallopeptidase 13 and inhibits cutaneous squamous cell carcinoma cell proliferation,migration,and invasion[J].J Biol Chem,2012,287(35):29899-29908.
8 Bruegger C,Kempf W,Spoerri I,et al.MicroRNA expression differs in cutaneous squamous cell carcinomas and healthy skin of immu?nocompetent individuals[J].Exp Dermatol,2013,22(6):426-428.
9 Liu X,Sempere LF,Ouyang H,et al.MicroRNA-31 functions as an oncogenic microRNA in mouse and human lung cancer cells by repressing specific tumor suppressors[J].J Clin Invest,2010,120(4):1298-1309.
10 Liu X,Cheng Y,Chen X,et al.MicroRNA-31 regulated by the ex?tracellular regulated kinase is involved in vascular smooth muscle cell growth via large tumor suppressor homolog2[J].J Biol Chem,2011,286(49):42371-42380.
11 Luo J,Ling ZQ,Peng BF,et al.Expression of miR-31 in esopha?geal squamous cell carcinomaand its relation to prognosis[J].Chi?nese Journal of Cancer,2013,(7):487-492.[羅 君,凌志強,彭兵鋒,et al.MicroRNA-31在食管鱗狀細胞癌中的表達及其與預后的關系[J].中國癌癥雜志,2013,(7):487-492.]
12 Wang CJ,Ma N,Zhou Y.Expression and functions of miR-31 in colorectal cancer tissues and cells[J].Journal of zhengzhou universi?ty(Medical medicine),2013,(5):625-629.[王朝杰,馬 寧,周 云.結直腸癌組織和結腸癌細胞中miR-31的表達及功能[J].鄭州大學學報(醫學版),2013,(5):625-629.]
13 Carroll AP,Goodall GJ,Liu B.Understanding principles of miRNA target recognition and function through integrated biological and bioinformatics approaches[J].Wiley interdiscip Rev RNA,2014,doi:10.1002/wrna.1217.[Epub ahead of print]
14 Murakami H,Mizuno T,Taniguchi T,et al.LATS2 is a tumor sup?pressor gene of malignant mesothelioma[J].Cancer Res,2011,71(3):873-883.
15 Cho WJ,Shin JM,Kim JS,et al.miR-372 regulates cell cycle and apoptosis of ags human gastric cancer cell line through direct regula?tion of LATS2[J].Mol Cells,2009,28(6):521-527.

