人胰腺癌PANC-1細胞裸鼠移植瘤模型建立及其用于觀察載siRNA納米微粒體內效應的研究*
曾林涓, 李景果, 張秋波, 錢辰琛, 林 忠, 陳茵婷, 黃開紅
(中山大學附屬第五醫院腫瘤內科,廣東珠海 519000)
人胰腺癌PANC-1細胞裸鼠移植瘤模型建立及其用于觀察載siRNA納米微粒體內效應的研究*
曾林涓, 李景果, 張秋波, 錢辰琛, 林 忠, 陳茵婷△, 黃開紅△
(中山大學附屬第五醫院腫瘤內科,廣東珠海 519000)
目的:探討建立人胰腺癌PANC-1裸鼠移植瘤模型的最佳實驗方法,并應用該模型進行載基因納米微粒體內效應的研究。方法:將不同數量PANC-1細胞懸液接種于BALB/c(nu/nu)小鼠右側背部皮下,當腫瘤體積達100 mm3時尾靜脈注射siRNACY5.5納米復合物進行活體熒光成像。此外,于尾靜脈注射負載siRNAKras納米復合物,蛋白印跡及免疫組織化學染色法觀察腫瘤組織Kras蛋白表達水平。結果:1×107cells/300 μL接種成瘤率達100%,成瘤時間<2周。熒光呈像及組織學檢查顯示載siRNA納米微粒可靶向聚集在腫瘤組織發揮體內基因沉默效應。結論:本研究報道的人胰腺癌裸鼠移植瘤模型建立方法成瘤率達100%,成瘤時間短,是研究藥物示蹤和觀察療效的理想模型。
胰腺腫瘤;模型,動物;納米微粒;RNA干擾
胰腺癌(pancreatic cancer,PA)是一類惡性度高、進展快、預后極差的消化道腫瘤,嚴重危害人類身體健康。早期根治性手術切除是可能治愈PA的唯一手段,但是,絕大多數PA患者就診時已屬晚期,失去手術機會,PA早診率和長期生存率均不到5%。利用納米載體靶向腫瘤組織進行化學藥物治療、基因治療或者攜帶影像對比劑進行腫瘤診斷是近年來的研究熱點[1]。建立動物移植瘤模型是進行納米抗腫瘤研究中不可缺少的實驗環節。在本實驗中,我們通過確定最佳接種條件,使得人胰腺癌裸鼠移植瘤模型在2周內100%成瘤,為進一步實驗奠定基礎。
材料和方法
1 細胞株
人胰腺癌細胞株PANC-1購自上海細胞生物學研究所,用含10%胎牛血清、4 mmol/L L-谷氨酰胺、1×105U/L青霉素和100 mg/L鏈霉素的DMEM(高糖)培養基在37℃、5%CO2溫箱中培養。
2 動物
4~5周齡雌性BALB/c(nu/nu)小鼠購自中山大學實驗動物中心[許可證號為SCXK(粵)2011-0029]。實驗過程中對動物的處置符合醫學倫理學標準,并飼養于該實驗中心SPF級屏蔽環境中,小鼠分籠飼養,4~5只/籠,自由飲水和進食。
3 主要試劑
納米載體PEG-PLL由中山大學化工學院提供,具體合成方法及表征參見文獻[2]。DMEM培養基購自Gibco,針對突變Kras基因siRNA(siKras)及陰性對照siRNA(scrambled control RNA,SCR)由上海吉瑪公司設計合成,CY5.5標記的陰性對照 siRNA (siCY5.5)由廣州銳博公司設計合成。KrasⅠ抗購自Gene Tex。
siKras正義鏈5’-AGUUGGAGCUGAUGGCGUA dTdT-3’,反義鏈3’-dTdT UCAACCUCGACUACCGCAU-5’;SCR正義鏈 5’-UUCUCCGAACGUGUCACGUTT-3’,反義鏈 3’-TTAAGAGGCUUGCACAGUGCA-5’。
4 主要方法
4.1 人胰腺癌BALB/c(nu/nu)小鼠皮下移植瘤模型的建立 將PANC-1細胞用PBS制成細胞懸液,分別取1×106cells/100μL PBS、5×106cells/100μL PBS、1×107cells/100μL PBS、1×107cells/300μL PBS液接種于BALB/c(nu/nu)小鼠右側背部皮下,每3 d用游標卡尺測量腫瘤大小,腫瘤體積(mm3)= L×W2/2,其中L為腫瘤長徑,W為與L垂直的最短徑(單位均為mm),觀察時間為5周。
4.2 活體熒光成像 當腫瘤體積達100 mm3時隨機選取3只荷瘤鼠進行活體成像實驗。小動物活體熒光成像儀(Carestream In Vivo Fx Pro.)用于觀察PEG-PLL/siCY5.5納米微粒(nanoparticles,NPs)在體內的分布。將75 μg PEG-PLL和20 μg siCY5.5混合,室溫靜置20 min以制備PEG-PLL/siCY5.5復合物(siCY5.5-NPs),然后將復合物用等量PBS稀釋后經尾靜脈緩慢注入。分別在注射前以及注射后2、6、24 h采集熒光圖像,注射前采集的圖像用以扣除動物自身發出的熒光。在預設的時點將動物安樂死,取出腫瘤組織和心、肝、腎等器官,再次進行熒光成像。
4.3 激光共聚焦顯微鏡觀察 將腫瘤組織冰凍包埋,-20℃條件進行冰凍切片,連續制備6 μm組織切片,在激光共聚集顯微鏡(Zeiss)下觀察熒光物質的分布。
4.4 載siRNA納米微粒的體內效應 當腫瘤體積達100 mm3時隨機選取18只荷瘤鼠隨機分為3組(每組6只)進行體內基因沉默實驗,分別于尾靜脈注射(1)PBS;(2)PEG-PLL/SCR(SCR-NPs);(3) PEG-PLL/siKras(siKras-NPs),siRNA用量為每只動物20 μg。1周以后將荷瘤鼠安樂死,剖出腫瘤組織稱重,并進行蛋白質印跡實和免疫組織化學染色觀察腫瘤組織Kras蛋白表達水平。
4.4.1 蛋白質印跡法檢測移植瘤中Kras蛋白的表達 常規方法抽提組織總蛋白,用BCA法進行蛋白含量測定,取50 μg蛋白于12%SDS-PAGE,后恒流60 min轉移至PVDF膜,5%脫脂奶室溫封閉2 h,加入目的蛋白和內參蛋白Ⅰ抗,于4℃搖床孵育過夜,加入HRP標記Ⅱ抗,室溫孵育2 h,把PVDF膜置于曝光盒內,均勻涂上化學發光液,蓋上膠片,暗室內曝光0.5~5 min后顯影、定影,觀察條帶。用ImageJ軟件對獲得的條帶進行灰度值分析,以GAPDH為內參照,以目的/內參照比值來比較其表達差異。
4.4.2 免疫組織化學染色 新鮮剝離的腫瘤組織用4%多聚甲醛固定,石蠟包埋,6 μm連續切片10張,分別進行HE染色及免疫組化染色。KrasⅠ抗工作液濃度為1∶100,以PBS代替第Ⅰ抗體作陰性對照,顯色劑為DAB。
5 統計學處理
用SPSS 17.0統計軟件分析。數據用均數±標準差(mean±SD)表示,多組間比較采用單因素方差分析(ANOVA),組間兩兩比較采用最小顯著性差異法(LSD法),以P<0.05為差異有統計學意義。
結果
1 人胰腺癌BALB/c(nu/nu)小鼠皮下移植瘤成瘤時間及體積
接種細胞數量及細胞懸液體積明顯影響成瘤率及成瘤時間,5×106cells/100 μL PBS成瘤率低、成瘤時間長,1×107cells/100 μL PBS成瘤率有較大提高,但成瘤時間仍超過3周,以1×107cells/300 μLPBS接種成瘤效果最好,成瘤率達100%,成瘤時間短(<2周),見圖1、2和表1。3周時移植瘤肉眼可見潰瘍發生率為0%,而至5周時,則30%的移植瘤發生潰瘍,見圖3。

Figure 1.The subcutaneous PANC-1 xenograft model in BALB/c (nu/nu)mice.A:mice inoculated with PANC-1 cells (1×107cells/300 μL)for 2 weeks;B:the excised tumors after inoculated with PANC-1 cells(5×106cells/100 μL or 1×107cells/300 μL)for 3 weeks.圖1 不同接種條件建立的裸鼠移植瘤模型

Figure 2.The number of inoculated PANC-1 cells affected the volume of xenograft tumor.Mean±SD.n=20.*P<0.05 vs 5×106cells.圖2 接種不同數量PANC-1細胞3周和5周后移植瘤體積的變化

表1 不同接種條件的成瘤率及成瘤時間Table 1.Tumor development after injection with different numbers of PANC-1 cells

Figure 3.The xenograft tumors tended to necrosis(ulcer,black arrow)as the inoculation time prolonged圖3 隨成瘤時間延長,移植瘤發生潰瘍增多
2 藥物在腫瘤組織中的分布
如圖4A所示,siCY5.5-NPs經尾靜脈注射2 h后可清晰顯示出腫瘤形態,提示納米微粒在腫瘤區域聚集(紅色箭頭指示),至6 h,肝臟攝取的納米微粒經代謝有所減少(白色箭頭指示),但腫瘤組織中的熒光信號未見明顯減弱,提示納米微粒被阻滯在腫瘤組織中。至24 h,活體熒光成像采集的熒光強度已明顯減弱,因此24 h為實驗終點,將荷瘤鼠安樂死,剖出腫瘤組織及重要器官(如心臟、肝臟、脾臟、腎臟),用生理鹽水清洗去除血液后再次進行熒光成像。如圖4B所示,離體熒光成像顯示腫瘤組織的熒光強度最強,經肝臟及腎臟排泄,心臟及脾臟中基本沒有納米微粒滯留,與活體熒光呈像結果一致。腫瘤組織切片的激光共聚焦顯微鏡檢查進一步證實了siCY5.5-NPs在腫瘤細胞內的分布,見圖4C。以上結果顯示,載siRNA NPs可靶向聚集在腫瘤組織并將siRNA輸送入腫瘤細胞。
3 藥物的體內效應
為了證實以納米載體導入的siRNA能夠在體內誘導出基因干擾效應,3組荷瘤鼠(n=6)分別經尾靜脈注射PBS(對照組)、SCR-NPs以及siKras-NPs。如圖5所示,siKras-NPs處理組腫瘤組織重量和Kras蛋白表達水平較PBS和SCR-NPs處理組均降低,而SCR-NPs處理組對Kras表達沒有影響。
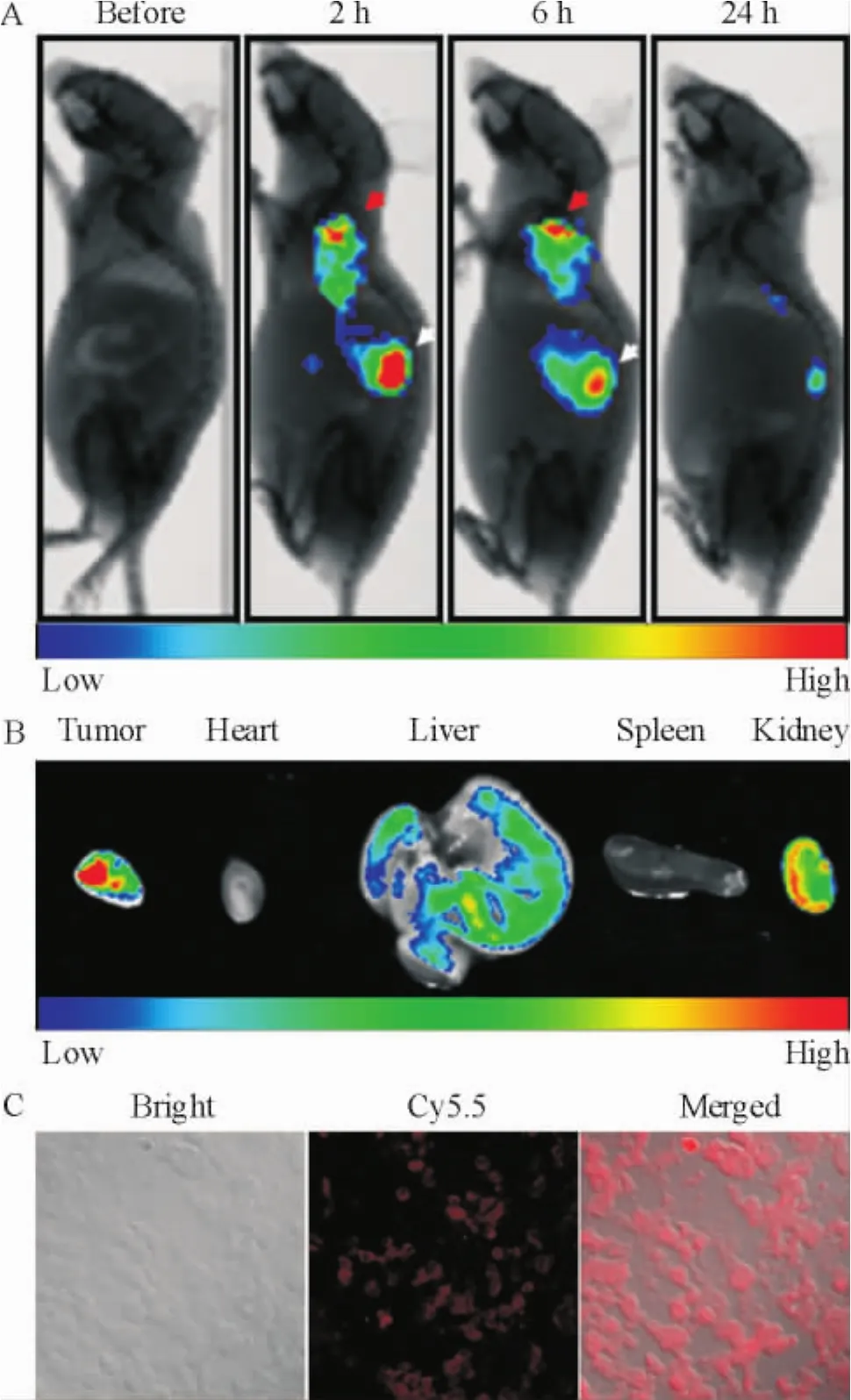
Figure 4.The biodistribution of siCY5.5-NPs in mice after injection through tail veins.A:in vivo imaging of tumorbearing mice injected with siCY5.5-NPs;B:siCY5.5-NPs accumulated in different organs;C:siCY5.5-NPs were captured by tumor cells as observed under a laser scanning confocal microscope.The color bars(from red to blue)indicate the change of fluorescence intensity from high to low.圖4 尾靜脈注射siCY5.5-NPs不同時點荷瘤鼠體內的分布
討論
PANC-1細胞株是最常用的人胰腺癌細胞株之一,基因表型為Kras、p53和p16基因突變,其生物學特性包括較強的黏附、轉移和侵襲能力;分泌較高水平的血管內皮生長因子等[3]。但是,根據已有的實驗報道,PANC-1皮下移植瘤成瘤時間大于6周[4],甚至有長達4個月才成瘤者[5]。影響移植瘤成瘤的因素,除腫瘤細胞本身致瘤性強弱外,接種的細胞數量也是關鍵。我們的結果顯示不同接種細胞數量成瘤率及成瘤體積1×107細胞>5×106細胞>1×106細胞。此外,我們的實驗還發現用于接種的細胞懸液體積顯著影響成瘤時間。盡管1×107cells/100 μL與1×107cells/300 μL最終都可達到目標腫瘤體積(100 mm3),但后者所用時間明顯縮短,這可能是因為適當的液體環境,為腫瘤細胞提供了生長空間,更有利于移植瘤的種植。成瘤時間是影響實驗結果的另一重要因素。實體瘤新生血管豐富,血管內皮結構、功能尚不完善,導致血管內皮細胞間隙較寬,因此大分子物質(如納米微粒)具有選擇性通過腫瘤組織血管內皮并在腫瘤組織中滯留的特性,這種現象稱為“增強滲透和滯留效應”(enhanced permeability and retention effect,EPR effect)[6]。納米微粒通過EPR效應在腫瘤組織中聚集,稱為納米微粒對腫瘤的“被動靶向性”。因此,移植瘤模型的血管密度、血管內皮間隙是影響納米微粒在腫瘤組織中聚集的關鍵因素。研究表明,成瘤時間為3周以內的血管密度最高,隨成瘤時間延長,移植瘤的新生血管密度下降[7]。另外,由于新生血管減少,當成瘤大于6周時腫瘤組織容易發生壞死,影響藥效評價[7]。我們的結果也證實成瘤3周時無肉眼可見潰瘍發生,但延長至5周則30%的移植瘤發生潰瘍。因此,成瘤時間過長的移植瘤模型不適用于藥效評價及影像學成像等實驗。
當基因或藥物被納米載體輸送至腫瘤細胞,要獲得最大的基因沉默效應或細胞毒作用,最關鍵的一點是基因或藥物能夠被帶入到每個腫瘤細胞內。臨床上,很難在早期發現胰腺癌,而且對化療反應性低下原因之一是胰腺癌周圍致密腫瘤基質的保護作用。我們的結果證實,siRNA-NPs不僅能夠聚集在腫瘤組織(圖4B,腫瘤中心區域熒光最強),而且有效地進入到了腫瘤細胞內(圖4C)。蛋白印跡及免疫組化檢測進一步證實納米載體攜帶的siRNAs在體內有效地發揮靶基因沉默效應。我們課題組利用此方法批量建立起來的胰腺癌皮下移植瘤模型,分別進行了靶向納米砷劑抗胰腺癌的體內研究,和納米砷聯合siRNA治療胰腺癌的體內研究[2,8]。兩項研究均證實藥物或siRNA可較長時間地聚集在腫瘤部位,發揮抗瘤效應。而另一實驗則顯示參考此方法建立的胃癌模型對MRI影像對比劑有良好的反應性[9]。
本研究結果顯示,人胰腺癌裸鼠移植瘤模型建立方法成瘤率達100%,而且短期內即可成瘤,成瘤質量好,是研究藥物示蹤、觀察療效的理想模型,增加結果的可信性與可重復性,為今后的研究打下基礎。

Figure 5.The in vivo effects of siRNA-NPs.A:seven days after treatment,the mice were sacrificed and the tumor weight was measured;B:Western blotting analysis of Kras expression in PANC-1 tumors;C:representative images of histopathological analysis of each dissected tumor tissue.Mean±SD.n=6.*P<0.05 vs SCR.圖5 載siRNA納米微粒的體內效應
[1]傅岳武,潘運龍,覃 莉,等.納米金抑制Ang-2和RGS-5表達導致裸鼠肝癌血管正常化[J].中國病理生理雜志,2011,27(12):2247-2252.
[2]Zeng L,Li J,Wang Y,et al.Combination of siRNA-directed Kras oncogene silencing and arsenic-induced apoptosis using a nanomedicine strategy for the effective treatment of pancreatic cancer[J].Nanomedicine,2014,10 (2):463-472.
[3]Deer EL,Gonzalez-Hernandez J,Coursen JD,et al.Phenotype and genotype of pancreatic cancer cell lines[J].Pancreas,2010,39(4):425-435.
[4]Freeman JW,Mattingly CA,Strodel WE.Increased tumorigenicity in the human pancreatic cell line MIA PaCa-2 is associated with an aberrant regulation of an IGF-1 autocrine loop and lack of expression of the TGF-beta type RII receptor[J].J Cell Physiol,1995,165(1):155-163.
[5]Diaz VM,Planaguma J,Thomson TM,et al.Tissue plasminogen activator is required for the growth,invasion, and angiogenesis of pancreatic tumor cells[J].Gastroenterology,2002,122(3):806-819.
[6]Fang J,Nakamura H,Maeda H.The EPR effect:unique features of tumor blood vessels for drug delivery,factors involved,and limitations and augmentation of the effect[J].Adv Drug Deliv Rev,2011,63(3):136-151.
[7]Ho KS,Poon PC,Owen SC,et al.Blood vessel hyperpermeability and pathophysiology in human tumour xenograft models of breast cancer:a comparison of ectopic and orthotopic tumours[J].BMC Cancer,2012,12:579.
[8]Qian C,Wang Y,Chen Y,et al.Suppression of pancreatic tumor growth by targeted arsenic delivery with anti-CD44v6 single chain antibody conjugated nanoparticles[J].Biomaterials,2013,34(26):6175-6184.
[9]Chen Y,Lian G,Liao C,et al.Characterization of polyethylene glycol-grafted polyethylenimine and superparamagnetic iron oxide nanoparticles(PEG-g-PEI-SPION)as an MRI-visible vector for siRNA delivery in gastric cancer in vitro and in vivo[J].J Gastroenterol,2013,48(7): 809-821.
Establishment of human pancreatic tumor xenograft mouse model for evaluating tumor-homing and gene-silencing effects of siRNA-loading nanoparticles
ZENG Lin-juan,LI Jing-guo,ZHANG Qiu-bo,QIAN Chen-chen,LIN Zhong,CHEN Yinting,HUANG Kai-hong
(Department of Oncology,The Fifth Affiliated Hospital of Sun Yat-sen University,Zhuhai 519000,China.E-mail:chenyt58 @mail.sysu.edu.cn;huangkh@mail.sysu.edu.cn)
AIM:To establish an effective and rapid method to develop transplanted subcutaneous pancreatic carcinoma by inducing PANC-1 cells into nude mice,and then use this mouse model to evaluate the tumor-homing and gene-silencing effects of siRNA-loading nanoparticles in vivo.METHODS:Different numbers of PANC-1 cells in 100 μL or 300 μL PBS were inoculated subcutaneously into the right flank of BALB/c(nu/nu)mice.When the tumor volume reached 100 mm3,siRNACY5.5nanoparticles were injected through the mouse tail vein to perform in vivo imaging assay.Besides,the mice were randomly divided into 3 treatment groups treated with PBS,scrambled control RNA nanoparticles and siKras nanoparticles,respectively.The protein expression of Kras was detected by Western blotting and immunohistochemical staining.RESULTS:After inoculated with 1×107PANC-1 cells in 300 μL PBS,all mice developed tumors within 2 weeks.The in vivo results showed that siRNA-loading nanoparticles accumulated in the tumor tissues and exerted gene silencing effect.CONCLUSION:In the present study,an effective and rapid method was established for PANC-1 cells to induce transplanted subcutaneous pancreatic carcinoma in nude mice within 2 weeks,which is suitable for in vivo imaging and treatment evaluations as a reproducible and reliable way for the further experiments.
Pancreatic neoplasms;Models,animal;Nanoparticles;RNA interference
R363
A
10.3969/j.issn.1000-4718.2014.03.034
1000-4718(2014)03-0572-05
2013-10-16
2014-01-07
國家自然科學基金資助項目(No.81072045;No.81302140);廣東省產學研資助項目(No.2009B090300277);珠
海市科技計劃(No.2013D0401990026)
△通訊作者Tel:020-81332489;E-mail:陳茵婷chenyt58@mail.sysu.edu.cn;黃開紅huangkh@mail.sysu.edu.cn

