膜聯蛋白A2對人宮頸癌HeLa細胞增殖、遷移和凋亡的影響
魏建勛, 馬文君, 李紅梅
(延安大學附屬醫院婦產科,陜西延安 716000)
膜聯蛋白A2對人宮頸癌HeLa細胞增殖、遷移和凋亡的影響
魏建勛, 馬文君, 李紅梅△
(延安大學附屬醫院婦產科,陜西延安 716000)
目的:研究膜聯蛋白A2(annexin A2,ANXA2)對人宮頸癌HeLa細胞增殖、遷移和凋亡能力的影響。方法:以HeLa細胞為研究對象,構建過表達載體以及ANXA2-siRNA,轉染入細胞。將細胞分為正常對照組、scrambled組、ANXA2過表達組及ANXA2-siRNA組。應用real-time PCR法檢測ANXA2 mRNA表達水平及Western blotting檢測ANXA2蛋白表達水平。分別采用MTT法、Boyden小室法和流式細胞術觀察ANXA2對HeLa細胞增殖、遷移及凋亡能力的影響。結果:ANXA2過表達組可以顯著促進HeLa細胞的增殖和遷移;ANXA2-siRNA組明顯抑制HeLa細胞的增殖和遷移;ANXA2對HeLa細胞凋亡幾乎無影響。結論:沉默ANXA2對人宮頸癌細胞的凋亡無顯著影響,但可顯著抑制其增殖能力和遷移能力。ANXA2可能在宮頸癌的發生發展中具有十分重要的作用,提示它有可能成為宮頸癌治療的分子靶點。
膜聯蛋白A2;HeLa細胞;細胞增殖;細胞遷移;細胞凋亡
宮頸癌(cervical cancer)是最常見的婦科惡性腫瘤之一,發病率在婦女惡性腫瘤中居第二位,僅次于乳腺癌[1]。隨著人們對宮頸癌認識程度的不斷加深,防癌普查的廣泛開展以及治療方法的不斷改進,發病率和死亡率有所下降,但腫瘤局部未控、復發和轉移仍是死亡的主要原因。目前隨著分子生物學技術的發展,從基因表達水平研究宮頸癌的發生、發展、診斷及治療已成為腫瘤研究的熱點之一。膜聯蛋白A2(annexin A2,ANXA2)是一種鈣離子介導的磷脂結合特性的蛋白質,屬于膜聯蛋白家族成員,廣泛分布于胞核、胞漿及細胞質膜外表面[2]。ANXA2作為生長調節因子,與一系列調控細胞生長和分裂的蛋白質相互作用而調控腫瘤生長[3]。ANXA2參與信號轉導、細胞遷移、DNA的合成、細胞增殖與凋亡等,與腫瘤發生發展及惡性程度密切相關[4]。研究發現,ANXA2在大多數人類腫瘤,如腦癌、肝癌、乳腺癌、肺癌、結腸癌以及血液腫瘤表達均上調[5],而在食管癌、前列腺癌、鼻咽癌中表達下調[6]。ANXA2的持續激活和異常表達與腫瘤增殖分化、細胞凋亡、新血管生成和免疫逃避密切相關,阻斷ANXA2信號轉導通路后,多種腫瘤細胞均出現增殖抑制、凋亡增加及侵襲力下降等現象[7]。本研究利用ANXA2基因轉染和siRNA干擾技術刺激體外培養的宮頸癌細胞,觀察ANXA2過表達和ANXA2-siRNA對宮頸癌細胞增殖、遷移、凋亡能力的變化,進一步明確ANXA2在宮頸癌細胞增殖、遷移、凋亡過程中的作用。
材料和方法
1 材料
1.1 細胞 人宮頸癌細胞株HeLa,購自中國科學院上海細胞庫,由本實驗室保存。
1.2 主要試劑及儀器 RPMI-1640培養基、胎牛血清、MTT、DMSO、TBST緩沖液和碘化丙啶(propidium iodide,PI)均購自賽默飛世爾生物化學制品有限公司。CO2細胞培養箱(Thermo Forma),酶聯免疫檢測儀(BioTek),流式細胞儀(BD),Bio-Rad iQ5實時定量PCR儀,激光共聚焦顯微鏡(Lavision),ECL化學發光試劑盒(Fermentas),BCA蛋白濃度測定試劑盒、RNAiso Plus kit、PrimeScript? RT reagent kit、SYBR? Premix Ex TaqTMII kit、限制性內切酶Nhe I、BamH I和T4連接酶(上海碧云天生物技術有限公司),LipofectamineTMRNAiMAX和抗 ANXA2抗體(Santa Cruz)。
2 方法
2.1 ANXA2基因siRNA序列的設計及轉染 siRNA片段由上海生工合成。靶向ANXA2的siRNA上游引物5’-GGGUCUGUCAAAGCCUAUAtt-3’,下游引物3’-ttACCCAGACAGUUUCGGAUA-5’。制備終濃度為80 nmol/L的siRNA-脂質體復合物,實驗組加入ANXA2-siRNA混合物,同時設置空白對照組(control)。將HeLa細胞以2×105cells/well接種于6孔板,待細胞生長至70% ~80%時,更換無血清培養基,采用LipofectamineTM2000將ANXA2-siRNA轉染細胞。
2.2 表達載體的構建 根據ANXA2序列設計合成一對分別位于ANXA2 cDNA序列上、下兩側的引物,中間包含有完整的ANXA2編碼序列,上游引物5’-TATCGCTAGCCAGCTTCCTTCAAA-3’,含有Nhe I酶切位點;下游引物 5’-TGCGGGATCCATTTCTGGACGCTC-3’,含有BamH I酶切位點,引物采用Bioasia公司的自動DNA合成儀合成。提取HeLa細胞總RNA,逆轉錄合成cDNA,PCR擴增后經Nhe I和BamH I酶切并與質粒pIRES2-GFP的酶切回收產物連接。連接產物經轉化感受態大腸桿菌DH5α,涂平板篩選挑取陽性克隆,擴增后提取質粒,酶切產物經電泳觀察基因片段的大小。然后挑選酶切鑒定符合的質粒送上海Invitrogen公司進一步測序鑒定。
2.3 RNA的提取與實時定量RT-PCR 以Trizol提取細胞總RNA,按照試劑盒要求操作。按照說明書進行反轉錄。ANXA2上游引物 5’-GAGGATGGCTCTGTCATTGATT-3’,下 游 引 物 5’-CTGGTAGTCGCCCTTAGTGTCT-3’,檢測按實驗室常規方法進行PCR擴增。PCR反應條件為:95℃預變性3 min、95℃ 30 s,52℃ 45 s,72℃ 45 s,35個循環;72℃7 min。以ANXA2/β-actin進行定量分析,實驗重復3次。
2.4 Western blotting 將培養的細胞用0.05%胰蛋白酶消化,PBS洗滌2次后離心棄上清,加入含全酶抑制劑和PMSF的RIPA裂解液冰浴裂解提取總蛋白,BCA法測定蛋白濃度。制備10%聚丙烯酰胺凝膠,冰浴進行電泳,電泳分離后用半干轉法將蛋白轉至硝酸纖維素膜上,5%脫脂牛奶室溫封閉2 h后加稀釋好的抗人ANXA2多克隆抗體4℃孵育過夜,次日PBS 1次、TBST 2次洗膜后加入辣根酶標記的Ⅱ抗室溫孵育2 h。洗膜后ECL發光,X光片顯影、定影、掃描儀掃描膠片。以β-actin作為內參照。
2.5 細胞增殖實驗 取對數生長期細胞接種于96孔板,實驗分為正常對照組、scramble組、ANXA2過表達組及ANXA2-siRNA組。細胞貼壁后,棄去舊培養基,加入無血清培養液,放入培養箱孵育24 h。取出培養板,每孔加20 μL MTT,放入培養箱中繼續孵育4 h。小心吸棄上清,每孔加入150 μL DMSO,振蕩10 min使紫色結晶充分溶解,酶標儀于490 nm處測定各孔A值,記錄結果。
2.6 細胞遷移能力測定 將4組細胞(每組大約5×105個)分別懸浮在含有0.2%小牛血清的800 μL培養基中,依次接種至Boyden小室上層,培養6 h。收集遷移到濾膜下層的細胞,用甲醇固定,并通過HE染色來觀察下層細胞的數量,最后通過計算濾膜下層的細胞數來評估其轉移的細胞數量。
2.7 細胞凋亡測定 取對數生長期的HeLa細胞以1.5×105cells/well接種至 6孔板中,培養 24 h,0.25%胰蛋白酶消化收集細胞,1 000 r/min離心5min沉淀細胞,PBS洗滌2次后1 000 r/min離心沉淀細胞。將10×binding buffer稀釋至1×binding buffer,每個樣品加入300 μL 1×binding buffer,再加入5 μL Annexin V-FITC,室溫避光染色30 min。每個樣品加入5 μL PI,避光染色5 min后,再補加200 μL 1×binding buffer,吹打均勻后上機檢測細胞凋亡情況。
3 統計學處理
以SPSS 16.0統計軟件分析,數據以均數±標準差(mean±SD),組間比較采用方差分析,以P<0.05為差異有統計學意義。
結果
1 ANXA2過表達載體或siRNA轉染效果的鑒定
RT-PCR及Western blotting結果見圖1,與對照組相比,scramble組HeLa細胞中ANXA2 mRNA及蛋白表達水平幾乎無變化,而ANXA2過表達組mRNA及蛋白表達水平顯著升高,ANXA2-siRNA組mRNA及蛋白表達水平明顯降低(P<0.05)。
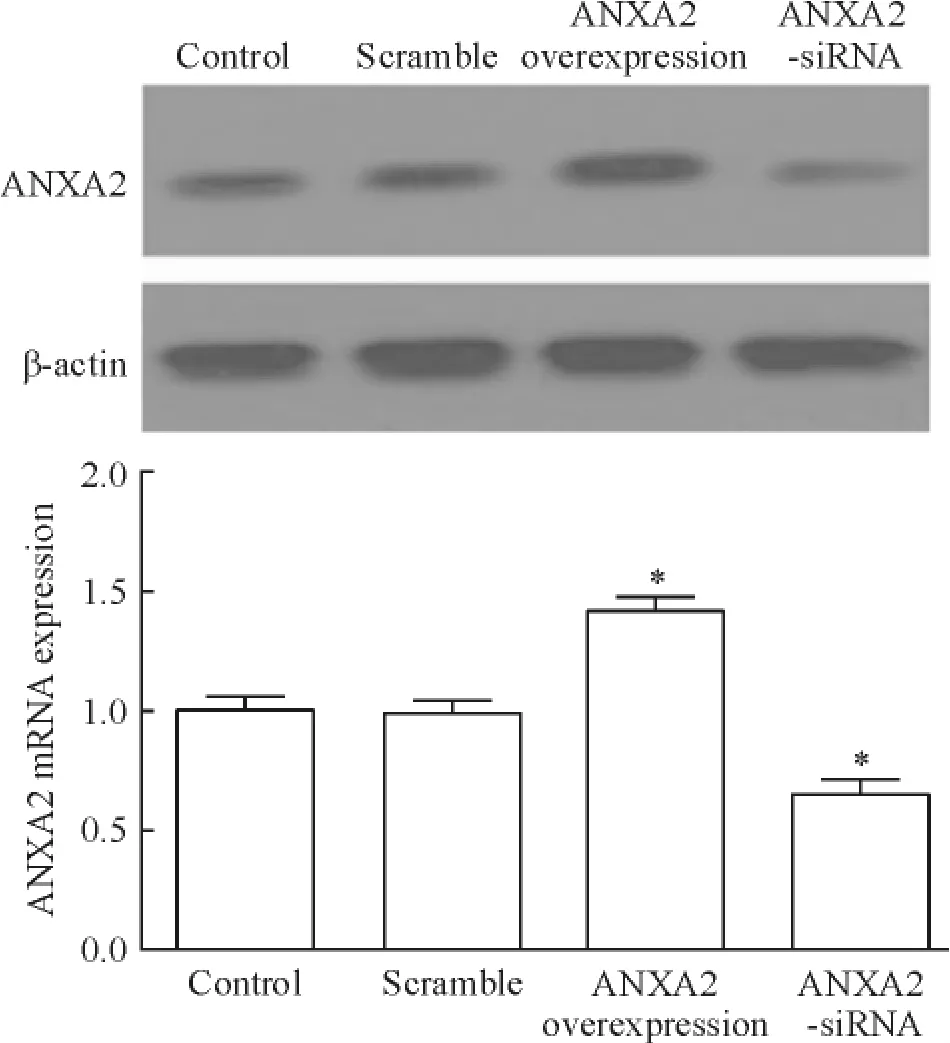
Figure 1.The transfection efficiency of ANXA2 overexpression vector or siRNA.Mean±SD.n=3.*P<0.05 vs control.圖1 ANXA2過表達載體或siRNA的轉染效果
2 ANXA2對HeLa細胞增殖的影響
MTT法測定結果見圖2,與對照組和scramble組相比,ANXA2過表達組可以顯著促進HeLa細胞的增殖,ANXA2-siRNA轉染組細胞的增殖受到明顯的抑制(P<0.05),而對照組和scramble組中HeLa細胞增殖的差異無統計學意義(P>0.05),提示沉默ANXA2能夠抑制宮頸癌HeLa細胞增殖。
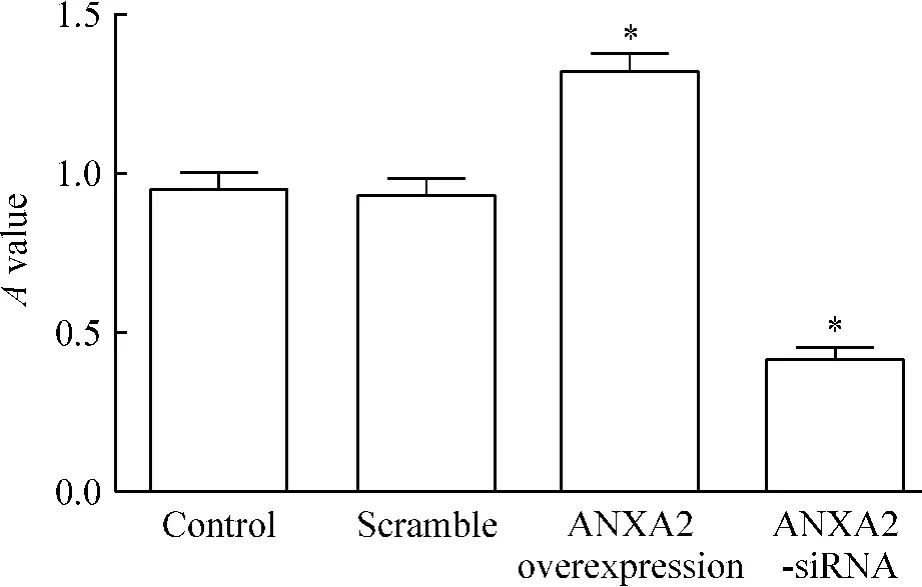
Figure 2.Effect of ANXA2 on HeLa cell proliferation.Mean± SD.n=3.*P<0.05 vs control.圖2 ANXA2對HeLa細胞增殖的影響
3 ANXA2對HeLa細胞遷移的影響
對照組和 scramble組細胞發生遷移數分別為(78.0±5.0)個和(75.0±4.1)個,差異無統計學意義(P>0.05),ANXA2過表達組細胞發生遷移數為(123.0±4.7)個,明顯高于對照組,而ANXA2-siRNA轉染組細胞發生遷移數為(39.0±3.9)個,明顯低于對照組(P<0.05),見圖3,表明沉默ANXA2能夠抑制宮頸癌HeLa細胞的遷移能力。
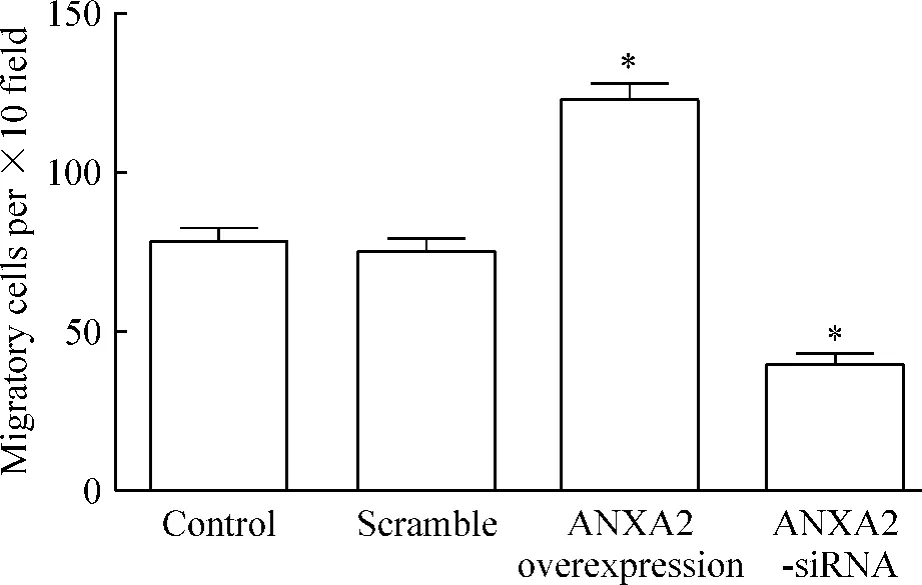
Figure 3.Effect of ANXA2 on HeLa cell migration.Mean±SD.n=3.*P<0.05 vs control.圖3 ANXA2對HeLa細胞遷移的影響
4 ANXA2對HeLa細胞凋亡的影響
流式細胞術檢測細胞凋亡結果見圖4,與對照組和scramble組相比,ANXA2過表達組和ANXA2-siRNA轉染組對HeLa細胞的凋亡無顯著影響,表明ANXA2不參與調控宮頸癌HeLa細胞的凋亡。
討論
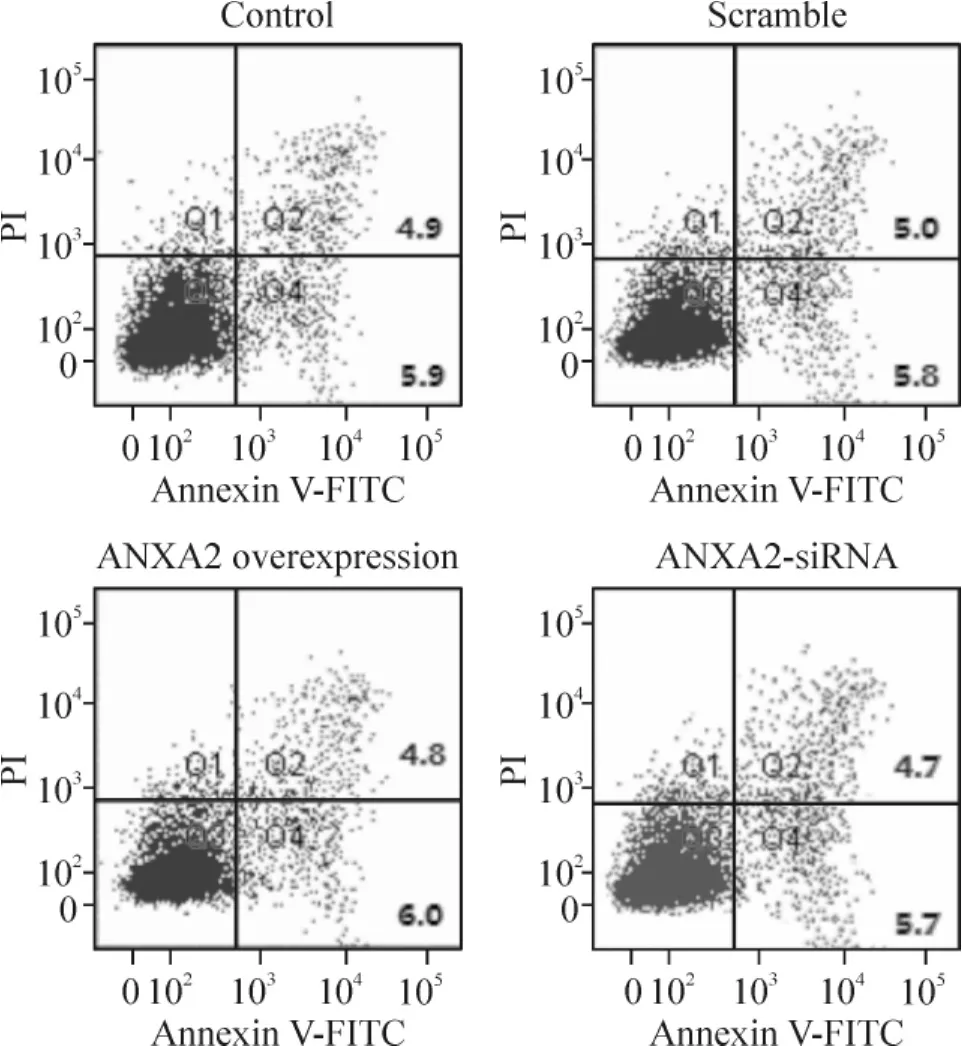
Figure 4.Effect of ANXA2 on HeLa cell apoptosis.圖4 ANXA2對HeLa細胞凋亡的影響
宮頸癌的發病與多因素的參與有關,但是具體發病機制至今仍不清楚,宮頸癌的發生發展與各種基因突變及基因表達紊亂密切相關[8-9]。而腫瘤的侵襲轉移是一個多因素、多步驟的復雜過程,涉及到腫瘤細胞與宿主之間復雜的相互作用,多種基因及其產物參與這一過程的調控。ANXA2在細胞內參與膜形成、膜轉運、胞吞、胞吐、細胞增殖、信號轉導、分化及凋亡等一系列重要的生命過程。ANXA2在腫瘤中的異常表達與腫瘤的發生、發展、侵襲、轉移及預后密切相關[10-11]。研究表明,上調ANXA2基因表達可促進人乳腺癌MCF-7細胞的增殖、遷移和侵襲能力[12]。對人肝癌細胞的研究發現,ANXA2干擾siRNA可以抑制人肝癌細胞的遷移和侵襲[13]。對宮頸癌細胞的研究發現,ANXA2表達水平低的患者對新輔助化療敏感性增加,表明ANXA2可能是誘導宮頸癌患者抵抗新輔助化療的一個重要因子,同時,宮頸癌患者基質細胞中ANXA2表達水平高,則生存率降低[14]。但是,關于ANXA2在宮頸癌HeLa細胞發生發展過程中的作用尚未見報道。
本研究通過ANXA2干擾siRNA和ANXA2過表達載體探討了ANXA2對宮頸癌HeLa細胞增殖、遷移和凋亡能力的影響。我們的研究結果表明,ANXA2對HeLa細胞凋亡基本無影響,沉默ANXA2基因能夠降低HeLa細胞的增殖、遷移能力;ANXA2過表達能夠增強HeLa細胞的增殖、遷移能力。本實驗結果提示,宮頸癌HeLa細胞與生長因子ANXA2的高表達密切相關,ANXA2可以成為宮頸癌治療的一個新靶點。雖然本研究證實了ANXA2在宮頸癌中發揮著重要作用,但是確切的信號途徑尚不清楚,有待于進一步探討。
[1]Eilstein D,Hedelin G,Schaffer P.Cervical cancer in Bas-Rhin:trend and prediction of the incidence in 2014[J].J Gynecol Obstet Biol Reprod(Paris),2002,31 (1):28-33.
[2]Vedeler A,Hollas H,Grindheim AK,et al.Multiple roles of annexin A2 in post-transcriptional regulation of gene expression[J].Curr Protein Pept Sci,2012,13(4): 401-412.
[3]Li PG,Yang YL,Ge YT.Roles of annexin A2 for the regulation of the growth and cytoskeleton of tumor cells[J].Sheng Li Ke Xue Jin Zhan,2010,41(6):457-460.
[4]Muimo R.Regulation of CFTR function by annexin A2-S100A10 complex in health and disease[J].Gen Physiol Biophys,2009,28(Spec No Focus):F14-F19.
[5]Domoto T,Miyama Y,Suzuki H,et al.Evaluation of S100A10,annexin II and B-FABP expression as markers for renal cell carcinoma[J].Cancer Sci,2007,98(1): 77-82.
[6]Yee DS,Narula N,Ramzy I,et al.Reduced annexin II protein expression in high-grade prostatic intraepithelial neoplasia and prostate cancer[J].Arch Pathol Lab Med,2007,131(6):902-908.
[7]Zhang HJ,Yao DF,Yao M,et al.Annexin A2 silencing inhibits invasion,migration,and tumorigenic potential of hepatoma cells[J].World J Gastroenterol,2013,19 (24):3792-3801.
[8]Peralta-Zaragoza O,Bermudez-Morales VH,Madrid-Marina V.RNA interference:biogenesis molecular mechanisms and its applications in cervical cancer[J].Rev Invest Clin,2010,62(1):63-80.
[9]秦瑞英,夏永華,任艷芳,等.AEG-1表達下調對人宮頸癌細胞細胞周期和侵襲能力的影響及其機制[J].中國病理生理雜志,2013,29(6):1020-1024.
[10]Lokman NA,Elder AS,Ween MP,et al.Annexin A2 is regulated by ovarian cancer-peritoneal cell interactions and promotes metastasis[J].Oncotarget,2013,4(8): 1199-1211.
[11]李秀娟,劉桂桃,張志強,等.應用蛋白質組學和組織芯片研究annexin A2在胃癌中的表達[J].中國病理生理雜志,2012,28(4):619-624.
[12]Wu B,Zhang F,Yu M,et al.Up-regulation of Anxa2 gene promotes proliferation and invasion of breast cancer MCF-7 cells[J].Cell Prolif,2012,45(3):189-198.
[13]Zhang W,Zhao P,Xu XL,et al.Annexin A2 promotes the migration and invasion of human hepatocellular carcinoma cells in vitro by regulating the shedding of CD147-harboring microvesicles from tumor cells[J].PLoS One,2013,8(8):e67268.
[14]Jin L,Shen Q,Ding S,et al.Immunohistochemical expression of Annexin A2 and S100A proteins in patients with bulky stage IB-IIA cervical cancer treated with neoadjuvant chemotherapy[J].Gynecol Oncol,2012,126 (1):140-146.
Effect of annexin A2 on proliferation,migration and apoptosis of human cervical cancer HeLa cells
WEI Jian-xun,MA Wen-jun,LI Hong-mei
(Department of Obstetrics and Gynaecology,Affiliated Hospital of Yanan University,Yanan 716000,China.E-mail:submission029@gmail.com)
AIM:To explore the effect of annexin A2(ANXA2)on the proliferation,migration and apoptosis abilities of human cervical cancer HeLa cells.METHODS:Overexpression vectors and siRNA of ANXA2 were constructed,and then transfected into HeLa cells.The HeLa cells were divided into 4 groups:control group,scramble group,ANXA2 overexpression group and ANXA2-siRNA group.The expression of ANXA2 at mRNA and protein levels was examined by real-time PCR and Western blotting.MTT assay,Boyden chamber and flow cytometry were used to determine the effect of ANXA2 on the proliferation,migration and apoptosis abilities of the HeLa cells.RESULTS:The proliferation and migration of HeLa cells were obviously promoted by ANXA2 overexpression.The proliferation and migration of HeLa cells were remarkably inhibited by the transfection of ANXA2-siRNA.ANXA2 had no effect on apoptosis of HeLa cells.CONCLUSION:Silencing of ANXA2 effectively inhibits the proliferation and migration of cervical cancer cells,but has little effect on apoptosis.ANXA2 may play a pivotal role in the occurrence and development of cervical cancer,and may be used as a molecular target for the treatment of cervical cancer.
Annexin A2;HeLa cells;Cell proliferation;Cell migration;Apoptosis
R737.33
A
10.3969/j.issn.1000-4718.2014.03.029
1000-4718(2014)03-0547-04
2013-10-31
2014-01-13
△通信作者Tel:0911-2881213;E-mail:submission029@gmail.com

