G蛋白偶聯受體56基因敲除抑制少突膠質前體細胞成熟*
鄧醫宇, 朱高峰, 方 明, 曾文新, 蔣文新, 曾紅科
(廣東省人民醫院,廣東省醫學科學院急危重癥醫學部,廣東廣州 510080)
G蛋白偶聯受體56基因敲除抑制少突膠質前體細胞成熟*
鄧醫宇, 朱高峰, 方 明, 曾文新, 蔣文新, 曾紅科△
(廣東省人民醫院,廣東省醫學科學院急危重癥醫學部,廣東廣州 510080)
目的:探討G蛋白偶聯受體56(GPR56)基因敲除對小鼠腦胼胝體內軸突髓鞘化和少突膠質前體細胞(OPCs)成熟的影響。方法:篩選出GPR56基因雜合型(GPR56+/-)和敲除型(GPR56-/-)小鼠36只,分為GPR56+/-和GPR56-/-組,每組18只。每組根據小鼠出生后時間分為出生后7 d(P7)、14 d(P14)、21 d(P21)和28 d(P28)4個亞組。應用FluoroMyelin染色觀察P14、P21和P28 GPR56+/-和GPR56-/-小鼠腦胼胝體內髓鞘形成。用電鏡觀察P28 GPR56+/-和GPR56-/-小鼠胼胝體內軸突髓鞘化,比較髓鞘的厚度。用熒光免疫組化染色觀察P7 GPR56+/-和GPR56-/-小鼠胼胝體內血小板源性生長因子α受體陽性(PDGF-αR+)細胞(即OPCs)的數量。用原位雜交監測P28 GPR56+/-和GPR56-/-小鼠胼胝體內髓鞘蛋白脂質蛋白陽性(PLP+)細胞數。用出生后1 d的GPR56+/-和GPR56-/-小鼠腦皮質做體外OPCs培養并誘導其分化成熟,觀察pro-oligodendroblast、immature oligodendrocyte和mature oligodendrocyte階段 O4+細胞百分比。結果:與 GPR56+/-小鼠比較,在 P14、P21和 P28 GPR56-/-小鼠腦胼胝體中髓鞘的形成明顯減少。電鏡見P28 GPR56-/-小鼠腦胼胝體內髓鞘化軸突的數量明顯減少,髓鞘g-ratio值變大,髓鞘厚度變薄。熒光免疫組化和原位雜交結果顯示P7 GPR56+/-和GPR56-/-小鼠胼胝體內PDGF-aR+細胞數量無差異,但P28 GPR56+/-小鼠胼胝體內PLP+細胞數明顯多于P28 GPR56-/-小鼠。體外細胞培養結果顯示在pro-oligodendroblast階段GPR56-/-O4+細胞百分比明顯多于GPR56+/-O4+細胞,在immature oligodendrocyte和mature oligodendrocyte階段 GPR56-/-O4+細胞百分比明顯少于 GPR56+/-O4+細胞。結論:GPR56蛋白可能參與了腦白質軸突髓鞘化和OPCs的成熟。
G蛋白偶聯受體56;胼胝體;少突膠質細胞;髓鞘化
軸突的髓鞘化是一個復雜的生理過程,需要大量的信號分子參與[1]。少突膠質前體細胞(oligodendrocyte precursor cells,OPCs)分化成熟、神經元軸突發育、成熟少突膠質細胞(oligodendrocytes,OLs)向目標軸突的遷移和OLs突起黏附到神經元軸突上發生相互作用均是軸突髓鞘化的重要環節[2]。近年來研究發現一些黏附性G蛋白偶聯受體(Adhesion G-protein-coupled receptors,adhesion GPRs)可能參與了軸突的髓鞘化過程[3-4]。有研究發現Gpr126突變可導致金魚軸突髓鞘化障礙[5],Gpr126基因突變的老鼠也表現嚴重的低髓鞘化周圍神經病變[6]。GPR17在少突膠質細胞系特異地表達,但在軸突髓鞘化的高峰期和成熟的OLs中表達減少,Gpr17過度表達或敲除均會導致軸突髓鞘化異常[7-8]。
GPR56屬于黏附性G蛋白偶聯受體家族。既往報道表明:人GPR56基因發生突變會導致雙側大腦皮層多小腦溝回畸形和白質發育缺陷[9]。GPR56基因突變所致的白質萎縮和局灶MRI-T2強信號類似于多發性硬化的病理改變[10],提示GPR56有可能參與了腦白質的發育和軸突髓鞘化。為了證實GPR56蛋白是否參與神經元軸突的發育和髓鞘化,本研究利用GPR56基因敲除(GPR56-/-)小鼠,用Fluoro-Myelin染色觀察不同年齡階段 GPR56+/-和GPR56-/-小鼠胼胝體內髓鞘形成情況,用電鏡觀察成年GPR56+/-和GPR56-/-小鼠胼胝體內軸突髓鞘比例及髓鞘的厚度,從而證實GPR56基因敲除是否導致軸突髓鞘化障礙。同時,采用血小板源性生長因子 α受體(platelet-derived growth factor alpha receptor,PDGF-aR)免疫熒光染色、蛋白脂質蛋白(proteolipid protein,PLP)原位雜交技術及體外OPCs培養進一步證實GPR56基因敲除是否會導致OPCs分化成熟障礙,從而引起軸突低髓鞘化。
材料和方法
1 材料
GPR56基因敲除小鼠從美國哈佛大學醫學院附屬波士頓兒童醫院Piao Xianhua博士實驗室贈獲。GPR56+/-和GPR56-/-小鼠在暨南大學醫學院實驗動物中心飼養,實驗條件下自然飲食。購買商業化抗體和試劑盒:兔抗PDGF-aR(Santa Cruz)、鼠抗O4 (Chemicon)和 FluoroMyelin試劑盒(Life Technologies)。
2 方法
2.1 實驗設計 將出生后小鼠進行基因分型,分為GPR56+/-和GPR56-/-組。每組在出生后7 d(P7)、14d(P14)、21d(P21)和28d(P28)各取3只小鼠進行灌流固定后行FluoroMyelin染色、免疫熒光組織化學染色或PLP原位雜交。每組在出生后28 d各取3只小鼠進行電鏡檢測。各組動物數見表1。
表1 GPR56+/-和GPR56-/-組在不同時點使用小鼠的數量Table 1.Numbers of mice at various time points in GPR56+/-group and GPR56-/-group
2.2 FluoroMyelin染色 FluoroMyelin染色能夠快速和選擇性標記冰凍腦切片內髓鞘的分布。將腦切片放在室溫下用PBS漂洗20 min,同時將FluoroMyelin原液稀釋300倍,隨后將稀釋的FluoroMyelin染色液滴加到腦切片上,在室溫下染色20 min。染色完成后,用PBS漂洗3次,每次10 min。最后封片,在熒光顯微鏡下觀察腦胼胝體內髓鞘的分布。
2.3 免疫組織化學染色 每組動物灌流、固定后移入30%蔗糖溶液過夜。冰凍切片機-20℃低溫取視交叉水平冠狀切片,片厚20 μm。正常工作血清封閉。用兔抗PDGF-aRⅠ抗4℃孵育過夜后,PBS清洗3次,每次10 min,滴加帶紅色熒光的Ⅱ抗工作液室溫下孵育1 h。PBS清洗3遍后用 mounting medium封片。在熒光顯微鏡(Olympus System Microscope Model BX53)下觀察結果。
2.4 PLP探針原位雜交 -70℃保存的切片在室溫下放置30 min,直至切片回到室溫,再放到50℃雜交爐中烤片烤20 min;DEPC-PBS洗片5 min;4% DEPC的多聚甲醛中前固定20 min,洗片;蛋白酶K緩沖液處理組織切片,洗片;后固定30 min;置于新配制的TEA緩沖液洗10 min;將切片浸在預雜交液中放入63~65℃的雜交爐中預雜交3~4 h;制備濕盒(干的雜交盒底部加用過的預雜交液),將含8 ng/ 100 μL地高辛標記PLP探針的雜交液加在切片上;放入65℃的雜交爐中雜交12~16 h;65℃,在預熱的0.2 mol/L SSC中洗掉蓋玻片;用PBT洗2次,每次20 min;10%血清(PBT稀釋)封閉30 min;倒去切片上的血清,不洗,加含1∶2 000的抗地高辛抗體的血清孵育3 h;PBT洗6次,每次10 min;堿性磷酸酶緩沖液洗2次,每次5 min;加顯色液,避光,顯色; PBS終止顯色反應;4%多聚甲醛固定1~2 h;PBS漂洗,甘油封片劑封片,室溫保存。
2.5 電鏡 出生后28 d GPR56+/-和GPR56-/-小鼠各3只用2%甲醛+3%戊二醛溶液灌流固定后,取大腦胼胝體制成1 mm×1 mm×1 mm組織塊。用振蕩切片機將組織塊切成80~100 μm的切片。0.1 mol/L磷酸鹽緩沖液漂洗后,用1%四氧化鋨后固定2 h,脫水、樹脂包埋。切超薄切片,在Philips CM 120電鏡(FEI Company)下觀察。從每只動物胼胝體近中側取 4個非重疊視野,拍不同倍數的照片。用ImageJ軟件測量每個神經纖維軸突和總神經纖維(軸突+髓鞘)的直徑。用公式g-ratio=神經纖維軸突直徑/總神經纖維(軸突+髓鞘)的直徑計算g-ratio值。這個公式等同于神經纖維軸突橫截面積除以總神經纖維的橫截面積。比較 GPR56+/-和GPR56-/-小鼠神經纖維直徑的大小。
2.6 體外OPC培養、誘導分化成熟及O4免疫組化染色 將新生 1 d小鼠進行基因分型后分為GPR56+/-和GPR56-/-組,分別進行少突膠質前體細胞培養。將小鼠斷頭,分離鼠腦,置于PBS中,剝去血管腦膜,分離皮質,剪碎。胰酶消化15 min后吹散,篩網過濾。800 r/min離心2 min后棄上清,細胞沉淀用DMEM培養基懸浮,計數細胞密度,接種于25 cm2塑料培養瓶中,在37℃、5%CO2的培養箱中培養。每隔3 d換液1次,培養至第7~10天,細胞融合。將培養瓶置于恒溫水平搖床上,37℃、120~150 r/min、1 h,以除去小膠質細胞。丟棄細胞懸液,加入混合細胞培養基,再在恒溫水平搖床上,37℃、230~260 r/min、18~20 h。吸出懸液靜置于未涂多聚賴氨酸的培養瓶內,37℃、5%CO2的培養箱中靜置30 min,去除少量胞體較大的星形膠質細胞和成纖維細胞。吸取細胞懸液,1 500 r/min離心5 min,棄上清,加入OPCs培養基,重懸細胞,以1×104/cm2密度接種于賴氨酸包被的24孔板中,用OPC分化培養基誘導OPCs分化成熟。培養5 d后用PBS漂洗,4%多聚甲醛固定30 min,按常規免疫熒光細胞化學方法進行O4染色。在熒光顯微鏡下隨意選取不同的視野拍照,根據O4+細胞特異性形態計算pro-oligodendroblast、immature oligodendrocyte和 mature oligodendrocyte階段O4+細胞百分比。
3 統計學處理
計量資料以均數±標準差(mean±SD)表示,兩組之間比較用t檢驗。以P<0.05為差異有統計學意義。
結果
1 GPR56+/-和GPR56-/-小鼠胼胝體內髓鞘形成和分布
FluoroMyelin染色顯示髓鞘主要分布在腦胼胝體內。同時,與 GPR56+/-小鼠相比,髓鞘在 P14、P21和P28 GPR56-/-小鼠胼胝體中形成和分布明顯降低,見圖1。
2 電鏡觀察GPR56+/-和GPR56-/-小鼠胼胝體中軸突髓鞘化
在低倍鏡下可以觀察到P28 GPR56-/-小鼠胼胝體中發生髓鞘化的軸突數目明顯減少,而在P28 GPR56+/-小鼠胼胝體中發生髓鞘化的軸突數目明顯增多。在P28 GPR56+/-小鼠胼胝體中軸突髓鞘在高倍電鏡下為明暗相間的同心圓板層排列,結構完整,板層致密,邊緣光滑。在P28 GPR56-/-小鼠胼胝體中軸突髓鞘在高倍電鏡下可見髓鞘板層紊亂,髓鞘與軸索間隙增大,外形不規則,有空泡出現;高倍鏡下顯示P28d GPR56-/-小鼠胼胝體中軸突髓鞘厚度明顯變薄。與P28 GPR56+/-小鼠軸突髓鞘相比,P28 GPR56-/-小鼠胼胝體中軸突髓鞘的g-ratio值明顯變大(P<0.05),見圖2。g-ratio值越大,軸突髓鞘越薄。這些結果進一步表明GPR56基因敲除使軸突髓鞘變薄,軸突髓鞘化發生障礙。
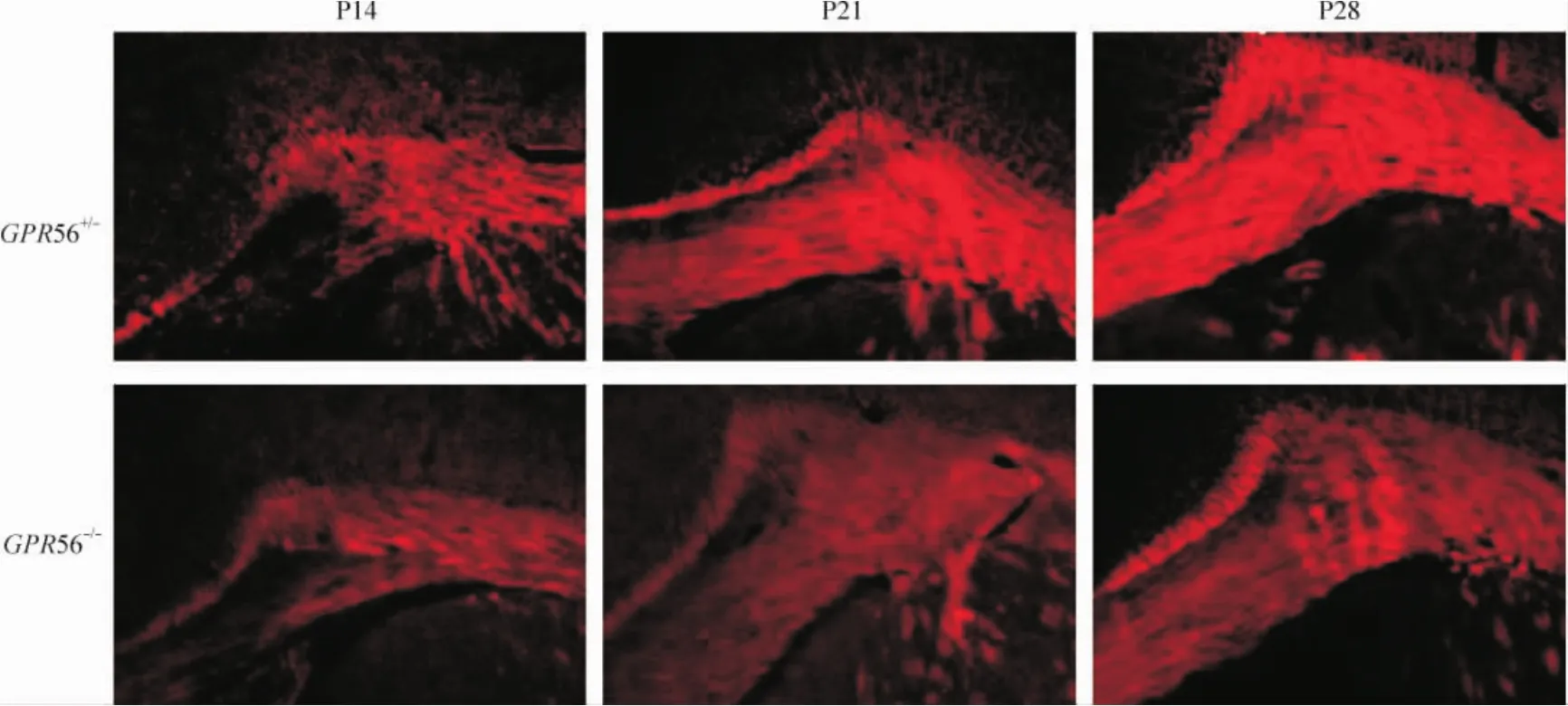
Figure 1.Distribution of myelin sheath in the corpus callosum of P14,P21 and P28 GPR56+/-and GPR56-/-mice(FluoroMyelin staining,×100).圖1 髓鞘在GPR56+/-和GPR56-/-小鼠胼胝體內分布
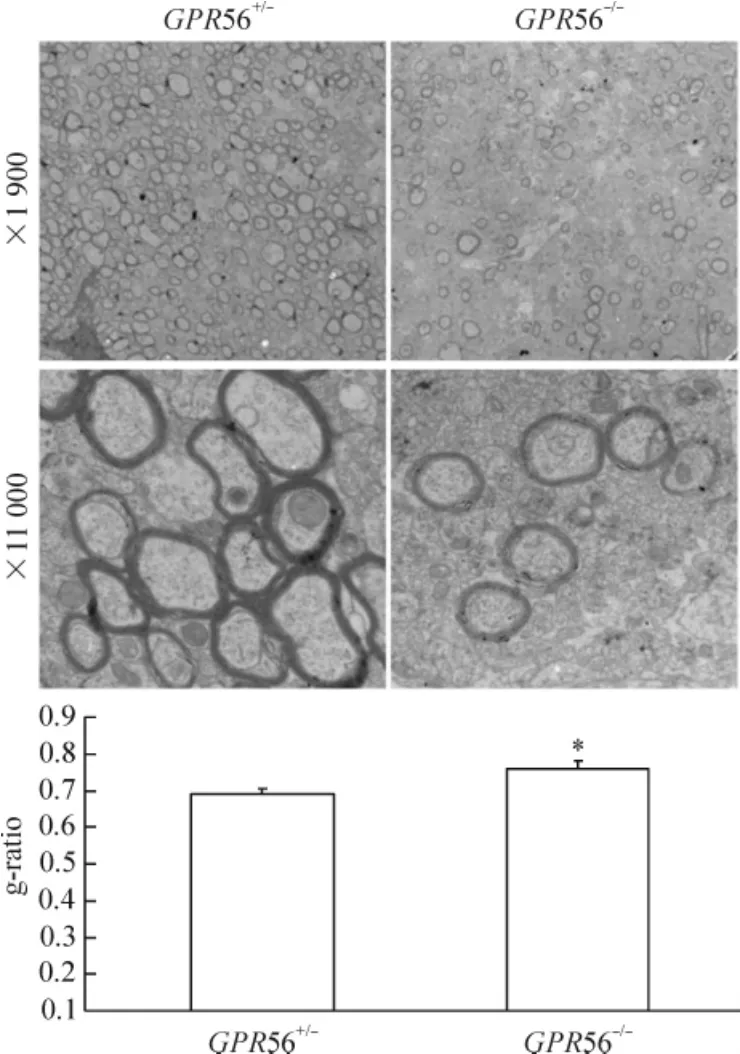
Figure 2.Electron microscopy showing axonal myelination in the corpus callosum cross-sections collected from P28 GPR56-/-and littermate control GPR56+/-mice.Mean±SD.n=3.*P<0.05 vs GPR56+/-.圖2 電鏡示P28 GPR56+/-和GPR56-/-小鼠胼胝體中軸突髓鞘化
3 GPR56基因敲除對OPCs成熟的影響
用PDGF-aR抗體特異染色發現,PDGF-aR陽性細胞主要分布在腦胼胝體內,見圖3。細胞計數發現,在P7 GPR56-/-小鼠胼胝體內PDGF-aR+細胞數與P7 GPR56+/-小鼠,比較沒有顯著差異,見圖3。在低倍鏡下,原位雜交顯示在P28 GPR56-/-小鼠胼胝體內PLP+細胞數明顯少于P28 GPR56+/-小鼠,見圖4。在高倍鏡下,我們選不同的視野進行統計學分析發現在P28 GPR56+/-小鼠胼胝體內PLP+細胞數明顯多于P28 GPR56-/-小鼠(P<0.01),見圖4。這些結果表明GPR56基因敲除不影響早期OPCs的生存,而抑制了OPCs分化成熟。

Figure 3.The numbers of PDGF-aR+cells in the corpus callosum of P7 GPR56+/-and GPR56-/-mice(immunofluorescence staining,×200).Mean±SD.n=3.圖3 P7 GPR56+/-和GPR56-/-小鼠胼胝體內PDGF-aR+細胞數
4 Pro-oligodendroblast、immature oligodendrocyte和mature oligodendrocyte階段O4+細胞百分比
在pro-oligodendroblast階段O4+細胞形態有較少的突起,在immature oligodendrocyte階段O4+細胞有很多突起,相互交錯成網格狀,在mature oligodendrocyte階段O4+細胞有髓鞘形成,呈現地圖狀,見圖5A。在同等誘導成熟條件下,相同數目GPR56+/-和GPR56-/-OPCs在誘導分化成熟5 d后進行O4染色發現,在pro-oligodendroblast階段GPR56-/-O4+細胞百分比明顯多于GPR56+/-O4+細胞,而在im-mature oligodendrocyte和 mature oligodendrocyte階段GPR56-/-O4+細胞百分比明顯少于GPR56+/-O4+細胞,見圖5B。這些結果進一步在體外表明GPR56基因敲除可以抑制OPCs分化和成熟。
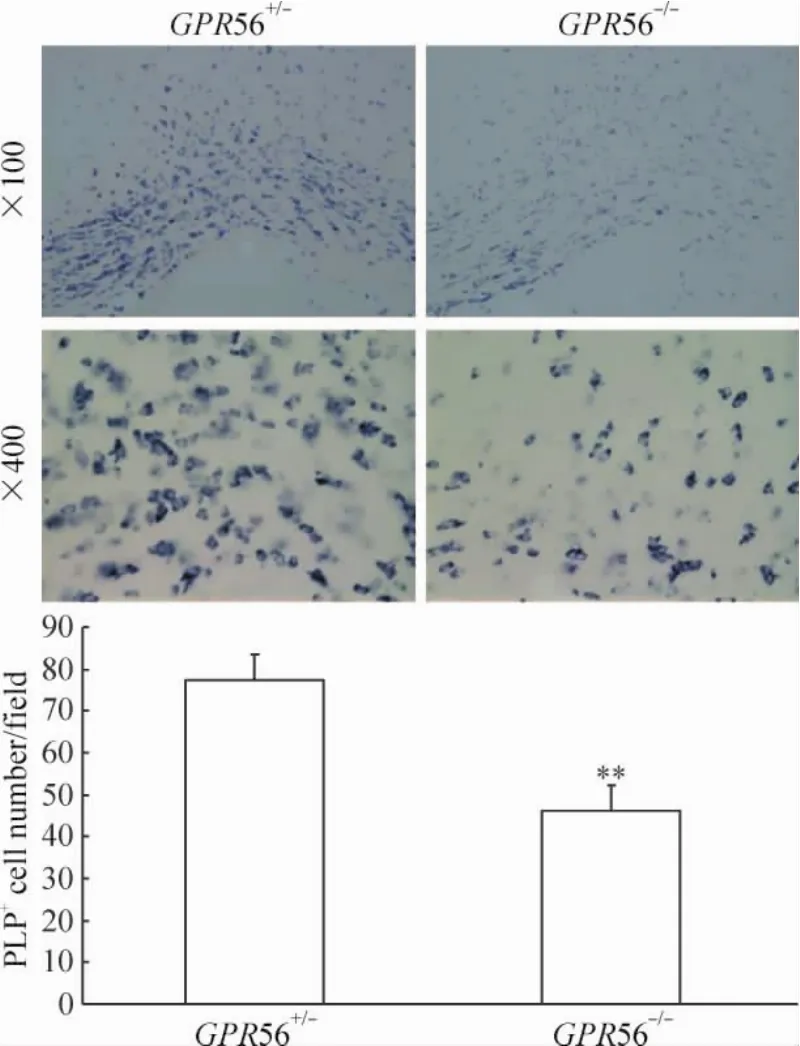
Figure 4.In situ hybridization showing the numbers of PLP+cells in the corpus callosum of P28 GPR56+/-and GPR56-/-mice.Mean±SD.n=3.**P<0.01 vs GPR56+/-.圖4 原位雜交示P28 GPR56+/-和GPR56-/-小鼠胼胝體內PLP+細胞數
討論
FluoroMyelin染色是利用軸突髓鞘含脂量高進行的一種親脂性染色[11]。與傳統的髓鞘染色方法相比FluoroMyelin染色步驟簡短,耗時短,只需20 min就可以顯示出軸突髓鞘的定位和含量[11]。另外,特異性好,它對細胞膜的脂質親和力低,對髓鞘內脂質的親和力高,因此能夠特異地顯示軸突髓鞘[11]。目前很多研究者采用此方法研究軸突髓鞘[12]。我們的研究結果顯示:GPR56基因敲除后在小鼠胼胝體內軸突髓鞘形成明顯減少。電鏡結果發現:在 P28 GPR56-/-小鼠胼胝體內髓鞘化軸突的數目明顯減少,髓鞘的厚度變薄。電鏡發現與FluoroMyelin染色結果一致,進一步證實了GPR56基因參與了軸突的髓鞘化過程。
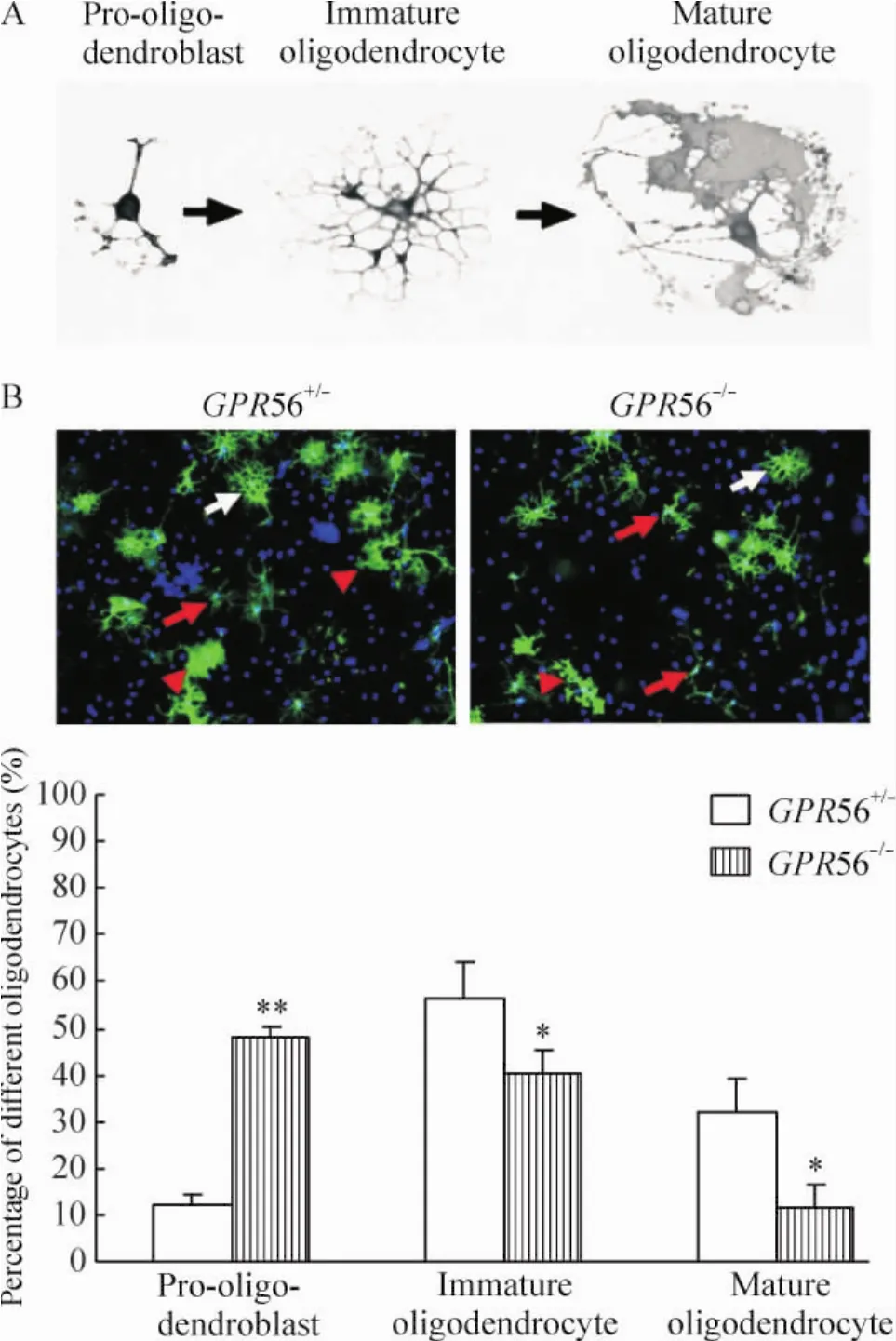
Figure 5.O4 staining showing GPR56+/-and GPR56-/-OPCs differentiation in vitro.A:schematic diagram of the morphology of O4+oligodendrocytes at different stages;B:O4 immunostaining of the primary oligodendrocytes(×200).The red arrows represent OPCs at pro-oligo-dendroblast stage.The white arrows represent OPCs at immature oligodendrocyte stage.The red arrow heads represent OPCs at mature oligodendrocyte stage.Mean±SD.n=3.*P<0.05,**P<0.01 vs GPR56+/-.圖5 O4染色顯示GPR56+/-和GPR56-/-少突膠質細胞體外分化情況
軸突的髓鞘化是成熟少突膠質細胞突起纏繞軸突形成的多層脂質髓鞘,此過程包括3個方面:(1) OPCs分化成熟;(2)神經元軸突成熟;(3)成熟OLs向目標軸突的遷移、OLs突起黏附到神經元軸突上和OLs突起纏繞軸突形成髓鞘[13]。OPCs的分化和成熟在軸突髓鞘化中起著關鍵作用。成熟的OLs來源于OPCs。OPCs分化為成熟的OLs要經歷Pre-O-2A、O-2A progenitor、pro-oligodendroblast、immature oligodendrocyte和 mature oligodendrocyte 5個發育階段[14]。有很多基因參與OPCs上述的分化成熟的調控[15-16]。那么,GPR56基因是否參與了OPCs分化成熟的調控?為了證實這一點,我們對P7 GPR56+/-和GPR56-/-小鼠胼胝體進行PDGF-aR免疫染色,對P28 GPR56+/-和GPR56-/-小鼠胼胝體進行PLP原位雜交染色,然后進行PDGF-aR+和PLP+細胞計數,比較兩者差異。PDGF-aR+細胞是OPCs發育早期階段的細胞,PLP+細胞是成熟的OLs。我們研究發現:P7 GPR56+/-和 GPR56-/-小鼠胼胝體內PDGF-aR+細胞數沒有明顯差別,但P28GPR56-/-小鼠胼胝體 PLP+細胞即成熟的 OLs明顯少于 P28 GPR56+/-小鼠。這表明 GPR56基因不影響早期OPCs生存,而影響OPCs分化成熟。為了進一步證實這個結論,我們在體外進行 GPR56+/-和GPR56-/-OPCs培養并誘導分化成熟,發現GPR56-/-OPCs分化成熟能力明顯降低。因此,體外細胞培養實驗結果與動物實驗結果一致。建立在這些實驗基礎之上,我們可以推測GPR56蛋白是OPCs分化成熟所必需,缺乏它會導致OPCs成熟障礙,從而也會導致腦白質低髓鞘化。這一發現對于我們理解和治療軸突髓鞘化障礙相關性疾病有極其重要的意義。
[1]Zuccaro E,Arlotta P.The quest for myelin in the adult brain[J].Nat Cell Biol,2013,15(6):572-575.
[2]Emery B.Regulation of oligodendrocyte differentiation and myelination[J].Science,2010,330(5):779-782.
[3]Bjarnadottir TK,Fredriksson R,Schioth HB.The adhesion GPCRs:a unique family of G protein-coupled receptors with important roles in both central and peripheral tissues[J].Cell Mol Life Sci,2007,64(16):2104-2119.
[4]Strokes N,Piao X.Adhesion-GPCRs in the CNS[J].Adv Exp Med Biol,2010,706:87-97.
[5]Monk KR,Naylor SG,Glenn TD,et al.A G protein-coupled receptor is essential for Schwann cells to initiate myelination[J].Science,2009,325(5946):1402-1405.
[6]Monk KR,Oshima K,Jors S,et al.Gpr126 is essential for peripheral nerve development and myelination in mammals[J].Development,2011,138(13):2673-2680.
[7]Chen Y,Wu H,Wang S,et al.The oligodendrocyte-specific G protein-coupled receptor GPR17 is a cell-intrinsic timer of myelination[J].Nat Neurosci,2009,12(11): 1398-1406.
[8]Ceruti S,Vigano F,Boda E,et al.Expression of the new P2Y-like receptor GPR17 during oligodendrocyte precursor cell maturation regulates sensitivity to ATP-induced death[J].Glia,2011,59(3):363-378.
[9]Luo R,Jeong SJ,Jin Z,et al.G protein-coupled receptor 56 and collagen III,a receptor-ligand pair,regulates cortical development and lamination[J].Proc Natl Acad Sci U S A,2011,108(31):12925-12930.
[10]Chang BS,Piao X,Bodell A,et al.Bilateral frontoparietal polymicrogyria:clinical and radiological features in 10 families with linkage to chromosome 16[J].Ann Neurol,2003,53(5):596-606.
[11]Monsma PC,Brown A.FluoroMyelinTMRed is a bright,photostable and non-toxic fluorescent stain for live imaging of myelin[J].J Neurosci Methods,2012,209(2):344-350.
[12]Payne SC,Bartlett CA,Harvey AR,et al.Myelin sheath decompaction,axon swelling,and functional loss during chronic secondary degeneration in rat optic nerve[J].Invest Ophthalmol Vis Sci,2012,53(10):6093-6101.
[13]Nave KA.Myelination and support of axonal integrity by glia[J].Nature,2010,468(7321):244-252.
[14]Armstrong RC.Isolation and characterization of immature oligodendrocyte lineage cells[J].Methods,1998,16 (3):282-292.
[15]Emery B.Transcriptional and post-transcriptional control of CNS myelination[J].Curr Opin Neurobiol,2010,20 (5):601-607.
[16]夏君慧,翁益云,李 佳,等.重組人髓鞘少突膠質細胞糖蛋白的表達、純化及免疫原性[J].中國病理生理雜志,2011,27(6):1245-1248.
Knockout of GPR56 gene inhibits maturation of oligodendrocyte progenitor cells
DENG Yi-yu,ZHU Gao-feng,FANG Ming,ZENG Wen-xin,JIANG Wen-xin,ZENG Hong-ke
(Emergency and Critical Care Department,Guangdong General Hospital,Guangdong Academy of Medical Sciences,Guangzhou 510080,China.E-mail:zenghongke@vip.163.com)
AIM:To explore the effect of G-protein-coupled protein 56(GPR56)gene knockout on axonal myelination and the maturation of oligodendrocyte progenitor cells(OPCs)in the corpus callosum of mouse brain.METHODS:Thirty-six GPR56+/-and GPR56-/-mice were selected and divided into GPR56+/-group and GPR56-/-group (18 mice in each group).According to the postnatal days,the mice in each group were further divided into P7,P14,P21 and P28 subgroups.Myelin formation in the corpus callosum of P14,P21 and P28 GPR56+/-and GPR56-/-mice was observed by FluoroMyelin staining.The number of myelinated axons and thickness of myelin sheaths were measured by electron microscopy.The numbers of platelet-derived growth factor alpha receptor-positive(PDGF-aR+)and proteolipid protein-positive(PLP+)cells in the corpus callosum of GPR56+/-and GPR56-/-mice were compared by the methods of immunofluorescence and in situ hybridization.GPR56+/-and GPR56-/-OPCs were cultured using P1 GPR56+/-and GPR56-/-mouse brain cortex and induced differentiation and maturation in vitro.The percentage of GPR56+/-and GPR56-/-O4+cells in pro-oligodendroblast,immature oligodendrocyte and mature oligodendrocyte stages was compared by O4 immunostaining.RESULTS:The myelin formation was obviously reduced in the corpus callosum of P14,P21 andP28 GPR56-/-mice as compared with GPR56+/-mice.The number of myelinated axons was obviously reduced and the gratio value was increased significantly in the corpus callosum of P28 GPR56-/-mice.No significant difference of the PDGF-aR+cell number in the corpus callosum between P7 d GPR56+/-and GPR56-/-mouse brains was observed.The number of PLP+cells was significantly decreased in the corpus callosum of P28 GPR56-/-mice as compared with GPR56+/-mice.The percentage of GPR56-/-O4+cells in pro-oligodendroblast stages was obviously higher than that of GPR56+/-O4+cells.On the contrary,the percentages of GPR56-/-O4+cells in immature oligodendrocyte and mature oligodendrocyte stages were significantly reduced.CONCLUSION:GPR56 may be involved in axonal myelination and OPCs maturation in the corpus callosum of mouse brain.
G-protein-coupled receptor 56;Corpus callosum;Oligodendrocytes;Myelination
R363
A
10.3969/j.issn.1000-4718.2014.03.013
1000-4718(2014)03-0454-06
2013-11-06
2014-01-13
國家自然科學基金資助項目(No.81271329)
△通訊作者Tel:020-83837812-60228;E-mail:zenghongke@vip.163.com

