激活β3腎上腺素能受體對心衰家兔室性心律失常及心率變異性、心率震蕩的影響
李海濤,吳明,馬建林,林勁,張敬文,王裕岱,韓麗娟
(海南省人民醫院心血管病臨床診療中心1、病案室2,海南海口 570311)
激活β3腎上腺素能受體對心衰家兔室性心律失常及心率變異性、心率震蕩的影響
李海濤1,吳明1,馬建林1,林勁1,張敬文1,王裕岱1,韓麗娟2
(海南省人民醫院心血管病臨床診療中心1、病案室2,海南海口 570311)
目的觀察給予β3腎上腺素能受體(β3-AR)激動劑及抑制劑其對心力衰竭兔心律失常及心率變異性、心率震蕩的影響。方法構建容量及壓力負荷型心力衰竭家兔模型,動態心電圖同步記錄給藥期間心律失常并進行心率變異性與心律震蕩分析,比較平均正常RR間期的標準差(SDNN)、低頻成分(LF)、高頻成分(HF)、低頻與高頻比值(LF/HF)、震蕩初始(TO)和震蕩斜率(TS)。結果給予β3-AR激動劑顯著降低室性心律失常發生率(P<0.05),增加SDNN、LF、HF、LF/HF值(P<0.05)及降低TO值,增加TS值(P<0.05),給予β3-AR抑制劑可以拮抗上述效應。結論激動β3腎上腺素能受體可減少心力衰竭室性心律失常發生,可能與其對交感神經張力平衡相關。
β3腎上腺素能受體;室性心律失常;心率變異性;心率震蕩;心力衰竭

心衰是一種復雜的病理生理綜合征,機體會產生一系列結構和功能的代償反應,如心室收縮末期容積增加、心肌肥厚、交感神經興奮性增強、腎素-血管緊張素系統激活等[1]。其中交感神經興奮性增強是心力衰竭時主要神經體液代償機制之一[2]。然而這種代償機制的長期存在,可能在心力衰竭進展至晚期時轉化為促使心律失常特別是室性心律失常發生的重要因素[3]。大量的基礎和臨床研究發現心衰時β3腎上腺素能受體(β3-AR)的表達顯著升高,目前有關β3腎上腺素能受體與心力衰竭心律失常關系的研究多集中在其表達及其下游信號通路功能的調節,但其對心衰心律失常及對心臟交感神經張力與相關臨床惡性心律失常危險分層預測指標的影響尚無明確的結論。
1 材料與方法
1.1 實驗動物及分組選取成年新西蘭大耳白兔24只,雌雄不拘,體重2~3 kg,由武漢大學人民醫院實驗動物中心提供。家兔心衰模型采用主動脈返流加主動脈縮窄的方法制作。麻醉動物后將4F鞘管置入左側頸總動脈,經鞘管向心臟方向送入測壓導管,用力刺破主動脈瓣數次。如果主動脈脈搏壓升高至少50%則認為主動脈返流成功。兩周后開腹行腹主動脈縮窄術使腹主動脈直徑縮小大約50%,后關腹。兩個月后行超聲檢查,左心室收縮末期內徑超過1.20 cm,左心室射血分數低于40%者視為心衰模型制作成功。
1.2 實驗材料與儀器β3-AR激動劑BRL 37344,純度98%,購自Tocris公司;β3-AR抑制劑SR 59230A,純度99%,購自Tocris公司;美國GE公司Marquette MARS Holter 12通道Holter記錄儀;中國四川錦江電子科技有限公司LEAD2000多道電生理記錄儀;美國Abbott公司Baxter flo-gard 6301輸液泵。
1.3 動態心電圖監測室性心律失常發生率接受超聲檢查并確定左心射血分數(LVEF)<40%且左心室收縮末直徑(LVEDS)>1.4 cm的家兔納入實驗,麻醉后家兔仰臥位固定行Holter監測,因心衰動物基礎心率較快(平均>240次/min),為便于后期精確測量,將Holter記錄的速度根據情況相應調整為25 mm/s、50 mm/s、100 mm/s,振幅為5 mm/mV、10 mm/mV、20 mm/mV、40 mm/mV。待家兔清醒后開始同步Holter及心電圖監測,監測時間設定為6 h。
1.4 在體室性心律失常記錄觀察5 min無室性心律失常發生后給予5 ml 0.9%生理鹽水(慢推注,時間不短于5 min),之后觀察5 min直至心率恢復至基線水平,其后為藥物洗脫時間(10 min),隨后給予BRL 37344(1.5 μg·kg·-1h·-1)靜脈泵入(30 min);之后再次給予5 ml 0.9%生理鹽水,再度觀察5 min,藥物洗脫10 min后給予SR 59230A(0.5 mg/kg)靜脈推注依據室性心律失常的嚴重程度將所記錄到的心律失常分為三類:單個室早、成對室早及短陣室速。
1.5 心率變異性分析在上述持續記錄6 h動態心電圖,分別取其中10 min給藥時間中的5 min無干擾及心律失常的心電圖(ECG)進行時域與頻域分析。獲得平均正常RR間期的標準差(SDNN),及頻域參數包括低頻成分(LF)、高頻成分(HF)及低頻與高頻比值(LF/HF)。
1.6 心率震蕩分析選取其中10 min給藥時間中的5 min有單源性室性早搏的ECG進行震蕩初始(Turbulence Onset,TO)及震蕩斜率(Turbulence Slope,TS)兩個參數進行分析,入選室性早搏的標準參照文獻[4]。TO值計算公式為:TO=[(R-R1+R-R2)-(R-R-2+ R-R-1)]/(R-R-2+R-R-1);其中R-R1、R-R2分別代表室早后的第一、第二個竇性RR間期;R-R-1、R-R-2分別代表室早前第二、第一個竇性RR間期。TS的計算方法是以室早后20個竇性搏動的RR間期均值為縱坐標,以RR間期序號為橫坐標,來測定任意連續5個竇性心搏的最大斜率。繪制RR間期均值分布圖,再用任意連續5個RR間期均值計算并擬合出回歸曲線,其中正向的最大斜率為TS值。每例Holter資料數據測量轉換后應用EXCEL軟件計算TO及TS值。
2 結果
2.1 室性心律失常發生頻數比較給予β3-AR激動劑后心衰各類室性心律失常發生率及頻數明顯減少(P<0.05)。給予β3-AR抑制劑后各類室性心律失常發生率恢復至給藥水平,見表1。
表1 給藥前后室性心律失常發生情況比較(±s,次,n=24)
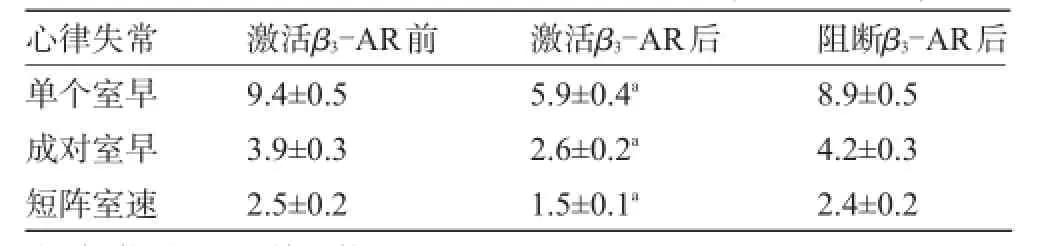
表1 給藥前后室性心律失常發生情況比較(±s,次,n=24)
注:與激活β3-AR前比較,aP<0.05。
心律失常激活β3-AR前激活β3-AR后阻斷β3-AR后單個室早成對室早短陣室速9.4±0.5 3.9±0.3 2.5±0.2 5.9±0.4a2.6±0.2a1.5±0.1a8.9±0.5 4.2±0.3 2.4±0.2
2.2 心率變異性分析給予β3-AR激動劑后心衰各組動物SDNN、LF、HF、LF/HF值均有所增加(P<0.05),給予抑制劑后各類指標恢復至給藥水平,見表2。
2.3 心率震蕩分析給予β3-AR激動劑后心衰TO值均有所降低,TS值顯著升高(P<0.05)。給予抑制劑后各類指標恢復至給藥水平,見表3。
表2 給藥前后心率變異性比較(±s,n=24)
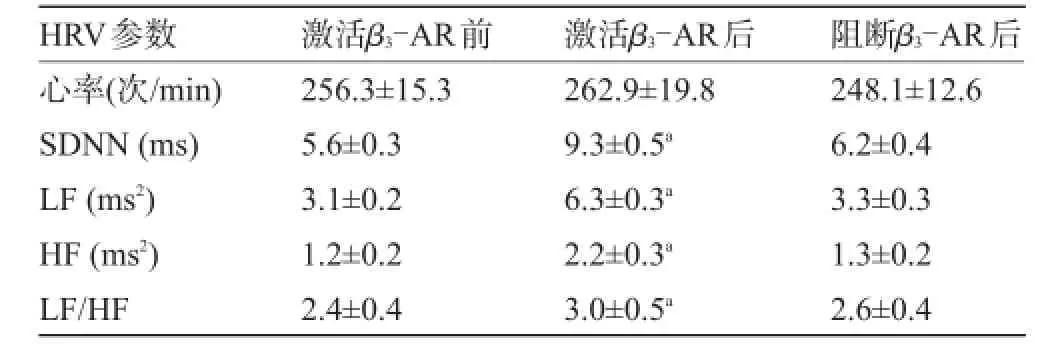
表2 給藥前后心率變異性比較(±s,n=24)
注:與激活β3-AR前比較,aP<0.05。
HRV參數心率(次/min) SDNN(ms) LF(ms2) HF(ms2) LF/HF激活β3-AR前256.3±15.3 5.6±0.3 3.1±0.2 1.2±0.2 2.4±0.4激活β3-AR后262.9±19.8 9.3±0.5a6.3±0.3a2.2±0.3a3.0±0.5a阻斷β3-AR后248.1±12.6 6.2±0.4 3.3±0.3 1.3±0.2 2.6±0.4
表3 給藥前后心率震蕩比較(±s)

表3 給藥前后心率震蕩比較(±s)
注:與激活β3-AR前比較,aP<0.05。
項目TO(%) TS(ms/RR)激活β3-AR前3.56±0.35 2.45±0.28激活β3-AR后-0.20±0.07a5.56±0.72a阻斷β3-AR后3.24±0.33 2.64±0.22
3 討論
心臟接受交感神經和副交感(迷走神經)的雙重支配,其中心室肌細胞對于交感活動特別是腎上腺素能受體的激動效應更為敏感。心力衰竭時,交感神經和迷走神經在局部呈現極度不平衡效應,表現為局部交感神經支配的高敏狀態,可引起心室肌不應期縮短和興奮性增強,易發生室性心律失常。
本研究發現給予心衰家兔β3-AR激動劑可以明顯降低其室性心律失常發生率。在先前的研究中,Zhou等[5]發現該受體的激活可以降低長期左側星狀神經節注射神經生長因子引起的室性心律失常發生率,結合本研究結果可猜測激活β3-AR可以部分抑制高交感活性狀態,并減少在心力衰竭發展或終末期由于過量兒茶酚胺類引起的心臟電活動異常,但其具體機制仍有待進一步研究。
本研究中發現激活β3-AR可以增加心衰家兔心率變異各值。先前的研究證明慢性心衰HRV值往往明顯較正常人低,提示在心衰時交感神經與迷走神經均受損的情況下,交感神經的張力高于迷走神經張力[6]。而自主神經與迷走神經與惡性心律失常的發生密切相關,二者相對平衡構成了自主神經抑制心律失常作用,心衰時心律震蕩現象則提示這種抑制效應已不復存在,預示著患者發生惡性心律失常的風險將會增加[7]。
本研究中還發現激活β3-AR可以增加心衰家兔心率震蕩TS值、降低TO值。大規模的臨床研究已證實,心率震蕩是心肌梗死后患者致死性室性心律失常的獨立預測指標[8]。與急性心肌梗死患者相同的是,慢性心衰患者也存在著交感系統的激活現象,因此其在一定程度上也可以評估心衰室性心律失常的發生風險[9]。慢性心衰患者心率震蕩的變化機制在于心臟自主神經功能的受損。心衰時神經內分泌體液因素,交感神經興奮性增高,同時迷走神經興奮性受降低,從而使心力衰竭患者心率震蕩現象減弱,使慢性心衰組TS值在較正常對照組明顯降低,TO值則明顯高于正常對照組[10]。
因此,我們將激活β3-AR后對上述預測指標的影響歸因為其直接或間接地降低了心臟交感活性,使迷走神經與交感神經之間的平衡重新建立。這一效應可能是直接神經體液調節,也可能是對于其他β-AR受體下游的信號表達通路的影響所致,這與本研究中對室性心律失常發生率的研究結果一致,提示其激活可以直接或間接作用調節心衰時心臟自主神經系統功能的恢復,從而抑制了室性心律失常的發生。
4 小結
心力衰竭相關的惡性室性心律失常仍是心衰患者心源性猝死的原因之一,關于其發生機制以及干預治療也是目前亟待解決的難題。本研究表明激活β3-AR可直接影響心臟自主神經功能,減少惡性室性心律失常的發生,說明局部神經遞質及其相關受體功能在心衰心律失常的發生中有其獨特的地位,可作為心衰心律失常治療的一個新靶點。
[1]Dzau VJ.Contributions of neuroendocrine and local autocrine-paracrine mechanisms to the pathophysiology and pharmacology of congestive heart failure[J].Am J Cardiol,1988,62(8):76-81.
[3]Packer M,Lee WH,Kessler PD,et al.Role of neurohormonal mechanisms in determining survival in patients with severe chronic heart failure[J].Circulation,1987,75(5 Pt 2):80-92.
[2]Bril A,Forest MC,Gout B.Ischemia and reperfusion-induced arrhythmias in rabbits with chronic heart failure[J].Am J Physiol, 1991,261(2 Pt 2):301-307.
[4]Watanabe MA,Marine JE,Sheldon R,et al.Effects of ventricular premature stimulus coupling interval on blood pressure and heart rate turbulence[J].Circulation,2002,106(3):325-330.
[5]Zhou S,Tan AY,Paz O,et al.Antiarrhythmic effects of beta3-adrenergic receptor stimulation in a canine model of ventricular tachycardia[J].Heart Rhythm.2008,5(2):289-297.
[6]Sandercock GR,Brodie DA.The role of heart rate variability in prognosis for different modes of death in chronic heart failure[J]. Pacing Clin Electrophysiol,2006,29(8):892-904.
[7]Guzzetti S,La Rovere MT,Pinna GD,et al.Different spectral components of 24 h heart rate variability are related to different modes of death in chronic heart failure[J].Eur Heart J,2005,26(4):357-362.
[8]Huikuri HV,Exner DV,Kavanagh KM,et al.Attenuated recovery of heart rate turbulence early after myocardial infarction identifies patients at high risk for fatal or near-fatal arrhythmic events[J].Heart Rhythm,2010,7(2):229-235.
[9]Flevari P,Georgiadou P,Leftheriotis D,et al.Heart rate turbulence after short runs of nonsustained ventricular tachycardia in chronic heart failure[J].Pacing Clin Electrophysiol,2007,30(6):787-795.
[10]Lin LY,Hwang JJ,Lai LP,et al.Restoration of heart rate turbulence by titrated beta-blocker therapy in patients with advanced congestive heart failure:positive correlation with enhanced vagal modulation of heart rate[J].J Cardiovasc Electrophysiol.2004,15 (7):752-756.
Effects of β3-AR activation on incidences of ventricular arrhythmia,heart rate variability and heart rate turbulence in rabbits with heart failure.
LI Hai-tao1,WU Ming1,MA Jian-lin1,LIN Jing1,ZHANG Jing-wen1, WANG Yu-dai1,HAN Li-juan2.Center of Cardiovascular Disease1,Medical Records Office2,People's Hospital of Hainan Province,Haikou 570311,Hainan,CHINA
ObjectiveTo investigate the effects of β3-adrenoceptor(β3-AR)activation on incidences of ventricular arrhythmia,heart rate variability and heart rate turbulence in rabbits with HF.Methodsβ3-AR agonists and inhibitors were administrated in 24 rabbits with heart failure(HF)induced by combination of artificial aortic insufficiency and aortic constriction.6 hours Holter monitoring was performed to evaluate incidences of ventricular arrhythmia,heart rate variability and heart rate turbulence.Resultsβ3-AR agonists significantly prevented incidences of ventricular arrhythmia(P<0.05),enhanced SDNN,LF,HF and LF/HF(P<0.05),and increased the TO and flatten TS(P<0.05).These effects were markedly antagonized when treated with specific β3-AR inhibitor(P<0.05).Conclusionβ3-AR activation may decrease prevalence of ventricular arrhythmia in HF through rebalance sympathetic tone.
β3-adrenoceptor;Ventricular arrhythmia;Heart rate variability;Heart rate turbulence;Heart failure
R-332
A
1003—6350(2014)16—2344—03
10.3969/j.issn.1003-6350.2014.16.0917
2014-03-25)

