馬來酸氯苯那敏原料藥細菌內毒素檢查方法的建立
王相忍
(河南省濮陽市食品藥品檢驗所,河南 濮陽 457000)
馬來酸氯苯那敏是抗組胺類藥,通過對H1受體的拮抗發揮抗過敏作用,收載于2010年版《中國藥典(二部)》,其注射劑采用細菌內毒素檢查法控制質量,但原料藥尚未將細菌內毒素檢查或熱原檢查項目列入標準中。為了加強藥品質量控制,筆者對馬來酸氯苯那敏原料藥細菌內毒素檢查法的可行性進行了研究。現報道如下。
1 儀器與試藥
TAL-40D型試管恒溫儀(湛江安度斯生物有限公司);ZH-2型自動漩渦混合器(天津藥典標準儀器廠);CPA225D型電子天平(德國賽多利斯公司)。馬來酸氯苯那敏(河南九勢制藥股份有限公司,批號為120910,121012,121118;上海新華聯制藥有限公司,批號為120802,121101,規格均為原料藥);鱟試劑(湛江安度斯生物有限公司,批號為1210081,規格為每支0.1 mL,靈敏度為0.25 EU/mL;湛江博康海洋生物有限公司,批號為 1201122,規格為每支 0.1 mL,靈敏度為 0.25 EU/mL);細菌內毒素工作標準品(中國藥品生物制品檢定所,批號為150601-201175,效價為120 EU/支);細菌內毒素檢查用水(簡稱BET用水,湛江安度斯生物有限公司,批號為1205300,規格為每支50 mL)。
2 方法與結果
2.1 鱟試劑標示靈敏度( )的復核[1]
照2010年版《中國藥典(二部)》細菌內毒素檢查法規定進行鱟試劑靈敏度復核試驗。結果2批鱟試劑靈敏度測試值 (λc)均在 0.5 λ ~ 2.0 λ,表明鱟試劑靈敏度符合規定,可用于試驗。
2.2 樣品內毒素限值(L)的確定[1]
照2010年版《中國藥典(二部)》相關方法,根據公式 L=K/M 計算,K為每人每千克體重每小時最大可接受的內毒素劑量,注射劑 K=5 EU/(kg·h),M為每人每千克體重每小時的最大供試品劑量。本品為原料藥,參照該藥品制劑馬來酸氯苯那敏注射液說明書及《臨床用藥須知》,最大使用劑量為20mg/h,成人體重按60 kg、滴注時間按 1 h 計算,則 M =20/60 =0.333mg(kg·h),則L=5/0.333=15.0 EU/mg,高于馬來酸氯苯那敏注射液細菌內毒素限制5.0 EU/mg。根據同品種的原料藥與不同制劑間的細菌內毒素限值一致性原則,為保證安全用藥,將本品安全系數(f)定為 3,則 L=15/3=5.0 EU/mg。因此馬來酸氯苯那敏原料藥的 L確定為 5.0 EU/mg。
2.3 樣品預干擾試驗
由于干擾試驗是在供試品存在的情況下驗證內毒素與鱟試劑的反應是否正常,與所使用鱟試劑的靈敏度無關,因此在干擾試驗中原則上可使用任意靈敏度的鱟試劑,建議使用較低靈敏度(如0.5 EU/mL或 0.25 EU/mL)的鱟試劑,可盡量避免供試品所含內毒素對干擾試驗造成的陽性影響[2]。本試驗將 λ為0.25 EU/mL的鱟試劑作為最高靈敏度,本品為原料藥,樣品最大有效稀釋倍數(MVD)取 1,L=5.0 EU/mg,根據公式 C = λ /L計算出供試品的最低有效稀釋質量濃度為0.05 g/L。精密稱取供試品64mg,精密加 BET用水,制成質量濃度為6.4 g/L的溶液,再用 BET用水稀釋成含馬來酸氯苯那敏 3.2,1.6,0.8,0.4,0.2,0.1,0.05 g/L 的溶液,記為 NPC;另制備同一系列質量濃度并含有 2 λ(0.5 EU/mL)細菌內毒素的樣品陽性溶液,記為 PPC;用 λ:0.25 EU/mL的2個廠家的鱟試劑,分別與上述NPC和PPC系列溶液進行反應,每1個質量濃度重復2管,并設陰性對照(NC)和陽性對照(PC)各2管。結果見表1。可見,當樣品稀釋至0.8 g/L質量濃度時對2個廠家鱟試劑均不存在干擾作用。
2.4 供試品正式干擾試驗
根據干擾預試驗結果,取2個廠家的樣品,以BET用水稀釋成最終質量濃度為0.8 g/L的溶液。以該溶液和BET用水分別將內毒素工作標準品稀釋成 0.5 EU/mL(2 λ),0.25 EU/mL(1 λ),0.125 EU/mL(0.5 λ),0.062 5 EU/mL(0.25 λ)的系列溶液,然后分別用 λ為0.25 EU/mL的2個廠家鱟試劑,按2010年版《中國藥典(二部)》細菌內毒素檢查法項下規定進行正式干擾試驗。結果見表2。內毒素標準品水溶液反應終點濃度的幾何平均值(Es)為 0.5 ~ 2.0 λ(包括 0.5 λ 和 2.0 λ),內毒素供試品溶液反應終點濃度的幾何平均值(Et)為 0.5 ~2.0 Es(包括 0.5 Es和2.0 Es), Es均在 0.5 λ ~ 2.0 λ 之間, Et均在 0.5 Es~ 2.0 Es范圍內。結果表明,在此試驗條件下,樣品對鱟試劑與細菌內素素的反應無干擾。

表2 干擾試驗結果
2.5 樣品細菌內毒素檢查
取5批樣品,用BET用水分別溶解稀釋制成質量濃度為0.8g/L的溶液,用 λ為0.25 EU/mL的2個廠家的不同鱟試劑,以 L為5.0 EU/mg作為評定標準,按細菌內毒素檢查法進行操作和結果判斷。結果見表3,表明5批樣品經不同廠家的鱟試劑檢驗,均符合規定。
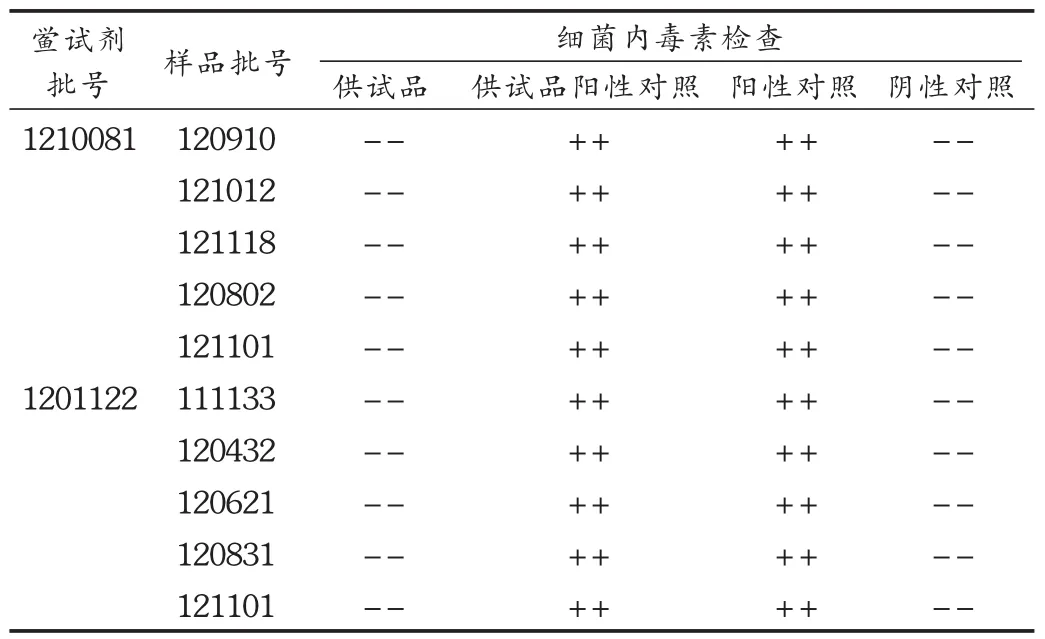
表3 樣品細菌內毒素檢查結果
3 討論
為提高藥品質量標準,更有效地控制藥品質量,依據2010年版《中國藥典(二部)》凡例二十二條“同一原料藥用于不同制劑時,需根據臨床用藥要求制訂相應的質量控制項目”的要求,制訂該原料藥的安全性檢查項目非常必要。將馬來酸氯苯那敏原料藥細菌內毒素限值定為5.0 EU/mg,與其注射劑限值相同,能保障臨床用藥安全。
采用2批不同廠家的鱟試劑對3批樣品進行干擾試驗,以及用不同廠家的鱟試劑對5批樣品進行方法學驗證試驗,結果表明,當樣品稀釋至0.8 g/L質量濃度時對鱟試劑與細菌內毒素的反應無干擾作用,方法學驗證結果也符合細菌內毒素檢查法有效性的規定。因此,馬來酸氯苯那敏原料藥采用內毒素檢查法(凝膠法)是可行的,建議注射劑生產廠家可用此方法控制采購原料藥質量。
參考文獻:
[1] 國家藥典委員會.中華人民共和國藥典(二部)[M].北京:中國醫藥科技出版社,2010:附錄88-附錄91.
[2] 中國藥品生物制品檢定所.中國藥品檢驗標準操作規范[M].北京:中國醫藥科技出版社,2010:322.

