魚油對母鼠及新生大鼠海馬組織NR1、c-fos、CREB基因表達的影響
岳 崟,余詩婷,張繼文,孫宗毅,王麗梅,2 *,劉烈炬
(1.武漢輕工大學 生物與制藥工程學院,湖北 武漢 430023;2.農產品加工湖北省協同創新中心,湖北 武漢 430023)
魚油富含二十二碳六烯酸(docosahexaenoicacid,DHA)和二十碳五烯酸(eicosapentenoic acid,EPA),它們屬于ω-3系列的長鏈多不飽和脂肪酸,在人體內轉化效率較低,需要從食物中攝取,屬于必需脂肪酸。尤其是DHA,它是大腦中重要的脂肪酸,占大腦灰質脂肪酸總量的12%~16%[1],有研究顯示,它在維持視網膜以及中樞神經系統的正常結構和功能方面發揮了重要的作用[2]。EPA能夠幫助降低血液中膽固醇和甘油三酯的含量,具有預防心腦血管疾病的作用。EPA對大腦認知功能也有影響,近來有研究顯示,飲食中攝入充足的EPA,可以增加青壯年大腦的認知功能[3]。有研究表明,飲食中添加一定劑量的魚油能夠改善阿爾茨海默病病人的癥狀,減緩認知功能的下降,增強大腦學習記憶功能[4]。還有研究顯示,孕期乳牛飲食添加一定量的魚油能夠提高牛乳中DHA和EPA的含量[5]。
目前,DHA和EPA可用于食品添加劑,尤其在歐洲和日本,已被用于嬰幼兒配方奶粉和雞蛋中[6],其應用前景廣闊,并且全球對嬰幼兒及孕期婦女的營養也愈加關注。目前,已經有大量研究顯示,孕期適當補充DHA能提高早產兒神經系統的發育[7],有利于神經組織的生長發育,提高嬰幼兒大腦認知功能[8];但是也有研究顯示,孕期補充DHA,不能提高幼兒的神經系統發育[9]、認知功能和語言能力[10]。還有研究發現,孕期補充魚油能夠增強嬰幼兒的大腦認知功能,預防發育期兒童過敏癥的發生[11]。該研究以與學習記憶密切相關的N-甲基-D-天冬氨酸受體亞基1(N-methyl-D-aspartate receptor 1,NR1)、即刻早期基因中的c-fos、環磷酸腺苷(cyclic adenosine monophosphate,cAMP)反應元件結合蛋白(cAMP responsive element binding protein,CREB)基因為切入點,觀察最適劑量的魚油對孕期母鼠以及新生大鼠海馬組織中三個基因mRNA表達量的影響,探究魚油影響認知功能的可能機制,這不僅驗證了魚油對孕鼠及新生大鼠認知能力的影響,也為進一步研究魚油影響大腦認知功能的機制提供參考。
1 材料與方法
1.1 材料與試劑
清潔級、成年sprague-dawley大鼠32只,體質量(250±50)g:華中科技大學同濟醫學院實驗動物學部提供(動物許可證號SCXK2010-0009)。
魚油(純品):湖北福星生物科技有限公司出品;羧甲基纖維素鈉:連云港友進食品添加劑技術開發有限公司;總RNA提取試劑盒(TRIzolRReagent):Invitrogen公司;一步法反轉錄PCR試劑盒(All-in-OneTM first-strand cDNA synthesis kit)、實時熒光定量PCR試劑盒(All-in-OneTMqPCR mix):GeneCopoeiaTM公司;NR1、c-fos和CREB引物:Invitrogen公司設計合成;三氯甲烷、異丙醇、無水乙醇等試劑均為國產分析純。
1.2 儀器與設備
DY89-Ⅰ型電動玻璃勻漿機:寧波新芝科器研究所;3K15型號高速冷凍離心機:德國Sigma公司;WH-1微型旋渦混合儀:上海滬西分析儀器廠有限公司;752型紫外可見分光光度計:上海光譜儀器有限公司;TCRADIENT梯度PCR儀:德國Biometra公司;ABI7500PCR儀:美國ABI公司。
1.3 方法
1.3.1 動物分組與喂養
64只成年SD大鼠,于標準動物房飼養7 d,以適應環境。然后使用隨機數字表法將其分為4組:陰性對照組、魚油低劑量組、魚油中劑量組和魚油高劑量組。每組8只雌鼠,8只雄鼠,分8籠喂養,每籠一雌一雄,每籠大鼠自由飲食進水(飼喂棒狀飼料)。每日清晨檢查雌鼠是否存在陰道栓,若有則記為懷孕,將成功受孕的雌鼠分籠飼喂,每日定時定量灌胃給魚油(只有受孕的雌鼠灌胃),連續灌胃60 d。魚油劑量參照學者PAN J P等[12-13]的研究,確定其灌胃劑量依大鼠體質量確定,為低劑量150 mg/(kg·d)組、中劑量300 mg/(kg·d)組、高劑量600 mg/(kg·d)組,(每5 d稱質量1次,調整劑量),陰性對照組灌胃相應劑量0.5%羧甲基纖維素鈉溶液,每組8只母鼠,連續飼養,檢測其海馬組織NR1、c-fos、CREBmRNA的表達。在灌胃60 d期間,雌鼠也完成生產,新生的大鼠不用灌胃魚油。將每組孕鼠所產大鼠按照它們對應的母鼠分組(陰性對照組的孕鼠所產大鼠為新生大鼠的陰性對照組,低劑量組孕鼠所產大鼠為新生乳鼠的魚油低劑量組,中劑量組孕鼠所產大鼠為新生乳鼠的魚油中劑量組,高劑量組孕鼠所產大鼠為新生乳鼠的魚油高劑量組),每組隨機選擇8只新生乳鼠,檢測其海馬組織NR1、c-fos、CREBmRNA的表達。
1.3.2 實時熒光定量檢測母鼠及新生大鼠海馬組織NR1、c-fos、CREBmRNA的表達
實驗結束后的雌鼠,用20%烏拉坦(現配)麻醉,斷頭處死,新生乳鼠直接用剪刀斷頭處死,取雌鼠與新生乳鼠的頭部于冰盤上,迅速剝離海馬組織,并迅速分裝于相應EP管中,加入1 ml TRIzolR試劑,淹沒海馬組織,并編號存放于液氮中,備用。按照TRIzolRReagent試劑盒說明書,提取大鼠海馬組織中總RNA。之后按照First-Strand cDNA Synthesis Kit試劑盒方法,反轉錄提取的海馬組織總RNA,合成cDNA。最后按qPCR Mix試劑盒進行實時熒光定量聚合酶鏈反應(polymerase chain reaction,PCR)的檢測,采用三步法檢測目的基因mRNA的相對表達,基因的引物設計見表1,其中甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)為內參基因,它屬于看家基因,在幾乎所有組織中均高效表達,在同類細胞或組織中的蛋白表達量幾乎是恒定的,并且它的蛋白表達量不受某些識別位點、誘導物的影響,因此常被用實時定量PCR實驗、western-bolt實驗的標準內參。實時定量PCR擴增程序:95 ℃預變性10 min;95 ℃變性10 s,58 ℃退火20 s,72 ℃延伸30 s,于此處收集熒光,40次循環;最后16 ℃保溫30 min。

表1 基因引物序列,退火溫度和產物長度Table 1 Gene primers,annealing temperature and product lengths
1.3.3 統計學分析
實驗結果以“±s”表示,SPSS 19.0統計軟件分析,并使用prism 6.0.1軟件繪圖,多組間比較采用ANOVA統計學方法分析,組間比較采用T檢驗,并且認為P<0.05為差異顯著,具有統計學意義,P<0.01為差異極顯著。
2 結果與分析
2.1 魚油對母鼠海馬組織NR1、CREB、c-fos mRNA表達量的影響
低劑量、中劑量和高劑量魚油對母鼠海馬組織NR1、CREB、c-fos基因mRNA表達量的Real-Time PCR結果見表2,表2顯示的結果為NR1、CREB、c-fos基因的相對表達量,設置陰性對照組的目的基因表達量為1±0。由表2可以看出,灌胃低劑量、中劑量、高劑量魚油的母鼠大腦海馬組織中NR1、CREB、c-fos三個基因均有不同程度的表達。與陰性對照組相比,魚油低劑量組和魚油中劑量組母鼠海馬組織中NR1、CREB、c-fos基因mRNA的相對表達量均顯著增高(P<0.05),魚油高劑量組的大鼠海馬NR1、CREB、c-fos基因mRNA的相對表達量未見明顯差異;不同劑量的魚油對母鼠NR1、CREB、c-fos基因mRNA的表達量影響不同,中劑量的魚油對母鼠海馬NR1、CREB、c-fos基因的影響最大,低劑量的魚油次之。表2還顯示,魚油對不同基因的相對表達量影響不同,三個劑量組中CREB的相對表達量最高,其次是c-fos基因、NR1基因。說明攝入適當劑量的魚油能夠增加母鼠海馬組織中與學習記憶密切相關的NR1、CREB、c-fos基因的表達,并且魚油對CREB基因的影響最大。
表2 不同劑量魚油對母鼠海馬NR1、CREB、c-fos 基因mRNA表達的影響(±s,n=6)Table 2 Effect of different fish oil dosage on mRNA expression ofc-fos,CREB andNR1 in female rats’hippocampus (±s,n=6)
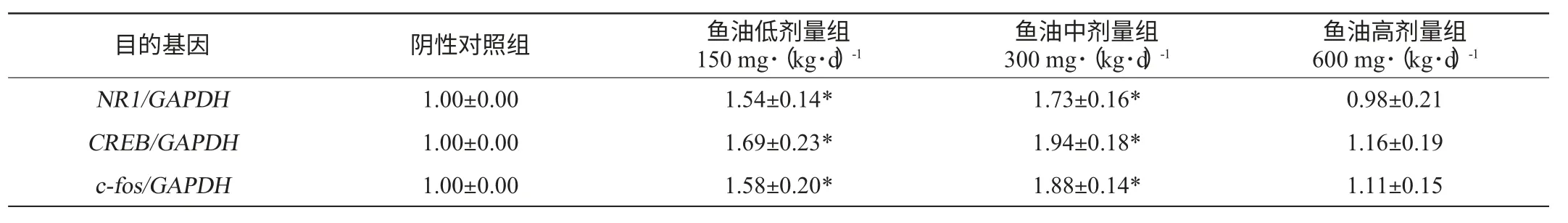
表2 不同劑量魚油對母鼠海馬NR1、CREB、c-fos 基因mRNA表達的影響(±s,n=6)Table 2 Effect of different fish oil dosage on mRNA expression ofc-fos,CREB andNR1 in female rats’hippocampus (±s,n=6)
注:“*”表示與陰性對照組比較,基因的相對表達量有顯著性差異(P<0.05)。
2.2 魚油對新生乳鼠海馬組織NR1、CREB、c-fos mRNA表達量的影響
低劑量、中劑量和高劑量的魚油對新生乳鼠海馬組織中NR1、CREB、c-fos基因mRNA表達量的影響見表3,表3中顯示的是目的基因的相對表達量,設置陰性對照組為1±0。由表3可知,三個劑量的魚油組中新生乳鼠海馬組織NR1、CREB、c-fos基因均有不同程度的表達。表3還顯示,與陰性對照組相比,魚油低劑量組和魚油高劑量組新生乳鼠海馬組織中NR1、CREB、c-fosmRNA的相對表達量均明顯增高(P<0.05),魚油高劑量組的新生乳鼠海馬NR1、CREB、c-fos基因mRNA 的相對表達量未見明顯差異;不同劑量的魚油對新生乳鼠NR1、CREB、c-fos基因mRNA的表達量影響不同,中劑量的魚油對新生乳鼠海馬NR1、CREB、c-fos基因的影響最大,低劑量的魚油次之。表3還顯示,魚油對新生乳鼠不同基因的相對表達量影響不同,三個劑量組中,c-fos的相對表達量最高,其次是CREB基因,最后是NR1基因。說明孕期以及哺乳期攝入適當劑量的魚油能夠顯著增加新生大鼠海馬組織中與學習記憶相關的NR1、CREB、c-fos基因的表達,并且魚油對CREB基因的影響最為顯著。
表3 不同劑量魚油對新生乳鼠海馬NR1、CREB、c-fos 基因mRNA表達的影響(±s,n=6)Table 3 Effect of different fish oil dosage on mRNA expression ofc-fos,CREB andNR1 in newborn rats' hippocampus (±s,n=6)
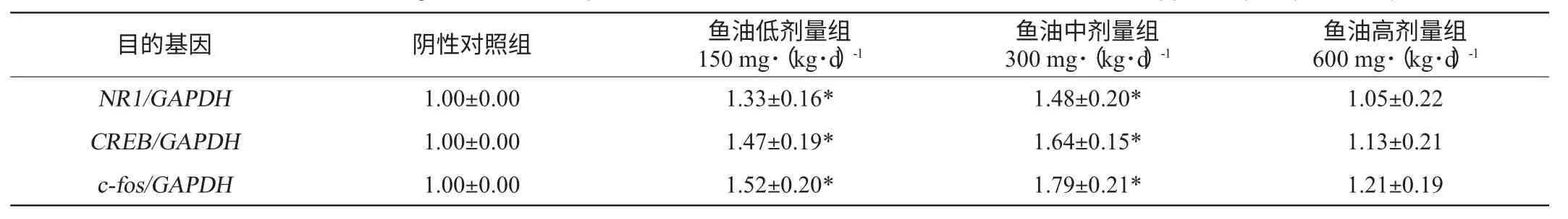
表3 不同劑量魚油對新生乳鼠海馬NR1、CREB、c-fos 基因mRNA表達的影響(±s,n=6)Table 3 Effect of different fish oil dosage on mRNA expression ofc-fos,CREB andNR1 in newborn rats' hippocampus (±s,n=6)
注:“*”表示與陰性對照組比較,基因的相對表達量有顯著性差異(P<0.05)。
長時程增強(long-term potentiation,LTP)一直被公認為是學習記憶的分子學基礎、神經系統突觸可塑性的物質基礎,其與學習記憶活動的關系極為密切,大量的實驗[14-15]顯示學習記憶活動的變化伴隨著LTP的變化。LTP的產生包括LTP的形成與LTP的維持兩個階段,其過程極為復雜,其中涉及多個基因、蛋白以及信號通路。NR1是N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受體的亞單位,也是構成NMDA受體復合物的關鍵亞基,與學習記憶活動關系密切。NR1參與了NMDA受體依賴型的LTP的形成,因此NR1與LTP的生成關系密切。有研究發現,大鼠在經歷空間學習訓練后,其NR1的蛋白表達量明顯增高,并且NR1的蛋白表達量與學習記憶成正相關[16]。環磷腺苷效應元件結合蛋白是環腺苷酸應答無件結合蛋白,它存在于真核生物的細胞核內,是一種轉錄增強子,可以增強特定基因的轉錄。CREB也是很多神經活動的調節因子,在大腦的生長發育、機體的晝夜節律以及LTP的產生中都發揮了重要的作用。有研究發現,CREB能夠通過調節大鼠脊柱內側杏仁核內的神經元樹突棘密度來影響記憶的形成[17]。還有研究顯示[18],阻斷CREB的糖基化修飾可以改變細胞的功能和行為的可塑性,能夠增強軸突與樹突的生長,促進長時程記憶的形成。即刻早期基因c-fos是一類原癌基因,它的主要功能是通過編碼c-fos蛋白實現的。c-fos與學習記憶以及LTP的生成有關,有研究[19]發現,c-fos的基因表達與c-fos蛋白表達與LTP存在相關性,當LTP增強的時候,伴隨著c-fos基因mRNA表達量的增加、c-Fos蛋白表達量的增加。
實驗還顯示,新生乳鼠海馬組織中NR1、CREB、c-fos基因mRNA的相對表達量也顯著增加了,但新生乳鼠并未直接飼喂魚油,結合VAFA T S[5]等的研究結論,推測新生乳鼠海馬中基因表達增加的原因,可能是母鼠在孕期攝入足夠量的魚油,增加了乳汁中DHA與EPA的含量,乳汁中的DHA與EPA誘導了新生乳鼠海馬中基因的表達。進一步驗證其可能的原因有待進一步研究討論。
3 結論
從實時定量PCR的實驗結果可以看出,孕期和哺乳期補充適當劑量的魚油,能夠提高母鼠與新生乳鼠海馬組織中NR1、CREB、c-fos的相對表達量,高劑量的魚油對母鼠和新生乳鼠海馬NR1、CREB、c-fos基因mRNA的表達量無明顯影響。由NR1、CREB和c-fos與LTP以及學習記憶的關系,推測孕期適當補充魚油,能夠調節其海馬組織中NR1、CREB和c-fos的表達,從而影響LTP的生成,最終提高母鼠以及新生乳鼠的學習記憶功能。然而,學習記憶是個十分復雜的過程,涉及多個信號通路、多種生化反應,魚油是如何發揮作用,怎樣提高大鼠的學習記憶功能的,它是如何發生的,具體過程是怎樣的,有待進一步研究討論。
[1]JULIEN C,BERTHIAUME L,HADJ-TAHAR A,et al.Postmortem brain fatty acid profile of levodopa-treated Parkinson disease patients and parkinsonian monkeys[J].Neurochem Int,2006,48(5):404-414.
[2]CAO D,KAVALA K,KIM J.Docosahexaenoic acid promotes hippocampal neuronal development and synaptic function[J].J Neurochem,2009,111(2):510-521.
[3]BAUER I,HUGHES M,ROWSELL R,et al.Omega-3 supplementation improves cognition and modifies brain activation in young adults[J].Hum Psychopharm Clin,2014,29(2):133-144.
[4]DAIELLO L A,GONGVATANA A,DUNSIGER S,et al.Association of fish oil supplement use with preservation of brain volume and cognitive function[J].Alzheimers Dement,2014,in press.
[5]VAFA T S,NASERIAN A A,HERAVI-MOUSSAVI A R,et al.Effect of supplementation of fish and canola oil in the diet on milk fatty acid composition in earlylactating holstein cows[J].Asian-Austral J Anim,2012,25(3):311-319.
[6]GOMEZ-PINILLA F.Brain foods:the effects of nutrients on brain function[J].Nat Rev Neurosci,2008,9(7):568-578.
[7]MAKRIDES M.DHA supplementation during the perinatal period and neurodevelopment:Do some babies benefit more than others? [J].Prostag Leukotr Ess,2013,88(1):87-90.
[8]HENRIKSEN C,HAUGHOLT K,LINDGREN M,et al.Improved cognitive development among preterm infants attributable to early supplementation of human milk with docosahexaenoic acid and arachidonic acid[J].Pediatrics,2008,121(6):1137-1145.
[9]VAN GOOR S A,DIJCK-BROUWER D A,ERWICH J J,et al.The influence of supplemental docosahexaenoic and arachidonic acids during pregnancy and lactation on neurodevelopment at eighteen months[J].Prostag Leukotr Ess,2011,84(5):139-146.
[10]MAKRIDES M,GIBSON R A,MCPHEE A J,et al.Effect of DHA supplementation during pregnancy on maternal depression and neurodevelopment of young children[J].JAMA-J Am Med Assoc,2010,304(15):1675-1683.
[11]LEE Q U,PALMER D J,SULLIVAN T,et al.Fish oil supplementation in pregnancy and childhood allergies[J].Allergy,2014,69(3):411-412.
[12]PAN J P,ZHANG H Q,GUO Y F,et al.Some subtypes of endocannabinoid/endovanilloid receptors mediate docosahexaenoic acid-induced enhanced spatial memory in rats[J].Brain Res,2011,1412(15):18-27.
[13]GUESNET P,AlESSANDRI J M.Docosahexaenoic acid(DHA)and the developing central nervous system(CNS)-implications for dietary recommendations[J].Biochimie,2011,93(1):7-12.
[14]LISMAN J,YASUDA R,RAGHAVACHARI S,et al.Mechanisms of CaMKII action in long-term potentiation[J].Nat Rev Neurosci,2012,13(3):169-182.
[15]SALE A,DE PASQUAlE R,BONACCORSI J,et al.Visual perceptual learning induces long-term potentiation in the visual cortex[J].Neuroscience,2011,172(13):219-225.
[16]WEI S,EDUAR DO M,PING W,et al.Changes in NMDA receptor expression in auditory cortex after learning[J].Neurosci Lett,2005,374(1):63-68.
[17]SARGIN D,MERCALDO V,YIU A P,et al.CREBregulates spine density of lateral amygdala neurons:implications for memory allocation[J].Front Behav Neurosci,2013,7:209-219.
[18]REXACH J E,CLARK P M,MASON D E,et al.Dynamic O-GlcNAc modification regulatesCREB-mediated gene expression and memory formation[J].Nat Chem Biol,2012,8(3):253-261.
[19]KEMP A,TISCHMEYER W,MANAHAN-VAUGHAN D.Learning-facilitated long-term depression requires activation of the immediate early gene,c-fos,and is transcription dependent[J].Behav Brain Res,2013,254:83-91.

