精子發生過程中組蛋白翻譯后修飾及其作用
葛少欽趙崢輝殷會瑩張慧敏綜述 黃 錦審校
1. 河北大學醫學部(保定 071000); 2. 北京大學第三醫院; 3. 河北大學生殖醫學研究所
·綜 述·
精子發生過程中組蛋白翻譯后修飾及其作用
葛少欽1,3趙崢輝1殷會瑩1張慧敏1綜述 黃 錦2*審校
1. 河北大學醫學部(保定 071000); 2. 北京大學第三醫院; 3. 河北大學生殖醫學研究所
一、精子發生過程中組蛋白甲基化
精子發生過程中組蛋白甲基化是指發生在組蛋白H3或H4N端精氨酸或者賴氨酸殘基上的甲基化,其甲基化水平受組蛋白甲基轉移酶(Histone methyltransferase, HMT)和組蛋白去甲基化酶(Histone demethylase,HDM)調節。組蛋白甲基化的功能主要體現在異染色質形成,基因轉錄調節以及其與DNA甲基化相互作用維持特定的染色質結構等方面。不同位點不同數量的甲基化相互組合,為組蛋白甲基化在精子發生過程中發揮作用提供了巨大潛能。
(一)組蛋白甲基化與DNA甲基化

圖1 DNA甲基化與組蛋白甲基化作用機制[6]
147 bp的DNA圍繞著組蛋白八聚體形成核小體,組蛋白與DNA之間緊密結合,其表觀遺傳修飾之間可互相作用。其中,組蛋白甲基化與DNA甲基化相互作用,通過建立特定的染色質結構來調節基因表達和細胞分化等過程。Tamaru等[4]通過對粗糙脈孢菌DNA甲基化的研究發現DNA甲基化完全依賴由組蛋白甲基化酶介導的組蛋白H3K9的甲基化,Dnmt3a/b通過異染色質蛋白1(Heterochromatin protein 1,HP1)被三甲基化的H3K9募集,進而調節DNA甲基化[5,6](圖1)。Spies等[7-10]研究發現基因本體中DNA甲基化與組蛋白H3K36有關,H3K36在基因本體的外顯子中較豐富,其具有富集DNA甲基化的功能,H3K36甲基化與DNA甲基化協同作用調節剪接機制[11];反之,DNA甲基化也調節組蛋白甲基化。異染色質中,Dnmt3a/b通過ADD domain與Suv39h1和Setdb1作用,調節組蛋白H3K9的甲基化[12,13]。常染色質中,Dnmt3a通過染色質蛋白MPP8與組蛋白H3K9甲基轉移酶G9a/GLP作用調節其甲基化水平[14]。基因本體中,Dnmt3a/b通過與H3K36me3有親和力的PWWP domain調節H3K36甲基化[15]。因此組蛋白甲基化與DNA甲基化通過正反調節來維持平衡和協調有功能的染色質[16]。
(二)組蛋白甲基化與基因轉錄調控
組蛋白H3或H4賴氨酸殘基甲基化是基因轉錄調節的一個關鍵因素,不同位點的組蛋白甲基化對基因轉錄的調節不同。精子發生過程中H3K4、H3K9和H3K27的單甲基化、二甲基化和三甲基化修飾表現為嚴密調控下的暫時性表達,對調節精子內DNA轉錄狀態極其重要[17-19]。H3K4甲基化主要分布在常染色質區轉錄活化基因的啟動子區,其通過促進臨近H3K4甲基化以及H3K9去甲基化促進基因轉錄[3,20];H3K9甲基化通過抑制RNA聚合酶Ⅱ與染色質結合,導致基因轉錄抑制[3];H3K27甲基化主要存在于具有Polycomb response elements(PREs)的常染色質區, 中心粒異染色質區以及失活的X染色體上,其通過阻止RNA聚合酶的前進,導致轉錄抑制[3]。精子中H3K4甲基化水平較低,而H3K9和H3K27的甲基化水平則比較高,這或許是為了確保基因的沉默[21,22]。
二、精子發生過程中組蛋白磷酸化
組蛋白磷酸化指通過蛋白質磷酸激酶將ATP的磷酸基轉移到組蛋白特定氨基酸上的過程,其與染色體的折疊、壓縮和分離、基因轉錄調控以及DNA損傷修復等多種機制有關[23]。組蛋白H1、H2A、H2B、H3、H4均可發生不同程度的磷酸化,在精子發生的各個階段發揮著重要作用。其中,H1、H2A和H2B磷酸化在DNA損傷修復以及基因轉錄調控過程中作用明顯。
(一)H2AX磷酸化與DNA損傷修復
H2AX第139位絲氨酸的磷酸化(γ-H2AX)是DNA雙鏈斷裂(Double stranded breaks, DSBs)的早期指標,在精子發生過程中呈現不同的水平[24]。Rogakou等[25]在對CD-1小鼠細長型精子胞核DSBs位點研究時檢測到了γ-H2AX的存在,Schwaba等[24]通過對雄性小鼠精子中PTIP蛋白的研究發現γ-H2AX與DNA損傷修復蛋白Rad51共同定位于DSBs部位,還有學者通過設計免疫缺陷、對放射敏感的小鼠模型(H2AX-/-mice),發現這種小鼠DNA損傷修復不完善,這些都是γ-H2AX促進胞核DSBs修復的證據[2]。此外,Elgin等[26]研究發現H4高乙酰化誘發實驗可以阻止精子發生過程中DSBs,表明γ-H2AX與H4高乙酰化在DSBs損傷修復過程中具有協同作用。精子發生中任何涉及DSBs修復調控異常的因素不僅可以導致精子功能異常而且可能具有遺傳性,可見γ-H2AX在調控動物生殖,甚至人類健康與生殖方面都具有非常重要的地位[27]。
從表2可以看出,樹脂脫附液經Fenton氧化+Ca(OH)2預處理后,TOC和UV254均得到很好的去除,TOC去除率在53%左右,UV254去除率在44%左右。納濾膜能截留廢水中大部分的有機物,預處理后的樹脂脫附液納濾滲透液對TOC和UV254的去除率分別為97.64%、97.06%,效果均優于未預處理的樹脂脫附液納濾滲透液(TOC和UV254的去除率分別為96.08%、93.00%)。
(二)組蛋白磷酸化與基因轉錄調控
精子發生過程中組蛋白磷酸化與基因轉錄的激活與抑制息息相關。組蛋白磷酸化使攜帶負電荷的磷酸基團與攜帶正電荷的組蛋白結合,導致組蛋白與DNA之間的親和力下降,染色質結構改變,暴露出與蛋白質作用因子結合的表面,通過與特異的蛋白質復合物相互作用,調節基因轉錄水平[28]。Talasz等[29]在Hela細胞的免疫熒光實驗中觀察到組蛋白H1亞型H1.5、H1.2磷酸化的第172位絲氨酸(Serine 172、S172)出現在有絲分裂期染色質激活轉錄的區域,而H1.5 N末端磷酸化的S17則出現在抑制轉錄的染色質區域,Lu等[30]在小鼠精子發生的不同階段檢測到了睪丸特異組蛋白TH2B的第116位蘇氨酸的磷酸化,由于其在胞核的獨特的區域性分布,提示其可能參與調控特殊染色質區域的基因轉錄[31]。此外,精子發生過程中組蛋白H2A家族中的H2AX磷酸化與ATR和BRCA1一起引發減數分裂期性染色體鈍化(meiotic sex chromosome inactivation, MSCI),但是要維持整個粗線期階段的MSCI,還需要一些包括定位于X/Y小體上H2A泛素化在內的其他表觀遺傳修飾協同作用[32]。因此,對精子發生過程中組蛋白磷酸化調控基因轉錄進行研究有助于理解組蛋白磷酸化的功能作用。
三、精子發生過程中組蛋白乙酰化
精子組蛋白乙酰化是指發生在組蛋白H3和H4 N端比較保守的賴氨酸殘基上的乙酰化,其乙酰化水平由組蛋白乙酰轉移酶(Histone acetyltransferase, HAT)和組蛋白去乙酰化酶(Histone deacetylase, HDAC)共同調節。組蛋白乙酰化會使染色質松弛,有利于精子發生過程中精蛋白并入DNA和基因轉錄。在延伸期的精細胞中,主要以H3和H4乙酰化為主,也可能出現H2A和H2B乙酰化[33]。
(一)組蛋白乙酰化與精蛋白并入DNA
以核小體為基礎的染色質結構轉變為以精蛋白為基礎的染色質結構是人類精子形成的一大特征,這些蛋白質并入DNA的過程被緊密調節,最終形成P1:P2的比例約為1:1[33,34]。首先,標準組蛋白普遍被睪丸特異組蛋白變體替代,使核小體形成一個比較寬松的結構;然后,全基因組范圍內的組蛋白開始高度乙酰化,其中組蛋白尾部乙酰化為募集Brdt提供了平臺,而組蛋白折疊區域的乙酰化則是為了使乙酰基與組蛋白H4上的賴氨酸殘基結合,中和賴氨酸所帶正電荷,進一步使核小體解聚,易于與轉錄因子等轉錄相關蛋白結合;最后,Brdt識別乙酰化的組蛋白尾開始了組蛋白移除和精蛋白并入DNA的過程,移除的乙酰化組蛋白在精子蛋白酶體PA200/Blm10-20S的作用下降解[35-37](圖2)。實際上,在組蛋白乙酰化的同時,也發生了H2AX磷酸化、H2A泛素化和組蛋白多ADP核糖基化,這些組蛋白PTMs互相作用共同調節組蛋白移除過程[38-40]。McGraw等[41]在牛細長型精子細胞中檢測到了催化H3和H4的組蛋白乙酰轉移酶MYST4。Steilmann等[42]在人和小鼠細長型精子細胞中發現了H3K9乙酰化。H4賴氨酸尾部乙酰化一般影響到第5、8、12、16位殘基,為進一步確定延伸期組蛋白H4賴氨酸的乙酰化情況,De Vries等[43]研究發現在人類細長型精子細胞中,H4乙酰化主要發生在第8和第16位殘基上。Govin等[44]觀察到在小鼠伸長型精子細胞中總體乙酰化提高主要在組蛋白H4的第5、8、12位殘基,而不包括第16位殘基,用特異性抗體進行的免疫熒光實驗表明,所有3種乙酰化賴氨酸—acK5、acK8和acK12在細長型精子細胞中與主要的衛星區域相關。此外,在哺乳動物細長型精子細胞中,觀察到了不同HMT和HDM的表達,H3K4和H3K9單甲基化、二甲基化和三甲基化以及H3K27的單甲基化和三甲基化在細長型精子細胞中高度表達,這些組蛋白甲基化與乙酰化相互協調,使染色質組態更加開放[43,45]。
(二)組蛋白乙酰化與基因轉錄調控
精子發生過程中,組蛋白乙酰化有利于染色質解聚,以促進聚合酶Ⅱ對基因的轉錄[33]。乙酰化酶家族作為輔助激活因子,一般使轉錄激活,去乙酰化酶家族則相反[46]。HAT通過在組蛋白的N端賴氨酸殘基上引入疏水的乙酰基,使DNA與組蛋白間的靜電引力和空間位阻增大,兩者間的相互作用減弱,DNA易于解聚,染色質呈轉錄活性結構,有利于轉錄因子與DNA模板相結合,進而募集轉錄共激活因子,整合轉錄因子傳來的信息,最終決定轉錄的水平[47,48]。相反,HDAC使去乙酰化后帶正電的組蛋白與帶負電的DNA緊密結合,染色質呈致密卷曲的阻抑結構,從而抑制基因轉錄[48]。
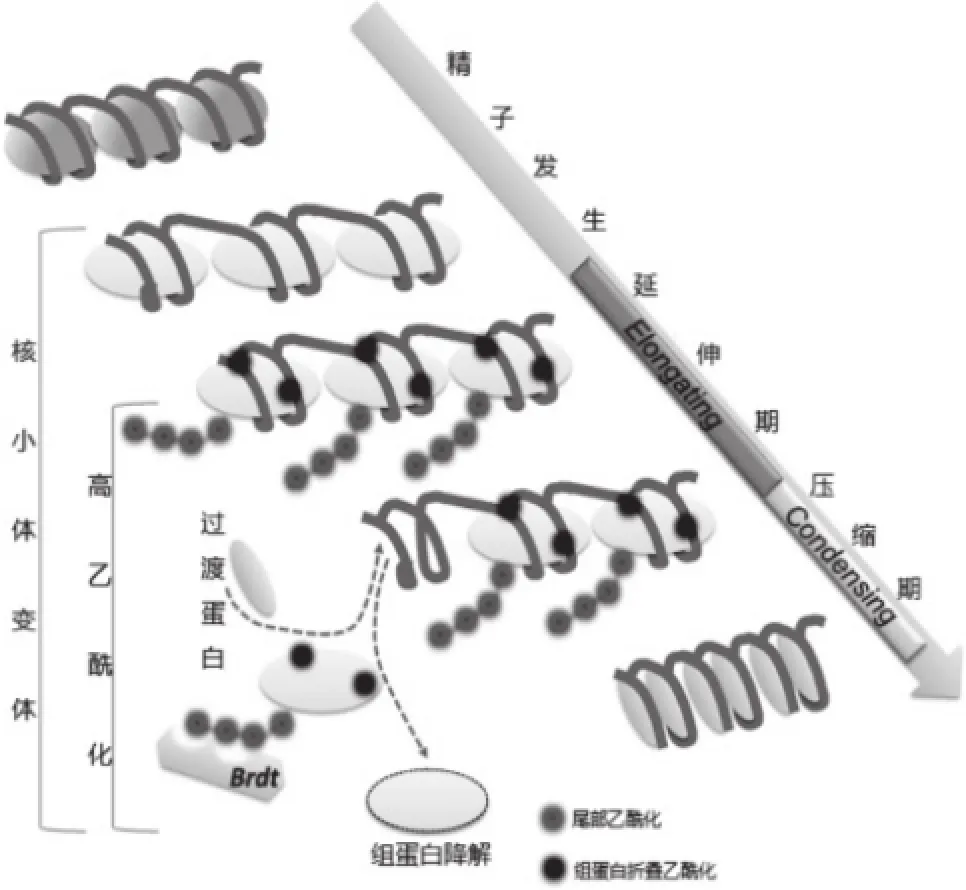
圖2 精子延伸期過渡蛋白替換組蛋白模型[35]
四、精子發生過程中組蛋白泛素化
組蛋白泛素化在精子發生過程中發揮著至關重要的作用,其泛素化水平由泛素活化酶E1、泛素接合酶E2和泛素連接酶E3共同調節[30,49]。近期,蛋白質組學研究發現在4600多種人類精子蛋白中,大約有220種蛋白質是精子特有的[50]。自從泛素首次從魚類和哺乳類動物中分離,有30多種泛素化酶被認為是精子發生過程中重要的調節因子[51-53]。據估計大約有70種E3在小鼠精子發生過程中表達,表明泛素系統有著多種重要功能[54]。哺乳動物中含有近90種去泛素化酶,他們是精子發生過程中重要的調節因子,其基因突變或DNA序列的靶向斷裂會導致精子發育和生育能力的嚴重異常[55]。Manku等[56]研究發現在生殖母細胞和精原細胞泛素系統所表達的205個基因中有91個基因相對高表達,其中包括去泛素化酶如泛素特異蛋白酶2(ubiquitin-specif c protease 2, USP2)和USP19,表明去泛素化在生殖母細胞分化過程中發揮著重要作用。
(一)組蛋白泛素化與組蛋白替代
精子發生過程中,泛素結合蛋白的水平呈動態變化,在精原細胞和精母細胞中含量微弱,在圓形精子和長形精子中含量增加,在成熟精子中含量較低。通過蛋白免疫印跡實驗發現泛素結合蛋白在精子延伸期大量出現,其可能與組蛋白的移除與降解有關[57]。組蛋白泛素化可以提高轉運蛋白或精蛋白與轉錄調節因子的結合力有助于染色質解聚,HR6B是Rad6 E2的一種同系物,定位于常染色質區,在精子延伸期高度表達[58],Roest等[59]通過對小鼠的研究發現HR6B的破壞會造成生精細胞廣泛凋亡、精子頭部形態異常和不完全的組蛋白替代,表明由HR6B催化的組蛋白泛素化在組蛋白替代和核濃縮等過程中發揮著重要作用。Lu等[60]通過研究RNF8基因敲除的小鼠模型,發現在精子發生過程中組蛋白泛素化通過減少H2A-H2B二聚體釋放能量來促進翻譯過程,進而影響組蛋白乙酰化,RNF8 E3催化H2A泛素化的同時也會通過H4K16乙酰轉移酶促進H4乙酰化,表明H2A泛素化與H4乙酰化在翻譯過程中具有協同作用。此外,RNF8敲除的小鼠睪丸研究顯示,組蛋白泛素化的抑制和H4K16乙酰化的去除是核小體移除過程開始的標志,可見組蛋白泛素化和乙酰化是一個高度互相作用的過程。
(二)組蛋白泛素化與基因轉錄調控
組蛋白泛素化在調節基因轉錄活性方面發揮著重要作用,對闡明泛素化與核濃縮的關系十分必要。近期研究表明,位于復制叉的Uhrf1蛋白通過其SRA domain與半甲基化位點結合,然后將其C末端的Ring domain作為E3催化H3K23泛素化,泛素化的H3K23通過與RFTS domain作用,將Dnmt1募集到復制中心,使半甲基化的CpG甲基化,進而調控基因轉錄[6,61]。此外,組蛋白泛素化通過作用于SCF復合體中的FBXO22,調節組蛋白去甲基化酶4A,也可影響基因轉錄過程[62]。組蛋白H2A泛素化會導致轉錄抑制[63,64],在有絲分裂的粗線期,H2A泛素化在X和Y擬常染色體聯會的區域富集[65],通過與一系列特殊的組蛋白修飾如H3K9二甲基化、H4去乙酰化和H2AX磷酸化協同作用一起誘發MSCI過程使性染色體轉錄抑制[66,67]。此外,H3K36me2的去甲基化酶Kdm2b與H2A泛素化協同作用,前者可將PRC1復合體的變體募集到CpG島上,后者則可抑制FACT(FACT可以促進RNA聚合酶在染色質上滑動)與染色質結合,其可能是PRC1介導基因沉默的機制之一[6,68]。組蛋白H2B泛素化一般導致轉錄激活[69-72],然而Sun等[73]通過對酵母菌的研究發現H2B組蛋白單泛素化會導致組蛋白H3甲基化,進而造成端粒基因的沉默。可見組蛋白泛素化調控基因轉錄的具體過程還有待于進一步研究。
精子發生過程中組蛋白翻譯后修飾呈動態變化,各種組蛋白翻譯后修飾緊密聯系,通過與其他表觀遺傳修飾因子協同作用,精確地調節精子發生的各個過程。減數分裂時期,H2A泛素化通過影響H2B和H3高甲基化調控DNA損傷修復過程;精子形成時期,組蛋白泛素化調控與組蛋白乙酰化、甲基化、磷酸化修飾相互協調共同調控精子形成過程;此外精子表觀遺傳修飾如DNA去甲基化、miRNA表達以及組蛋白修飾等不僅在精子形成中發揮重要作用,在胚胎干細胞中也具有相似的功能,因此de Boer 等[74]認為,精子可能是跨代遺傳不穩定和后代基因突變的源頭,Carrell也發現人類精子中的組蛋白修飾主要富集在對早期胚胎發育有重要影響的Hox發育基因中,進一步證明了精子中組蛋白修飾對早期胚胎發育的重要性[75]。
五、問題與展望
隨著生物學技術的迅猛發展,人們對組蛋白PTMs認識的日益深入,在組蛋白密碼研究方面做出了一定成績。人們發現在精子發生過程中,多種組蛋白PTMs可以單獨或協同作用調節基因的轉錄水平以及參與組蛋白移除和DNA損傷修復等多種生物學過程,而且組蛋白PTMs與其他表觀遺傳修飾之間也可以相互作用,如組蛋白甲基化與DNA甲基化相互作用共同維持特定的染色質結構來調控基因的轉錄,組蛋白乙酰化與精蛋白相互作用,完成精蛋白替代組蛋白的過程。雖然不同組蛋白甲基化都能影響DNA甲基化,對基因轉錄起到促進或抑制作用,但這種作用的機制還不是十分明確。此外,精子發生過程中各種生物學過程均需要多種表觀遺傳修飾共同作用完成,只有對各種表觀遺傳修飾進行綜合分析,才有可能對精子發生過程中染色質濃縮、基因轉錄調節和精蛋白替代組蛋白等過程有一個深入而全面的理解。此外,精子中各種組蛋白PTMs相互作用并與其他表觀遺傳修飾因子協同調控早期胚胎發育過程的具體機制將成為生殖專家研究的另一個新方向。為加強精子表觀遺傳研究的系統性和特異性,本實驗室與美國猶他大學Andrology and IVF實驗室聯合開展了精子形態分類(WHO標準)基礎上的表觀遺傳因子DNA甲基化、H3K4me2和H3K27me3的膠體金免疫定位研究,試圖建立精子表觀遺傳質量評價標準,為進一步研究組蛋白密碼的作用機制及其功能作用提供理論基礎。
致謝:本課題由河北省自然科學基金資助項目(編號:H2013201259);河北省2013留學回國人員科研活動項目(編號:C2013005002)和河北大學創新訓練項目(編號:201410075029,201410075073)資助
組蛋白類; 生物,基因修飾; 精子發生;轉錄,遺傳
1 張朝暉, 康現江, 穆淑梅. 遺傳 2014; 36(3): 220-227
2 Zhang Y, Reinberg D.Genes Dev2001; 15(18): 2343-2360
3 宋博研, 朱衛國. 遺傳 2011; 33(4): 285-292
4 Tamaru H, Selker EU.Nature2001; 414(6861): 277-283
5 Lehnertz B, Ueda Y, Derijck AA,et al. Curr Biol2003; 13(14): 1192-1200
6 Rose NR, Klose RJ.Biochim Biophys Acta2014 pii: S1874-9399(14)00028-5
7 Spies N, Nielsen CB, Padgett RA,et al. Mol Cell2009; 36(2): 245-254
8 Kolasinska-Zwierz P, Down T, Latorre I,et al. Nat Genet2009; 41(3): 376-381
9 Andersson R, Enroth S, Rada-Iglesias A,et al. Genome Res2009; 19(10): 1732-1741
10 Huff JT, Plocik AM, Guthrie C,et al. Nat Struct Mol Biol2010; 17 (12): 1495-1499
11 Brown SJ, Stoilov P, Xing Y.Hum Mol Genet2012; 21(R1): R90-R96
12 Fuks F, Hurd PJ, Deplus R,et al.Nucleic Acids Res2003; 31(9): 2305-2312
13 Li H, Rauch T, Chen ZX,et al. J Biol Chem2006; 281(28): 19489-19500
14 Chang Y, Sun L, Kokura K,et al. Nat Commun2011; 2: 533
15 Dhayalan A, Rajavelu A, Rathert P,et al. J Biol Chem2010; 285(34): 26114-26120
16 Roudier F, Ahmed I, Berard C,et al. EMBO J2011; 30(10): 1928-1938
17 Boissonnas CC, Jouannet P, Jammes H.Fertil Steril2013; 99(3): 624-631
18 Lachner M, Jenuwein T.Curr Opin Cell Biol2002; 14(3): 286-298
19 Suganuma T, Workman JL.Cell2008; 135(4): 604-607
20 Barski A, Cuddapah S, Cui K,et al. Cell2007; 129(4): 823-837
21 Simon JA, Kingston RE.Nat Rev Mol Cell Biol2009; 10(10): 697-708
22 Gannon JR, Emery BR, Jenkins TG,et al. Adv Exp Med Biol2014; 791: 53-66
23 Khalil AM, Wahlestedt C.Epigenetics2008; 3(1): 21-28
24 Schwaba KR, Smith GD, Dressler GR.Dev Biol2013; 373(1): 64-71
25 Rogakou EP, Pilch DR, Orr AH,et al. J Biol Chem1998; 273(10): 5858-5868
26 Elgin SC, Grewal SI.Curr Biol2003; 13(23): R895-R898
27 Kimmins S, Sassone-Corsi P.Nature2005; 434(7033): 583-589
28 Ahn SH, Henderson KA. Keeney S,et al. Cell Cycle2005; 4(6): 780-783
29 Talasz H, Sarg B, Linder HH.Chromosoma2009; 118(6): 693-709
30 Lu S, Xie YM, Li X,et al.Mol Hum Reprod2009; 15(6): 373-378
31 Zalensky AO, Siino JS, Gineitis AA,et al. J Biol Chem2002; 277(45): 43474-43480
32 Carrell DT, Hammoud SS.Mol Hum Reprod2010; 16(1): 37-47
33 葛少欽, 李建忠, 張曉靜. 遺傳 2011; 33(9): 939-946
34 Jenkins TG, Carrell DT.Asian J Androl2011; 13(1): 76-80
35 Goudarzi A, Shiota H, Rousseaux S,et al. J Mol Biol2014; 426(20): 3342-3349
36 Kouzarides T.Cell2007; 128(4): 693-705
37 Qian MX, Pang Y, Liu CH,et al. Cell2013; 153(5): 1012-1024
38 Leduc F, Maquennehan V, Nkoma GB,et al. Biol Reprod2008; 78(2): 324-332
39 Baarends WM, Hoogerbrugge JW, Roest HP,et al. Dev Biol1999; 207(2): 322-333
40 Meyer-Ficca ML, Scherthan H, Burkle A,et al. Chromosoma2005; 114(1): 67-74
41 McGraw S, Morin G, Vigneault C,et al. BMC Dev Biol2007; 7: 123
42 Steilmann C, Paradowska A, Bartkuhn M,et al. Reprod Fertil Dev2011; 23(8): 997-1011
43 De Vries M, Ramos L, Housein Z,et al. Biol Open2012; 1(5): 446-457
44 Govin J, Escoffier E, Rousseaux S,et al. J Cell Biol2007; 176(3): 283-294
45 Godmann M, Auger V, Ferraroni-Aguiar V,et al. Biol Reprod2007; 77(5): 754-764
46 王維, 孟智啟, 石放雄. 遺傳 2012; 34(7): 810-818
47 盧震, 王永潮. 科學通報 1998; 43(8): 792-797
48 管曉翔, 陳龍邦. 中華腫瘤防治雜志 2007; 14(4): 307-310
49 Nobuhiro N.Cells2013; 2(4): 732-750
50 Wang G, Guo Y, Zhou T,et al. J Proteomics2013; 79: 114-122
51 Roth G, Himstedt W.Naturwissenschaften1978; 65(12): 657-658
52 Loir M, Caraty A, Lanneau M,et al. FEBS Lett1984; 169(2): 199-204
53 Hou CC, Yang WX.Mol Biol Rep2013; 40(4): 3213-3230
54 Hou X, Zhang W, Xiao Z,et al. BMC Genomics2012; 13: 495
55 Clague MJ, Barsukov I, Coulson JM,et al. Physiol Rev2013; 93(3):1289-1315
56 Manku G, Wing S, Culty M.Biol Reprod2012; 87(2): 44
57 葛少欽, 康現江, 劉桂榮, 等. 生物學雜志 2008; 25(2): 1-6
58 Koken MH, Hoogerbrugge JW, Jasper-Dekker I,et al. Dev Biol1996; 173(1): 119-132
59 Roest HP, van Klaveren J, de Wit J,et al. Cell1996; 86(5): 799-810
60 Lu LY, Wu J, Ye L,et al. Dev Cell2010; 18(3): 371-384
61 Nishiyama A, Yamaguchi L, Sharif J ,et al. Nature2013; 502(7470): 249-253
62 Labbé RM, Holowatyj A, Yang ZQ.Am J Transl Res2013; 6(1): 1-15
63 Osley MA.Brief Funct Genomics Proteomic2006; 5(3): 179-189
64 Weake VM, Workman JL.Mol Cell2008; 29(6): 653-663.
65 Baarends WM, Wassenaar E, van der Laan R.Mol Cell Biol2005; 25(3): 1041-1053
66 Turner JM, Mahadevaiah SK, Fernandez-Capetillo O,et al. Nat Genet2005; 37(1): 41-47
67 Sheng K, Liang X, Huang S,et al. Biomed Res Int2014: 870695
68 Simon JA, Kingston RE.Nat Rev Mol Cell Biol2009; 10(10): 697-708
69 Henry KW, Wyce A, Lo WS,et al. Genes Dev2003; 17(21): 2648-2663
70 Kao CF, Hillyer C, Tsukuda T,et al. Genes Dev2004; 18(2): 184-195
71 Wood A, Schneider J, Shilatifard A.Biochem Cell Biol2005; 83(4): 460-467
72 Pavri R, Zhu B, Li G,et al. Cell2006; 125(4): 703-717
73 Sun ZW, Allis CD.Nature2002; 418(6893): 104-108
74 de Boer P, Ramos L, de Vries M,et al. Mol Hum Rep2009; 16(1): 48-56
75 Carrell DT.Fertil Steril2012; 97(2): 267-274
(2014-06-25收稿)
10.3969/j.issn.1008-0848.2014.10.016
R 394.1

