結核分枝桿菌NrdF1、PE_PGRS35、Rv1985c和Rv1986的原核表達及檢測牛結核病抗體之應用
孫 林,劉 艷,2,閔晨雨,胡亞辰,陳 祥,焦新安
牛結核病是主要由牛分枝桿菌(Mycobacteriumbovis,M.bovis,M.bhuo或Mb)感染引起的一種慢性消耗性人獸共患傳染病,被世界動物衛生組織列為需通報的動物疫病[1],我國將其列為二類動物疫病,該病不僅嚴重危害畜牧業的健康發展,同樣也會引起人結核病的發生,對人類健康造成重大威脅。國際上普遍采用“檢疫-撲殺”的手段來對牛結核病進行防控,目前法定的牛結核檢疫方法是結核菌素皮內變態反應(tuberculin skin test,TST),但是結核菌素是粗提物,含有200多種組分,與環境分枝桿菌等存在交叉反應,導致假陽性產生,因此迫切需要研制特異的牛結核病診斷方法。
差異區2(region of difference 2,RD2)是BCG在1927-1931年傳代過程中丟失的基因片段[2-3],RD2的丟失將有利于BCG進一步的減毒,RD2共包含11個基因,這些基因在所有結核分枝桿菌毒株中保守存在。研究表明,RD2區域中的MPT64和CFP21具有較強的免疫原性[4],現已被用于結核病疫苗和診斷試劑的開發,但是對該區域中的其它組分還知之甚少,特應用大腸桿菌表達系統表達RD2區域的NrdF1、PE_PGRS35、Rv1985c和Rv1986,并分別以此4種融合蛋白純化產物作為包被抗原進行牛結核病血清學檢測,探討牛結核病新型診斷試劑研制。
1 材料與方法
1.1菌株和載體 大腸桿菌E.coliDH5α、E.coliBL21(DE3)由本實驗室保存;滅活的結核分枝桿菌標準株H37Rv由中國疾病預防控制中心傳染病預防控制所萬康林研究員饋贈;原核表達載體pET-32a(+)由本實驗室保存,pEASY-E1購自北京全式金生物技術有限公司。
1.2試劑 限制性內切酶NdeⅠ、XhoⅠ、Hind Ⅲ、PyrobestTMDNA聚合酶、DL2000 DNA Marker、T4 DNA連接酶等購自寶生物工程(大連)有限公司,基因組提取試劑盒購自天根生化科技(北京)有限公司;DNA膠回收試劑盒購自北京百泰克公司;羊抗兔IgG-HRP購自Invitrogen公司;抗His單抗、羊抗鼠IgG-HRP購自Sigma公司;Ni-NTA His Bind?purification Kit購自Novagen公司,BOVIGAMTM牛結核病IFN-γ檢測試劑盒購自Prionics公司。
1.3牛血清來源 137份牛血清來源于中國東部某牛場,經牛γ干擾素試驗檢測,68份樣本為陽性,69份樣本為陰性。
1.4目的基因的擴增 使用基因組提取試劑盒提取H37Rv基因組DNA,根據http://genolist.pasteur.fr/TubercuList/index.html公布的nrdF1、pe_pgrs35、rv1985c和rv1986序列,設計引物,引物由華大基因有限公司合成,詳細序列信息見表1。以所提取的基因組DNA為模板,用高保真DNA聚合酶進行PCR擴增,反應條件為94 ℃預變性5 min;94 ℃ 30 s,Tm 40 s,72 ℃ 30 s,30次循環,72 ℃延伸5 min。
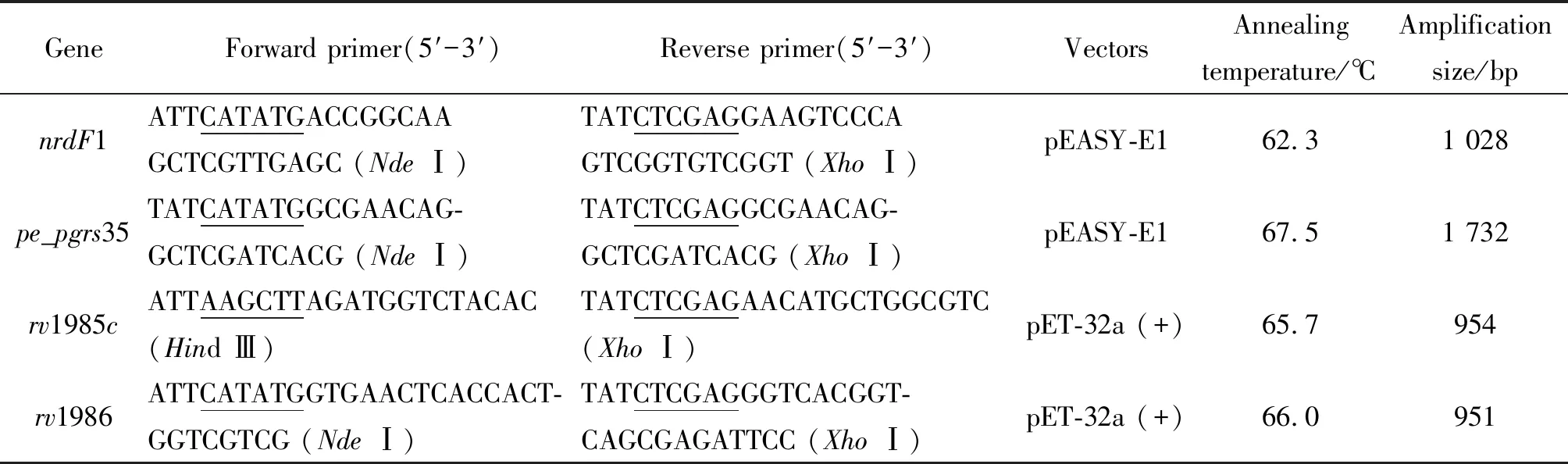
表1 目的基因引物和表達載體
1.5重組表達質粒的構建 目的基因和表達載體分別進行雙酶切,基因對應的表達載體及酶切位點信息見表1,酶切產物進行瓊脂糖凝膠電泳后分別切膠回收目的片段,將nrdF1和pe_pgrs35基因分別與pEASY-E1載體片段連接,rv1985c和rv1986基因分別與pET-32a (+)載體片段連接,連接產物轉化DH5α 感受態細菌,通過Amp+抗性篩選、經NdeⅠ/XhoⅠ或者Hind Ⅲ/XhoⅠ雙酶切鑒定,陽性克隆送南京金斯瑞生物科技有限公司測序,測序正確的質粒命名為pEASY-E1-nrdF1、pEASY-E1-nrdF1、pET32a-rv1985c和pET32a-rv1986。
1.6重組蛋白的誘導表達與純化 將鑒定正確的重組表達質粒轉化表達菌E.coliBL21(DE3),重組菌命名為BL21(DE3)(pEASY-E1-nrdF1)、BL21(DE3) ( pEASY-E1-pe_pgrs35)、BL21(DE3)(pET32a-rv1985c)和BL21(DE3)(pET32a-rv1986)。將重組菌小量接種,過夜培養,過夜培養物1∶100擴大培養,37 ℃搖床培養至OD600 nm為0.4~0.5,加入IPTG使其終濃度為0.5 mmol/L,30 ℃誘導5~6 h。4 ℃、8 000 r/min離心收集細菌,PBS充分洗滌2次后進行超聲波裂解菌體,分別收集裂解上清和沉淀進行SDS-PAGE,分析蛋白表達情況。融合蛋白的純化按照Novagen公司的Ni-NTA His Bind?purification Kit說明書進行。
1.7Western-blotting分析 將純化的NrdF1、PE_PGRS35、Rv1985c和Rv1986融合蛋白進行SDS-PAGE,然后轉移至硝酸纖維素膜,含1% BSA的PBST封閉過夜,加入抗HIS單抗,37℃孵育2 h,PBST洗滌3次,與HRP標記的羊抗鼠IgG 37 ℃ 作用1h,PBST洗滌3次,DAB顯色并觀察結果。
1.8融合蛋白在牛結核病ELISA檢測中的初步應用 按照文獻[5]方法,利用牛γ干擾素試驗進行牛結核病檢測,對于檢測陽性的樣品,分別以NrdF1、PE_PGRS35、Rv1985c和Rv19864種融合蛋白純化產物作為包被抗原,應用間接ELISA方法對血清中的特異抗體進行檢測。
2 結 果
2.1目的基因的PCR 擴增及表達載體的構建 以結核分枝桿菌H37Rv基因組DNA 為模板,PCR 擴增nrdF1、pe_pgrs35、rv1985c和rv1986基因,產物進行10 g/ L 瓊脂糖凝膠電泳,結果顯示,擴增片段與預期大小相符,分別為1 028 bp、1 732 bp、954 bp和951 bp(圖1)。將PCR產物與表達載體連接,轉化E.coliDH5α感受態細胞,Amp+抗性篩選陽性克隆,經NdeⅠ/XhoⅠ或者Hind Ⅲ/XhoⅠ雙酶切,目的片段符合預期大小,同時測序結果表明插入基因序列與發表的序列100 %一致,說明結核分枝桿菌nrdF1和pe_pgrs35基因成功克隆入pEASY-E1表達載體、rv1985c和rv1986基因成功克隆入pET-32a (+)表達載體。
2.2重組菌的誘導表達及純化 挑取重組菌BL21(DE3)(pEASY-E1-nrdF1) 、BL21(DE3)(pEASY-E1-pe_pgrs35)、BL21(DE3)(pET32a-rv1985c)、BL21(DE3) ( pET32a-rv1986)單個克隆,經IPTG誘導,超聲波裂解離心后的上清和沉淀進行SDS-PAGE 分析,結果表明nrdF1、pe_pgrs35、rv1985c和rv1986基因在大腸桿菌中都獲得了表達,對應分子量分別為42 ku、63 ku、46 ku和41 ku,其中NrdF1、PE_PGRS35以及Rv1986以包涵體形式存在,Rv1985c以可溶和包涵體兩種方式表達(圖2)。經過鎳柱親和純化后,均獲得了純化蛋白(圖2),其中Rv1985c是從上清純化獲得,其余的蛋白均是由包涵體純化獲得。
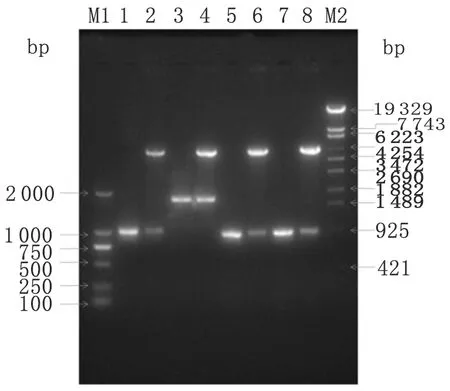
圖1nrdF1和pe_pgrs35基因PCR擴增及表達載體酶切鑒定
Fig.1PCRamplificationofnrdF1,pe_pgrs35,rv1985c,andrv1986DNAfragmentsfromMycobacteriumtuberculosisH37Rvgenomeandenzymedigestion
M1: DL2000 DNA Marker;
1:nrdF1 PCR amplification;
2: pCR2.1-nrdF1 digested byNdeⅠ andXhoⅠ;
3:pe_pgrs35 PCR amplification;
4: pCR2.1-pe_pgrs35 digested byNdeⅠ andXhoⅠ;
5:rv1985cPCR amplification;
6: pCR2.1-rv1985cdigested byHind Ⅲ andXhoⅠ;
7:rv1986 PCR amplification;
8: pCR2.1-rv1986 digested byNdeⅠ andXhoⅠ;
M2: λ-EcoT14 Ⅰdigest DNA Marker.
2.3Western-blot分析 抗HIS單抗能夠識別純化的重組蛋白NrdF1、PE_PGRS35、Rv1985c和Rv1986,說明表達的重組蛋白具有良好的免疫反應性。
2.4融合蛋白在牛結核病ELISA檢測中的初步應用 通過牛γ干擾素試驗共檢出68頭陽性牛,以純化的重組蛋白作為包被抗原進行牛結核病血清學檢測,結果NrdF1的陽性檢出率為7.35% (5/68),陰性檢出率為85.51%(59/69);PE_PGRS35的陽性檢出率為22.06%(15/68),陰性檢出率為86.96%(60/69);Rv1985c的陽性檢出率為16.18%(11/68),陰性檢出率為79.71.0%(55/69);Rv1986的陽性檢出率為16.18%(11/68),陰性檢出率為84.06%(58/69)。

圖2重組菌誘導表達產物的SDS-PAGE分析
Fig.2SDS-PAGEanalysisoftheexpressedproductsoftherecombinantBL21(DE3)
M:Low molecular protein marker;
1: Sediments of lysate of BL21 (DE3) (pEASY-nrdF1) induced by IPTG;
2: BL21 (DE3) (pEASY) induced by IPTG;
3: sediments of lysate of BL21 (DE3) (pEASY-pe_pgrs35) induced by IPTG;
4: supernatant of lysate of BL21 (DE3) (pET32a-rv1985c) induced by IPTG;
5: BL21 (DE3) (pET32a) induced by IPTG;
6: sediments of lysate of BL21 (DE3) (pET32a-rv1986) induced by IPTG;
7: purified NrdF1; 8: purified PE_PGRS35;
9: purified Rv1985c; 10: purified Rv1986.
3 討 論
至今為止“檢疫→撲殺”是控制牛結核的有效方法,因此準確而及時的診斷對該病的控制極為重要。細菌學檢查方法仍被認為是結核病確診的金標準,但是牛分枝桿菌生長緩慢,分離率低(20%左右),需要生物安全措施,同時對于病理部分樣品的采集需要屠宰奶牛,不適用于活畜的檢疫,嚴重影響了該方法的推廣[5]。目前皮試變態反應在牛結核病的診斷中被廣泛使用,但是特異性較差,診斷結果假陽性率較高,因此迫切需要研究開發出特異性好、便于臨床應用的鑒定方法。
特異性的不足主要是由于使用的抗原和環境分枝桿菌存在交叉反應,因此鑒定特異的牛分枝桿菌抗原對研發特異性診斷試劑顯得尤為必要,比較基因組學的研究提供了大量特異性抗原信息,常用于新型抗結核病候選疫苗和診斷試劑研發。Mahairas等[2]利用差減雜交技術比較了結核分枝桿菌、牛分枝桿菌毒力株與BCG基因組發現3個差異區,命名為RD1、RD2及RD3;后來Behr等[3]利用細菌人工染色體文庫、細菌人工染色體陣列及DNA微陣列,又鑒別出13個差異區:分別命名為RD4—RD16。

圖3融合蛋白的Westernblotting分析
Fig.3Western-blottingassayofpurifiedfusionproteins
M: Low molecular protein marker;
1: Purified NrdF1; 2: Purified Rv1985c;
3: Purified Rv1986; 4: Purified PE_PGRS35.
由RD區基因編碼的蛋白質構成潛在免疫診斷特異性抗原的來源[2-3,6],尤其是對RD1區蛋白已研究得較為清楚,ESAT-6、CFP10、Rv3872和Rv3873(TB37.6)已被確定為診斷抗原[7-9]。本研究選取RD2區域中的NrdF1、PE_PGRS35,Rv1985c和Rv1986等四種蛋白進行原核融合表達與純化,并分別以NrdF1、PE_PGRS35、Rv1985c和Rv1986四種融合蛋白純化產物作為包被抗原,應用間接ELISA方法對血清中的特異抗體進行檢測,結果顯示4種蛋白的陽性檢出率分別為7.35%、22.06%、16.18%和16.18%,顯示出一定的診斷價值,在接下來的研究中,我們將結合實驗室前期工作中表達純化的其他結核分枝桿菌特異的抗原,采用組合多種抗原的方法來進一步提高特異性和靈敏度。
參考文獻:
[1]World Organization for Animal Health. Manual of diagnostic test and vaccines for terrestrial animals[M]. Paris: Office international des epizooties. 2009: 16-22.
[2]Mahairas GG,Sabo PJ,Hickey MJ,et al. Molecular analysis of genetic differences betweenMycobacteriumbovisBCG and virulentM.Bovis[J]. J Bacteriol,1996,178(5): 1274-1282.
[3]Behr MA,Wilson MA,Gill WP, et al. Comparative genomics of BCG vaccines by whole-genome DNA microarray[J]. Science,1999,284(5419): 1520-1523. DOI: 10.1126/science.284.5419.1520
[4]Sable SB,Goyal D,Verma I,et al. Lung and blood mononuclear cell responses of tuberculosis patients to mycobacterial proteins[J]. Eur Respir J,2007,29(2): 337-346. DOI: 10.1183/09031936.00111205
[5]Chen X,Xu ZH,Shi ZH,et al. Comparision of gamma-interferon assay and tuberculin skin test for detection of bovine tuberculosis[J]. Chin J Zoonoses,2011,27(2): 97-100. (in Chinese)
陳祥,徐正中,時振華,等. γ-干擾素試驗和皮試變態反應對檢測奶牛結核病的比較[J]中國人獸共患病學報,2011,27(2): 97-100.
[6]Brosch R,Gordon SV,Billault A, et al. Use of aMycobacteriumtuberculosisH37Rv bacterial artificial chromosome library for genome mapping,sequencing,and comparative genomics[J]. Infect Immun,1998,66(5): 2221-2229.
[7]Brusasca PN,Colangeli R,Lyashchenko KP,et al. Immunological characterization of antigens encoded by the RD1 region of theMycobacteriumtuberculosisgenome[J]. Scand J Immunol. 2001,54(5): 448-452. DOI: 10.1046/j.1365-3083.2001.00975.x
[8]van Pinxteren LA,Ravn P,Agger EM,et al. Diagnosis of tuberculosis based on the two specific antigens ESAT-6 and CFP10[J]. Clin Diagn Lab Immunol,2000,7(2): 155-160.
[9]Lyashchenko K,Colangeli R,Houde M,et al. Heterogeneous antibody responses in tuberculosis patients[J]. Infect Immun,1998,66(8): 3936-3940.

