蜂膠對豬細小病毒滅活疫苗佐劑作用的試驗
馬 霞,劉永錄,郭振環,沈志強
(1.河南牧業經濟學院,河南 鄭州450011;2.山東省濱州畜牧獸醫研究院,山東 濱州256600)
豬細小病毒(Porcine ParvovirusVaccine,PPV)病是引起母豬繁殖障礙的主要病因之一,為了預防豬細小病毒病,上海市農業科學院畜牧獸醫研究所在國內首先研制成功豬細小病毒病滅活疫苗[1],并證實豚鼠可以作為豬細小病毒病疫苗效力檢驗的實驗動物[2],豚鼠免疫油佐劑細小病毒疫苗后具有免疫效果確實[3]的優點。國外在用豚鼠和家兔作為疫苗的效力檢驗方面也做過探討[4]。
本試驗以豚鼠為模型動物,以油佐劑和鋁膠佐劑為對照,觀察蜂膠對豬細小病毒滅活疫苗的佐劑作用。
1 材料與方法
1.1 蜂膠佐劑的制備 將生產用蜂膠(購自山東省聊城蜂業研究所,蜂膠在75%乙醇溶解率≧65%),在2℃~8℃條件下磨碎過篩,按1∶4(W/V)比例加入95%乙醇,室溫浸泡48 h,冷卻、過濾,即得純凈蜂膠乙醇浸出液(透明栗色溶液)。
1.2 主要試劑和儀器 主要試劑:RPMI1640培養液,Gibco公司產品;按說明書用三蒸水配制后過濾除菌,分裝,4℃保存;伴刀豆素球蛋白(ConA),Sigma公司產品;-20℃保存;Hank's試劑按照文獻[5]配制;小牛血清:杭州四季青生物有限公司產品;56℃30min滅活,分裝,-20℃保存備用;四唑鹽(MTT):3-(4,6-二甲基噻唑-2-x-l)-2,5-乙苯基-四唑溴鹽,Sigma公司產品。其他試劑皆為分析純。ELISA檢測試劑盒,R&D Systems Inc,Minneapolis,USA.
主要儀器設備:MULTISKAN-MK3型酶聯免疫檢測儀,賽默飛世爾(上海)儀器有限公司產品;CO2培養箱,美國Revco公司生產;XSZ-D2型倒置顯微鏡,重慶光學儀器廠生產;75-2A型微量振蕩器,上海醫用分析儀器廠生產;96孔細胞培養板和6孔細胞培養板,德國Nunclon公司生產。
1.3 PPV疫苗的制備
1.3.1 病毒接種及收毒 PPV-SD1毒株,山東省濱州畜牧獸醫研究院分離、鑒定后保存。豬的腎原傳代細胞(Porcine kidney 15,PK-15),中國獸醫藥品監察所提供。按照常規細胞培養方法[6],用含有8%新生牛血清的DMEM液(pH=7.2)作為PK-15細胞的培養液,用0.25%胰酶消化傳代,置于37℃、5%CO2培養箱中培養。PK-15細胞生長至12~15 h時,按照5%接種量接種PPV,待細胞有80%發生細胞病變時收毒。并用豚鼠紅細胞血凝試驗測血凝效價[7],并測定病毒含量[8]。
1.3.2 病毒的滅活 0.3%甲醛在37℃條件下作用24 h,并不斷攪拌。滅活病毒用PK-15細胞連續傳代3次,觀察細胞有無病變確定病毒滅活是否完全。并按《中華人民共和國獸用生物制品質量標準》(2000版)附錄中方法進行無菌檢驗。
1.3.3 蜂膠佐劑疫苗的制備 取滅活后PPV加入一定比例蜂膠乙醇提取液,用膠體磨慢速轉動攪拌,3 000 r/min攪拌3~5min,使其充分混合乳化。終止攪拌前按總量的0.005%加入10%硫柳汞溶液。
1.3.4 鋁膠疫苗的制備 取滅活后的PPV配以20%氫氧化鋁膠佐劑,按總量的0.005%加入10%硫柳汞溶液。
1.3.5 油佐劑疫苗的制備 94%白油與6%司本-80混合后加2%硬脂酸鋁,滅菌后為油相,滅活后的PPV抗原液加2%吐溫-80為水相,按照油相和水相5∶3比例混合,乳化。乳化時先緩速混合,再用膠體磨10 000 r/min攪拌20 min。終止攪拌前按總量的0.005%加入10%硫柳汞溶液。
1.4 實驗動物 健康豚鼠,體重350 g左右,購自北京中醫藥大學動物中心。飼養于濱州畜牧獸醫研究院P2動物房(溫度18℃~24℃,24 h光照),籠長×寬×高為80×50×40 cm,每籠2只,定時用動物房購買豚鼠飼料喂養,自由飲水。試驗前檢測HI抗體效價陰性。
1.5 試驗設計 取豚鼠68只隨機均分為4組,1~3組分別肌肉注射0.5mL蜂膠佐劑(propolisadjuvant,PA)PPV滅活疫苗、鋁膠佐劑(Aluminum saltadjuvant,AA)PPV滅活疫苗、油佐劑(oilemulsion adjuvant,OA)PPV滅活疫苗0.5mL,空白對照(blank control,BC)組注射0.5mL生理鹽水,2周后二免。分別于免疫后第7(D7)、14(D14)、21(D21)、28(D28)、35(D35)天和第42(D42)天每組5只豚鼠心臟采血0.5mL用β-微量法檢測細小病毒HI抗體,第D7、D14、D35天每組隨機抽取3只采集脾臟,分別用MTT法[13]及ELISA法[14]測定脾淋巴細胞增值及淋巴細胞上清液中IL-2和IL-4的含量。
1.6 數據分析 數據以-X±SE表示,用SPSS軟件進行Duncan多重分析。
2 結果
2.1 HI抗體效價變化 免疫后第7天(D7)和D14蜂膠佐劑組的HI抗體效價明顯高于鋁膠佐劑和油佐劑組,D21~D42油佐劑組高于蜂膠佐劑組,后者高于鋁膠佐劑組(P>0.05);在D28,油佐劑組HI抗體效價顯著高于蜂膠佐劑和鋁膠佐劑組(P<0.05)(表1)。

表1 免疫后HI抗體效價的動態變化 (log2)
2.2 淋巴細胞增殖變化 在D7和D35蜂膠佐劑組協同ConA刺激脾臟T淋巴細胞增殖A570值顯著高于油佐劑和鋁膠佐劑組,油佐劑組顯著高于鋁膠佐劑組(P<0.05)。在D14,蜂膠佐劑組A570值顯著高于油佐劑和鋁膠佐劑組(P<0.05)(表2)。
在D7,蜂膠佐劑組協同LPS刺激脾臟淋巴細胞增殖A570值顯著高于油佐劑和鋁膠佐劑組,鋁膠佐劑組顯著高于油佐劑組(P<0.05)。在D14和D35,蜂膠佐劑組協同刺激源LPS刺激脾臟淋巴細胞增殖A570值最高,且高于油佐劑和鋁膠佐劑組(P>0.05)(表2)。

表2 各組脾臟淋巴細胞增殖的變化(A570值)
2.3 脾淋巴細胞分泌IL-2的變化 在D7,蜂膠佐劑組脾臟T淋巴細胞分泌IL-2含量顯著高于油佐劑和鋁膠佐劑組,油佐劑組顯著高于鋁膠佐劑組(P<0.05)。在D14,蜂膠佐劑組分泌IL-2含量顯著高于油佐劑和鋁膠佐劑組(P<0.05)。在D35,蜂膠佐劑組分泌IL-2含量顯著高于油佐劑和鋁膠佐劑組(P<0.05)(表3)。
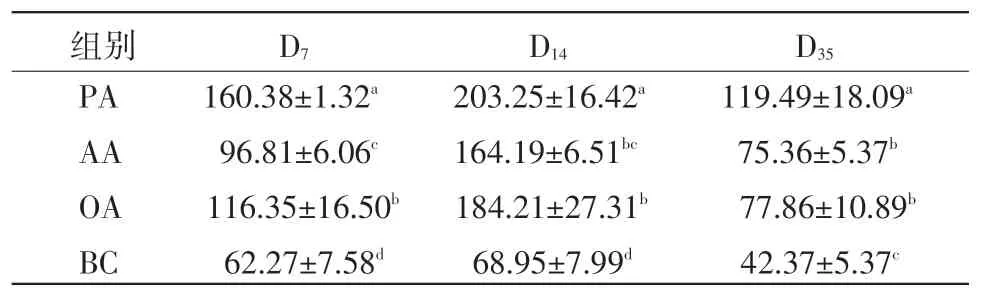
表3 脾淋巴細胞分泌IL-2的變化(μg/mL)
2.4 脾淋巴細胞分泌IL-4的變化 在D7,蜂膠佐劑組和油佐劑組脾臟T淋巴細胞分泌IL-4含量顯著高于鋁膠佐劑組,三佐劑組含量顯著高于對照組(P<0.05)。在D14,蜂膠佐劑組脾臟T淋巴細胞分泌IL-4含量顯著高于油佐劑和鋁膠佐劑組,油佐劑組顯著高于鋁膠佐劑組,三佐劑組含量顯著高于對照組(P<0.05)。在D35,蜂膠佐劑組脾臟T淋巴細胞分泌IL-4含量顯著高于油佐劑和鋁膠佐劑組,三佐劑組含量顯著高于對照組(P<0.05)(表4)。
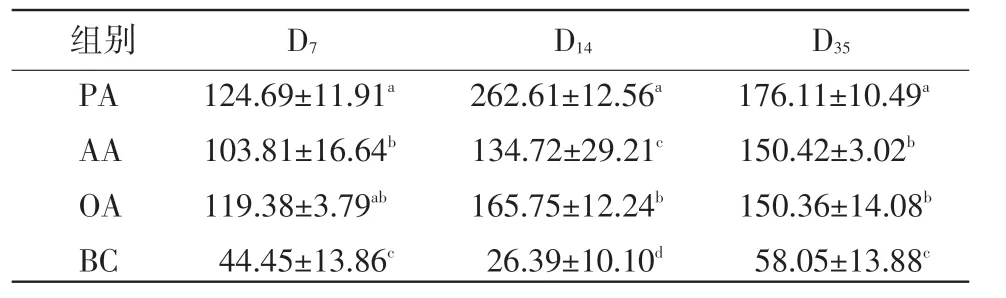
表4 脾淋巴細胞分泌IL-4的變化(μg/mL)
3 討論
3.1 對體液免疫的影響 本試驗結果表明,蜂膠佐劑可使豚鼠對豬細小病毒疫苗取得很好的體液免疫,特別是在免疫早期,血清特異性HI抗體略高于油佐劑組;且在檢測免疫后抗體變化過程中發現,蜂膠佐劑組抗體效價高于鋁膠佐劑組。
潘雪珠等[2]和葉向華等[3]已經證明,豚鼠可以作為豬細小病毒油佐劑疫苗免疫的檢測抗體的校檢動物,本試驗中也發現豚鼠可以對豬細小病毒油佐劑疫苗產生很好的體液免疫,蜂膠佐劑豬細小病毒佐劑疫苗體液免疫水平比油佐劑略差,但優于鋁膠佐劑,因此,可以肯定蜂膠佐劑豬細小病毒疫苗的體液免疫效果。沈志強等首次以蜂膠為佐劑研制的禽霍亂蜂膠菌苗取得了滿意的效果,產生抗體快速、7 d可產生堅強免疫力,證明蜂膠在特異性抗體產生早期效果特別明顯[9]。趙恒章等[10]以油佐劑、蜂膠和鋁膠為佐劑,按一定比例配制成巴氏桿菌的滅活苗,試驗證明,油佐劑滅活苗的保護期和蜂膠滅活苗的保護期相當,但蜂膠滅活苗的抗體水平上升速度比油佐劑苗快且保護率高。
3.2 對細胞免疫的影響 本試驗通過測定淋巴細胞增殖和IL-2、IL-4細胞因子含量,比較了蜂膠佐劑、油佐劑和鋁膠佐劑輔助豬細小病毒滅活疫苗產生免疫應答的影響,結果表明,蜂膠佐劑對疫苗產生細胞免疫水平高于油佐劑。
IL-2為Th1型細胞因子,可以增強機體的抵抗病毒等病原體的能力。IL-4為Th2型細胞因子,可以輔助機體產生特異性抗體。Th1和Th2反應相互協調[11]。程超等[12]報道,將蜂膠黃酮作為佐劑制備EDS-76疫苗,研究其對雛雞血液中T、B淋巴細胞比例的影響,結果表明,蜂膠黃酮作為佐劑可使雛雞血液中的T淋巴細胞的比例極顯著增加,且血清特異性抗體增加明顯。也有研究報道[13],蜂膠的乙醇粗提物單獨或配伍其他中藥成分作為新城疫疫苗佐劑使用,與其油佐劑比較,可以產生相同或略低的新城疫抗體,但用MTT法測定的淋巴細胞增殖效果是蜂膠佐劑優于油佐劑,并且可以提高雛雞抵抗新城疫病毒的感染的能力。Fischer G等[14]報道了用小鼠模型免疫蜂膠的酚類提取物佐劑豬皰疹病毒滅活疫苗的試驗,結果表明,該疫苗可以提高豬皰疹病毒特異性抗體和小鼠脾臟IFN-γ水平。
[1]潘雪珠,粟壽初,張婉華,等.豬細小病毒滅活疫苗的安全性和免疫力[J].上海農業學報,1988,4(1):1-10.
[2]潘雪珠,粟壽初,余晨,等.注射豬細小病毒滅活疫苗的豚鼠的抗體反應[J].上海畜牧獸醫通訊,1987(4):1-4.
[3]葉向陽,張婉華,曹偉明,等.豬細小病毒病油乳劑滅活疫苗研制及應用研究[J].上海畜牧獸醫通訊,2002(6):17-18.
[4] Joo H S,Molitor TW,Leman A D.Antibody responses of guineapigs,rabbits and pigs to inactivated porcine parvovirus vaccine[J].Veterinarymicrobiology,1984,9(1):27-33.
[5]Deyun Wang,Yuanliang Hu,Junling Sun,et al.Comparative study on adjuvanticity of compound Chinese herbalmedicinal ingredients[J].Vaccine,2005,23(28):3704-3708.
[6]殷震,劉景華.動物病毒學[M].2版,北京:科學出版社,1997:1145-1155.
[7]中國獸藥典委員會.中華人民共和國獸藥典[M].2005年版三部,北京:中國農業出版社,附錄30.
[8]中國獸藥典委員會.中華人民共和國獸藥典[M].2005年版三部,北京:中國農業出版社,附錄26.
[9]沈志強,劉吉山,李峰,等.禽霍亂與大腸桿菌病多價蜂膠二聯滅活疫苗的研究[J].中國預防獸醫學報,2004,26(4):290-297.
[10]趙恒章,劉保國,李軍民.地方性雞大腸桿菌多價蜂膠滅活苗的制備及應用[J].甘肅畜牧獸醫,2004,4:5-7.
[11]Segura E and Villadangos JA.Antigen presentation by dendritic cells in vivo[J].Current Opinion in Immunology,2009,21:105-110.
[12]程超,明慶磊.蜂膠乙醇提取物及其作為佐劑對雛雞血液T、B淋巴細胞比例的影響[J].徐州師范大學學報(自然科學版),2002,20(3):61-63.
[13]Zhenhuan Guo,Yuanliang Hu,DeyunWang,etal.Sulfatedmodification can enhance the adjuvanticity of lentinan and improve the immune effect of ND vaccine[J].Vaccine,2009(27):660-665.
[14]Fischer G,Concei??o F R,Leite F P,et al.Immunomodulation produced by a green propolis extract on humoral and cellular responses ofmice immunized with SuHV-1[J].Vaccine,2007,25(7):1250-1256.

