C-myc和HIF-1α蛋白在預測巨塊型宮頸鱗癌新輔助化療療效中的作用
吳均,陳苗苗,周青峰,王穎,朱雪瓊
(溫州醫科大學附屬第二醫院 婦產科,浙江 溫州 325027)
·論 著·
C-myc和HIF-1α蛋白在預測巨塊型宮頸鱗癌新輔助化療療效中的作用
吳均,陳苗苗,周青峰,王穎,朱雪瓊
(溫州醫科大學附屬第二醫院 婦產科,浙江 溫州 325027)
目的:研究C-myc和低氧誘導因子1α(HIF-1α)蛋白在巨塊型宮頸鱗癌新輔助動脈化療前后的變化以及與化療療效的相關性。方法:選取2007年1月-2012年8月在我院因巨塊型(Ib2或IIa2期)宮頸鱗癌行新輔助動脈化療和宮頸癌根治術的患者,共36例,新輔助動脈化療方案均為順鉑、5-氟尿嘧啶加絲裂霉素的聯合化療。采用Western blot法檢測宮頸鱗癌組織中C-myc和HIF-1α蛋白的特異性表達。采用免疫組織化學SP法檢測宮頸鱗癌組織中C-myc和HIF-1α蛋白的細胞定位以及兩種蛋白在化療前后、化療有效組和無效組中的表達差異。結果:①巨塊型宮頸鱗癌新輔助動脈化療的總有效率為52.7%。②C-myc和HIF-1α蛋白在化療后宮頸鱗癌組織中的表達均顯著低于化療前(均P<0.05)。③化療前C-myc和HIF-1α蛋白的表達明顯相關。④化療前宮頸鱗癌組織中C-myc和HIF-1α蛋白的表達在化療有效組中均比化療無效組中高(均P<0.05)。結論:巨塊型宮頸鱗癌組織中C-myc和HIF-1α蛋白的表達可在新輔助動脈化療前輔助預測化療療效。
C-myc;低氧誘導因子1α;宮頸腫瘤;新輔助化療;療效
新輔助動脈化療是在術前或者放療前使用動脈化療,縮小巨塊型宮頸癌局部的體積,以提高隨后的手術切除率,減少淋巴結和血管的微轉移[1]。研究表明,新輔助化療僅對部分巨塊型宮頸癌患者有效,而術前新輔助化療療效好的宮頸癌患者其預后好[2]。尋找在新輔助化療前預測宮頸癌對化療藥物療效的指標,以實現“預見性”的新輔助化療,防止延誤確切的手術或放療時間,將改善巨塊型宮頸癌患者的預后。
雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一種絲氨酸/蘇氨酸蛋白激酶,屬于磷脂酰肌醇3-激酶相關激酶蛋白家族,分子量約為290 kDa,調控著各種細胞的增殖、細胞周期和糖酵解,在多種惡性腫瘤化療耐藥中起了重要的作用[3-5]。在受mTOR調節的眾多下游因子中,Myc家族和低氧誘導因子(hypoxia inducible factor,HIF)與多種惡性腫瘤的發生發展以及化療耐藥的關系尤為密切[6-8]。過度活化的mTOR可以通過低氧誘導因子1α(HIF-1α)所介導的丙酮酸激酶M基因轉錄或是C-myc所介導的丙酮酸激酶M前體RNA(premRNA)的選擇性剪切來上調丙酮酸激酶M2(pyruvate kinase type M2,PKM2)的表達[9]。
我們在前期工作中發現,宮頸鱗癌組織中mTOR和PKM2的表達在新輔助動脈化療后明顯改變,并且與宮頸鱗癌新輔助動脈化療療效相關[10-11],但是宮頸癌新輔助動脈化療與mTOR-C-myc-PKM2通路或與mTOR-HIF-1α-PKM2通路抑或兩者相關尚鮮見報道。本研究采用免疫印跡(Western blot)和免疫組織化學SP法,檢測宮頸鱗癌組織中C-myc和HIF-1α蛋白在化療前后、化療有效組和化療無效組中的表達差異,探討宮頸鱗癌新輔助化療相關的信號通路以及化療前預測化療療效的指標,為提高巨塊型宮頸癌患者的預后提供新思路。
1 資料和方法
1.1 一般資料 選取自2007年1月至2012年8月間在我院就診,并因巨塊型宮頸鱗癌(腫瘤直徑>4 cm)行新輔助動脈化療和宮頸癌根治術的患者,共36例,術前未接受過其他治療。患者年齡25~62歲,中位年齡44歲。根據國際婦產科聯盟婦科腫瘤中的宮頸癌臨床分期,36例患者中Ib2期21例,占58.3%;IIa2期15例,占41.7%。本研究經我院倫理委員會批準,治療前患者均簽署知情同意書。
1.2 納入標準 ①活檢病理報告為宮頸鱗狀細胞癌;②治療前由2位婦科主任醫師三合診均診為Ib2或者IIa2期的宮頸鱗癌;③盆腔MRI檢查宮頸病灶直徑>4 cm;④骨髓造血功能無明顯受損:血白細胞數、血紅蛋白和血小板計數均在正常范圍;⑤無明顯內科合并癥,肝、腎功能和心電圖正常;⑥Karnofsky評分≥80分;⑦患者依從性好,治療前知情同意。
1.3 治療方法 采用Seldinger技術,行雙側子宮動脈插管灌注化療加栓塞。化療方案是以順鉑為主的聯合化療:順鉑50 mg/m2+5-氟尿嘧啶500 mg/m2+絲裂霉素8 mg/m2,單次灌注。根據化療療效分別給予1~2個療程的化療。納入本研究的患者均在化療后14~22 d行宮頸癌根治術。
1.4 化療療效判定 化療后2周時采用影像學檢查,并測量病灶的最大直徑和最大垂直橫徑的乘積變化情況。根據實體瘤的化療療效評估標準評估療效[11],分為化療有效組和化療無效組。化療有效組包括化療后宮頸局部癌灶完全緩解或部分緩解。而化療無效組包括化療后宮頸局部癌灶穩定或進展。
1.5 標本采集 化療前活檢時和手術中切除的宮頸癌組織,甲醛固定,經常規脫水和透明后,石蠟包埋。所取得組織均經蘇木素伊紅染色,確診為宮頸鱗癌組織標本。
1.6 試劑和儀器 鼠抗人單克隆C-myc抗體購自美國Santa Cruz公司,鼠抗人單克隆HIF-1α抗體購自英國Abcam公司,增強化學發光試劑(ECL)購自美國Pierce公司,鼠抗人單克隆GAPDH抗體、辣根過氧化物酶標記山羊抗鼠IgG、RIPA蛋白裂解液均購自上海碧云天生物技術有限公司,SP-9000過氧化物酶標記的鏈霉卵白素染色試劑盒、DAB顯色試劑盒購自北京中杉金橋生物技術有限公司,GS-800掃描儀購自美國Bio-rad公司。
1.7 Western blot法 RIPA蛋白裂解液提取組織中蛋白,BCA法測定蛋白濃度,取50μg蛋白質于8%十二烷基磺酸鈉-聚丙烯酰胺凝膠中電泳分離蛋白,濕轉法將蛋白轉到聚偏氟乙烯膜上,用300 mA恒流轉移目的蛋白(C-myc轉移60 min,HIF-1α轉移100 min)。用含5%脫脂奶粉和Tween-20的三羥甲基氨基甲烷緩沖液于室溫中振蕩封閉2 h。分別加入相應一抗(鼠抗人C-myc抗體,稀釋度1∶200;鼠抗人HIF-1α,稀釋度1∶1 000;鼠抗人GAPDH抗體,稀釋度1∶500)。4 ℃搖床過夜后,分別加入相應二抗(用辣根過氧化物酶標記的山羊抗鼠,稀釋度1∶1 000);在增強化學發光試劑中反應,顯影、定影。膠片由GS-800掃描儀掃描。
1.8 免疫組織化學SP法 按照試劑盒說明書操作,切片脫蠟入水,微波修復后,3% H202阻斷過氧化物酶活性,山羊血清室溫孵育30 min。加相應一抗(鼠抗人單克隆抗體C-myc、HIF-1α,均為1∶200稀釋),4 ℃濕盒孵育過夜。生物素標記二抗孵育30 min,后滴加辣根酶標記鏈霉卵白素工作液孵育15 min,DAB顯色后,蘇木素復染,淡氨水返藍,樹脂封片。以PBS代替一抗作陰性對照,C-myc和HIF-1α均用已知有陽性表達的宮頸癌切片作為陽性對照。
C-myc和HIF-1α陽性染色主要表現為細胞漿呈棕黃色。每張切片隨機選擇10個高倍視野,每個視野觀察100個細胞,分別進行陽性細胞百分率及染色強度的評分,將兩者的乘積進行比較分析。陽性細胞百分率分為:≤5%計0分,6%~24%計1分,25%~49%計2分,50%~74%計3分,≥75%計4分;染色強度分為:無著色計0分,淺黃色計1分,淺棕色計2分,深棕色計3分。
1.9 統計學處理方法 用SPSS 19.0統計學軟件。采用獨立樣本的t檢驗比較化療有效組和化療無效組患者的年齡、腫塊的大小,采用Fisher確切概率法比較2組患者的臨床分期,采用Wilcoxon兩樣本秩和檢驗比較病理分化程度。因為C-myc和HIF-1α蛋白表達的部分數據為非正態分布,因此數據采用M(P25~P75)表示,組間數據的比較采用非參數檢驗。宮頸癌化療前、后組織中兩蛋白表達的變化用配對秩和檢驗進行分析。而兩種蛋白質在化療前宮頸癌組織中的表達在化療有效組與化療無效組之間的差異采用Mann-Whitney U法。化療前、后宮頸癌組織中兩蛋白的相關性采用Spearman相關分析。P<O.05為差異有統計學意義。
2 結果
2.1 新輔助動脈化療的療效 36例巨塊型宮頸癌患者在新輔助動脈化療后19例為化療有效,17例為化療無效,總有效率為52.7%。36例巨塊型宮頸鱗癌患者的臨床特征,見表1。
表1 宮頸鱗癌患者的臨床特征(±s)

表1 宮頸鱗癌患者的臨床特征(±s)
組別例數年齡(歲)臨床分期病理分化程度腫瘤大小(cm)Ib2IIa2高中低化療有效組1946±811841324.1±1.2化療無效組17 44±1010741034.2±1.3
經檢驗,化療有效組和化療無效組患者的年齡、腫塊大小、臨床分期及病理分化程度差異均無統計學意義(均P>0.05)。
2.2 宮頸鱗癌組織中C-myc和HIF-1α蛋白的特異表達 見圖1。
2.3 化療前、后宮頸鱗癌組織中C-myc和HIF-1α蛋白的表達變化 化療前宮頸鱗癌組織中均有C-myc蛋白的表達,化療后有5例宮頸鱗癌組織中未見C-myc蛋白的表達。1例化療前和4例化療后宮頸鱗癌組織中未見HIF-1α蛋白的表達外,其余均可見到HIF-1α蛋白的表達。具體兩種蛋白在化療前后的表達變化見表2、圖2-3。
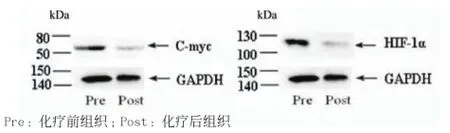
圖1 宮頸中分化鱗癌組織中C-myc和HIF-1α蛋白的特異表達

表2 化療前、后宮頸鱗癌組織中C-myc和HIF-1α蛋白的表達M(P25~P75)
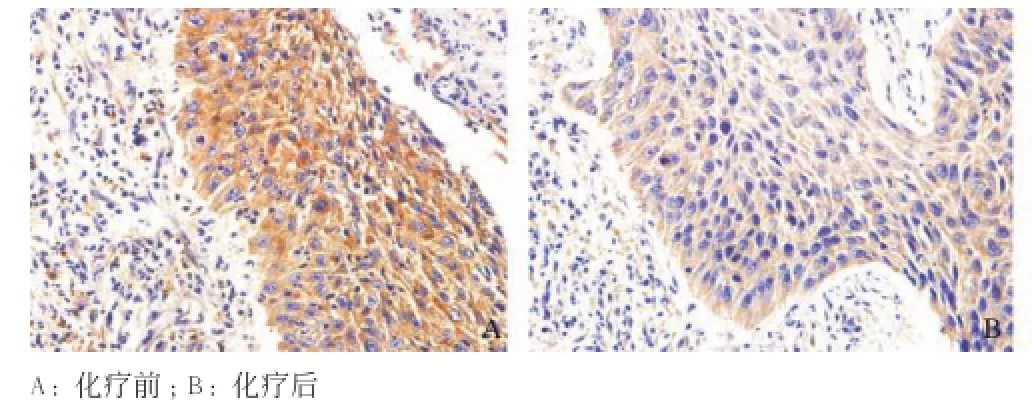
圖2 宮頸鱗癌組織中C-myc在化療前、后的表達變化(SP法,×400)

圖3 宮頸鱗癌組織中HIF-1α在化療前、后的表達變化(SP法,×400)
經配對秩和檢驗,宮頸鱗癌組織中C-myc和HIF-1α蛋白在化療后的表達均明顯下降,低于化療前(Z值分別為2.796,2.929,P<0.01)。
2.3 化療前、后宮頸鱗癌組織中C-myc和HIF-1α蛋白表達的相關性 化療前宮頸鱗癌組織中C-myc和HIF-1α蛋白的表達呈正相關(rs=0.645,P<0.01)。化療后宮頸鱗癌組織中C-myc和HIF-1α蛋白的表達無明顯相關(rs=0.304,P>0.05)。
2.4 化療有效組和化療無效組中C-myc和HIF-1α蛋白在化療前宮頸鱗癌組織中的表達,見表3。

表3 2組C-myc和HIF-1α蛋白在化療前宮頸鱗癌組織中的表達M(P25~P75)
化療前宮頸鱗癌組織中C-myc和HIF-1α蛋白在化療有效組中的表達均顯著高于化療無效組(Z值分別為3.625,4.151,P<0.01)。
3 討論
C-myc是原癌基因,在腫瘤的發生和進展中起了很重要的作用。但其表達與化療療效的相關性在不同腫瘤中報道不一。在對前列腺癌的研究中,C-myc蛋白的表達與泰素帝的耐藥相關[12]。而在對轉移性乳腺癌的研究中,發現C-myc擴增的患者對化療(阿霉素+氟尿嘧啶+環磷酰胺或者甲氨蝶呤+氟尿嘧啶+環磷酰胺)療效優于無C-myc擴增者[13]。Li等[6]對C-myc在宮頸癌篩查中的作用進行研究,采用熒光原位雜交技術檢測宮頸液基細胞中的C-myc基因的擴增,發現宮頸脫落細胞中C-myc基因的過表達用于篩查宮頸癌前病變具有較高的特異性。在最近的研究中,唐金芝等[14]發現,正常宮頸組織、宮頸上皮內瘤變與宮頸癌組間C-myc基因的表達有明顯差異,其陽性率隨著宮頸組織病理級別的增加而逐漸升高。同時發現42例宮頸上皮內瘤變和30例宮頸癌患者在治療后,C-myc基因的表達明顯下降。Yim等[15]將宮頸鱗癌HeLa細胞株和CaSki細胞株經順鉑處理后,應用雙向電泳加質譜技術檢測差異表達的蛋白,發現C-myc蛋白的表達在順鉑作用后明顯下調,并經Western blot法檢測證實。但是,C-myc蛋白的表達與宮頸癌新輔助化療療效的相關性尚鮮見報道。
低氧為許多實體瘤的共同特征。HIF-1α為實體瘤低氧的標志,可上調血管形成、腫瘤侵襲和抗凋亡等相關基因的表達,與惡性腫瘤的發生發展、侵襲性及化療的耐藥相關[8,16]。HIF-1α與宮頸癌治療的研究僅見Ishikawa等[17]1篇報道。通過對38例接受體外照射和低劑量腔內放射治療的IIIb宮頸鱗癌患者進行研究,Ishikawa等[17]發現HIF-1α的強陽性表達與局部腫瘤的控制率無明顯相關性,但與放療后癌癥的復發和遠處轉移關系密切。Nakamura等[16]發現HIF-1α的表達與胃癌的臨床病理特征,包括浸潤的深度、淋巴結的轉移和腫瘤的分期以及生存期均無相關,但其陽性表達與44例接受新輔助5-氟尿嘧啶化療的晚期胃癌患者的耐藥相關。但是,Nakai等[18]卻發現在原發性晚期上皮性卵巢癌中,表達HIF-1α的卵巢癌患者對術后紫杉醇和卡鉑的聯合化療的療效明顯優于不表達HIF-1α的卵巢癌患者,提示HIF-1α的表達與術后紫杉醇和卡鉑聯合化療的療效呈正相關。
本研究發現宮頸鱗癌組織中C-myc和HIF-1α蛋白的表達在新輔助動脈化療后均明顯下降,而且化療前癌組織中C-myc和HIF-1α蛋白的表達呈正相關。表明以順鉑為基礎的聯合動脈化療可能與mTOR-C-myc-PKM2通路及mTOR-HIF-1α-PKM2通路均相關,而且兩條通路間可能存在相互促進作用,但是C-myc和HIF-1α蛋白與順鉑等化療藥物敏感性的關系以及信號通路間如何相互促進等尚待體外宮頸癌細胞系及裸鼠宮頸癌移植瘤等實驗來進一步明確。本研究還發現,化療前早期巨塊型宮頸鱗癌組織中C-myc和HIF-1α蛋白在化療有效組中的表達明顯高于化療無效組,提示化療前宮頸鱗癌組織中C-myc和HIF-1α的高表達與早期巨塊型宮頸鱗癌新輔助動脈化療的療效相關。通過檢測巨塊型宮頸鱗癌組織中C-myc和HIF-1α蛋白的表達可在新輔助動脈化療前輔助預測化療療效,為巨塊型宮頸鱗癌術前的“預見性”化療提供依據。
[1] Kim HS, Sardi JE, Katsumata N, et al. Effcacy of neoadjuvant chemotherapy in patients with FIGO stage IB1 to IIA cervical cancer: an international collaborative meta-analysis [J]. Eur J Surg Oncol, 2013, 39(2): 115-124.
[2] Ye Q, Yuan HX, Chen HL. Responsiveness of neoadjuvant chemotherapy before surgery predicts favorable prognosis for cervical cancer patients: a meta-analysis[J]. J Cancer Res Clin Oncol, 2013, 139(11): 1887-1898.
[3] Honjo S, Ajani JA, Scott AW, et al. Metformin sensitizes chemotherapy by targeting cancer stem cells and the mTOR pathway in esophageal cancer[J]. Int J Oncol, 2014, 45(2): 567-574.
[4] Li S, Li Y, Hu R, et al. The mTOR inhibitor AZD8055 inhibits proliferation and glycolysis in cervical cancer cells [J]. Oncol Lett, 2013, 5(2): 717-721.
[5] Zou Z, Zhang J, Zhang H, et al. 3-Methyladenine can depress drug effux transporters via blocking the PI3K-AKT-mTOR pathway thus sensitizing MDR cancer to chemotherapy[J]. J Drug Target, 2014, 22(9): 839-848.
[6] Li T, Tang L, Bian D, et al. Detection of hTERC and c-MYC genes in cervical epithelial exfoliated cells for cervical cancer screening [J]. Int J Mol Med, 2014, 33(5): 1289-1297.
[7] Liao LM, Sun XY, Liu AW, et al. Low expression of long noncoding XLOC 010588 indicates a poor prognosis and promotes proliferation through upregulation of c-Myc in cervical cancer[J]. Gynecol Oncol, 2014, 133(3): 616-623.
[8] Kasuya K, Tsuchida A, Nagakawa Y, et al. Hypoxia-inducible factor-1α expression and gemcitabine chemotherapy for pancreatic cancer[J]. Oncol Rep, 2011, 26(6): 1399-1406.
[9] Sun Q, Chen X, Ma J, et al. Mammalian target of rapamycin up-regulation of pyruvate kinase isoenzyme type M2 is critical for aerobic glycolysis and tumor growth[J]. Proc Natl Acad Sci USA, 2011, 108(10): 4129-4134.
[10] Zou S, Shen Q, Hua Y, et al. Proteomic identifcation of neoadjuvant chemotherapy-related proteins in bulky stage IBIIA squamous cervical cancer[J]. Reprod Sci, 2013, 20(11): 1356-1364.
[11] 吳均, 陳苗苗, 王穎, 等. mTOR-PKM2信號通路與宮頸鱗癌新輔助動脈化療療效的相關性研究[J]. 浙江醫學, 2014, 36(2): 94-97.
[12] Hatano K, Yamaguchi S, Nimura K, et al. Residual prostate cancer cells after docetaxel therapy increase the tumorigenic potential via constitutive signaling of CXCR4, ERK1/2 and c-Myc[J]. Mol Cancer Res, 2013, 11(9): 1088-1100.
[13] Todorovi?-Rakovi? N, Ne?kovi?-Konstantinovi? Z, Nikoli?-Vukosavljevi? D. C-myc as a predictive marker for chemotherapy in metastatic breast cancer[J]. Clin Exp Med, 2012, 12(4): 217-223.
[14] 唐金芝, 許君艷, 高琨, 等. C-MYC基因在宮頸上皮內瘤變及宮頸癌治療前后的表達及其與HPV的相關性[J]. 廣西醫科大學學報, 2014, 31(1): 86-88.
[15] Yim EK, Lee KH, Kim CJ, et al. Analysis of differential protein expression by cisplatin treatment in cervical carcinoma cells[J]. Int J Gynecol Cancer, 2006, 16(2): 690-697.
[16] Nakamura J, Kitajima Y, Kai K, et al. Hypoxia-inducible factor-1alpha expression predicts the response to 5-fuorouracil-based adjuvant chemotherapy in advanced gastric cancer[J]. Oncol Rep, 2009, 22(4): 693-699.
[17] Ishikawa H, Sakurai H, Hasegawa M, et al. Expression of hypoxic-inducible factor 1alpha predicts metastasis-free survival after radiation therapy alone in stage IIIB cervical squamous cell carcinoma[J]. Int J Radiat Oncol Biol Phys, 2004, 60(2): 513-521.
[18] Nakai H, Watanabe Y, Ueda H, et al. Hypoxia inducible factor 1-alpha expression as a factor predictive of effcacy of taxane/platinum chemotherapy in advanced primary epithelial ovarian cancer[J]. Cancer Lett, 2007, 251(1): 164-167.
(本文編輯:吳健敏)
·消 息·
我校附屬第一醫院入選全國“三級甲等醫院公信力”百強榜單
由健康報社發起的“中國健康服務公信力排行榜”日前發布,我校附屬第一醫院入選“三級甲等醫院公信力”百強榜單。我校黨委副書記、附屬第一醫院院長陳肖鳴入選“中國健康服務業十大風云人物”。
(溫宣)
·論 著·
Objective:To study the change of C-myc and HIF-1α protein expression after neoadjuvant intraarterial chemotherapy and explore the role of C-myc and HIF-1α protein in prediction on the response of neoadjuvant intra-arterial chemotherapy in bulky squamous cervical cancer.Methods:Thirty-six patients with stage Ib2or IIa2squamous cervical cancer who underwent neoadjuvant intra-arterial chemotherapy, combined cisplatin with 5-fuorouracil and mitomycin, and radical hysterectomy between 2007 and 2012 in Wenzhou Medical University were selected. Western blot was used to detect the specifc expression of C-myc and HIF-1α protein. Then, streptavidin peroxidase (SP) immunohistochemical staining was used to detect the cellular localization of C-myc and HIF-1α protein and the difference of the expression of C-myc and HIF-1α protein between before and after neoadjuvant chemotherapy and between chemotherapy-response group and non-response group.Results:①The total effective rate of neoadjuvant intra-arterial chemotherapy in bulky squamous cervical cancer was 52.7%. ②The expression of C-myc and HIF-1α protein in tumor cells after chemotherapy was significantly lower than that before chemotherapy (P<0.05). ③There was positive correlation between the expression of C-myc protein and HIF-1α protein before chemotherapy. ④The expression of C-myc and HIF-1α protein in chemotherapy-response group before chemotherapy was significantly higher than that in non-response group (P<0.05). Conclusion: The expression of C-myc and HIF-1α protein in bulky squamous cervical cancer may be used as a predictor for response to neoadjuvant intra-arterial chemotherapy.
C-myc; HIF-1α; cervical neoplasms; neoadjuvant chemotherapy; response
R737.33
A
1000-2138(2014)12-0859-05
2014-08-19
國家自然科學基金資助項目(30700195)。
吳均(1988-),男,浙江建德人,碩士生。現工作單位:溫嶺市第一人民醫院。
朱雪瓊,教授,主任醫師,博士生導師,Email:zjwzzxq@163.com。
The role of C-myc and HIF-1α protein in the prediction of the response of neoadjuvant intra-arterial chemotherapy in bulky squamous cervical cancer
WU Jun, CHENG Miaomiao, ZHOU Qingfeng, WANG Ying, ZHU Xueqiong. Department of Obstetrics and Gynecology, the Second Affliated Hospital of Wenzhou Medical University, Wenzhou, 325027

