柴油機后處理系統N2O排放特性的試驗研究
唐 韜,張 俊,帥石金,曹東曉
(清華大學,汽車安全與節能國家重點實驗室,北京 100084)
前言
N2O是一種典型的溫室氣體,在大氣中具有極強的穩定性,其溫室效應是CO2的300多倍[1],并且對臭氧層具有強烈的破壞作用。柴油機原機排放中N2O的含量很低,長期以來N2O排放并未引起人們的重視。隨著排放法規不斷加嚴,柴油機往往須要使用排放后處理技術,氧化催化器(diesel oxidation catalyst, DOC)、顆粒捕集器(diesel particulate filter, DPF)、選擇性催化還原(selective catalytic reduction, SCR)、氨氣氧化催化器(ammonia slip catalysts, ASC)等技術得到廣泛應用。柴油機后處理裝置會顯著增加N2O排放[2],其主要來源包括:(1)DPF主動再生時,缸內或排氣管內噴入的柴油與排氣中的NOx在DOC的貴金屬催化劑表面發生副反應生成N2O[3];(2)SCR催化器中,較低溫度時SCR催化劑表面生成NH4NO3,NH4NO3再分解生成部分N2O,在高溫條件下,NH3在SCR中被氧化也會生成N2O[4];(3)SCR催化器泄露的NH3在ASC中被氧化時生成N2O[5]。本文中對一臺重型柴油機的后處理系統進行臺架試驗,研究了DPF主動再生、SCR催化反應和氨氧化過程中的N2O排放特性。
1 試驗裝置與方法
1.1 試驗裝置
試驗臺架主要包括柴油機、測功機、排氣管柴油噴射裝置、DOC、DPF、尿素噴射系統、SCR催化器、ASC和排放測試與數據采集系統等。試驗發動機為一臺采用SCR技術滿足國Ⅳ排放標準的6缸柴油機,排量為7L,額定功率199kW。試驗采用K型熱電偶測量排氣溫度,使用AVL FTIR(傅里葉變換紅外光譜分析儀)測試排氣組分,主要包括NO、NO2、N2O和NH3等。使用的DOC、DPF、SCR和ASC的主要參數如表1所示。試驗用尿素水溶液為質量濃度32.5%的標準車用尿素水溶液,柴油為滿足京Ⅴ標準的市售柴油,硫含量低于10mg/kg。
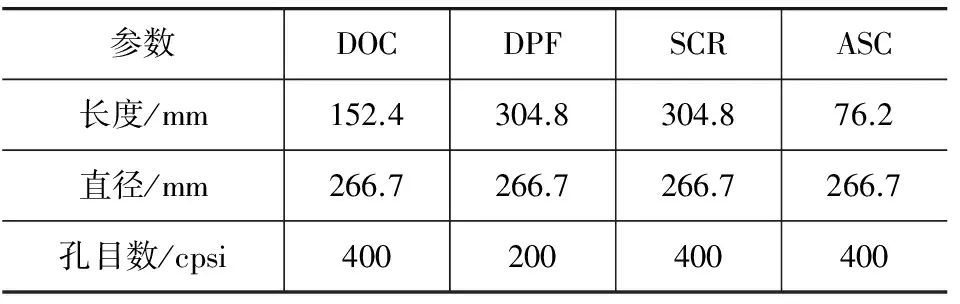
表1 試驗用催化劑的主要參數
1.2 試驗方法
試驗中,通過調節柴油機工況改變排氣溫度和空速(SV)。DPF需要主動再生時,通過空氣輔助的方法將柴油噴入排氣管中,測試不同溫度、空速和柴油噴射速率條件下DOC后N2O的生成規律。研究SCR系統的N2O生成規律時,選用相同規格和封裝條件的釩基SCR、Cu沸石SCR、Fe沸石SCR等不同類型SCR催化劑進行比較,并研究在SCR上游是否安裝DOC-DPF對N2O生成量的影響。
研究ASC中N2O的生成規律試驗中,為了實現SCR下游的氨泄漏,將尿素水溶液噴射速率設定為完全反應所需理論值的1.2倍,即氨氮比(NSR)為1.2,測試不同工況下ASC氧化NH3后生成N2O的規律,此外,選擇N2O生成量較大的工況點試驗研究了氨氮比對N2O生成量的影響。
2 試驗結果與分析
2.1 DPF主動再生時N2O的生成特性
試驗研究了不同柴油噴射速率對DOC后N2O生成量的影響。試驗中DOC入口溫度保持在265℃,而DOC出口溫度則隨著柴油噴射速率的變化而改變。不同DOC空速和出口溫度下N2O的生成特性,如圖1所示。由圖可見,DOC中N2O生成量隨DOC出口溫度的升高呈先增加后減少的趨勢,在DOC出口溫度為350~400℃時,N2O的生成量達到最高。在保持DOC出口溫度不變時,隨著空速的增大,N2O的生成量降低。
DPF主動再生中,DOC中大部分HC被O2氧化,但同時排氣中的部分NOx在貴金屬催化劑表面被HC還原,生成副反應產物N2O。當排氣溫度低于300℃時,HC催化還原NOx的活性較低,因而N2O生成量較少;當溫度較高時,HC主要被O2氧化,生成N2O的選擇性較低,從而也降低了N2O的生成量。生成N2O的溫度窗口受到排氣組分和DOC催化劑成分的影響[6]。隨著空速的增大,HC與NOx的反應時間縮短,N2O生成量降低[3]。
為進一步研究N2O在DOC中的生成規律,試驗考察了60 000/h空速、不同DOC入口溫度下,柴油噴射速率對N2O濃度的影響,結果如圖2所示。
在該空速條件下,柴油噴射速率分別為68和34g/min時,DOC后的排氣溫度相比于DOC前分別可升高約200和100℃。兩種噴射速率條件下,由于柴油機工況點相同,DOC入口處溫度和NOx濃度基本一致,柴油噴射速率為68g/min時DOC出口溫度較高。根據圖1的試驗結果,DOC出口溫度高于350~400℃這一溫度范圍后,隨著溫度進一步升高時DOC后N2O濃度降低,因此,雖然柴油噴射速率為68g/min時DOC中HC濃度更高,但生成的N2O的濃度較低,并且兩種噴射速率下,N2O的濃度均隨DOC入口溫度的升高而降低。
2.2 SCR催化劑中N2O的生成特性
首先針對柴油機后只安裝SCR系統時N2O的生成規律進行研究。試驗中SCR的空速為30 000/h,不同類型SCR催化劑的N2O生成特性如圖3所示。由圖可見,在相同空速和溫度條件下,Cu沸石催化劑生成的N2O最多,Cu-Fe復合沸石催化劑次之,而釩基和Fe沸石催化劑N2O的排放與原機基本相同,幾乎為零。Cu沸石催化劑和Cu-Fe復合催化劑的N2O生成量隨催化器平均溫度的變化表現出相同的變化規律,在催化器平均溫度為180~320℃范圍內,兩者的N2O生成量均隨催化器平均溫度的升高先增加后減少,在250℃附近達到最大,而當SCR催化器的平均溫度高于320℃后,兩種催化劑的N2O生成量均又隨溫度的升高而增大。
在催化器平均溫度為180~320℃時,N2O主要是SCR催化劑表面形成的NH4NO3的分解產物。在該溫度范圍內,當溫度較低時,NH4NO3的分解速率較慢,N2O的生成量較少,當溫度過高時,難以在催化劑表面形成NH4NO3,從而N2O的生成量較低。當催化器的平均溫度高于320℃時,SCR中的N2O主要是由于NH3被O2或NO2氧化而生成,溫度越高,N2O生成速率越快[3]。
在ETC循環中,Fe沸石SCR的N2O排放很低,而Cu沸石SCR下游N2O排放明顯較高,N2O濃度峰值達18×10-6,循環平均濃度為5×10-6。
當SCR系統上游安裝了DPF系統后,進入SCR催化器的NO2/NOx比例會發生顯著變化,進而對SCR系統的N2O生成量產生影響。試驗測試了DOC-DPF-SCR系統下游N2O的排放,并與只采用SCR系統時的結果進行比較,試驗中采用Fe沸石SCR催化劑,SCR的空速為30 000/h,試驗結果如圖4所示。由圖可見,當NO2/NOx大于0.5時,SCR催化器中N2O的生成量快速增加。這是由于此時進入SCR催化器中的NO2除參與快速SCR反應外還有剩余,這部分NO2參與SCR反應時N2O是主要中間產物[7],因此容易在SCR下游產生N2O排放。為降低SCR系統產生的N2O排放,應注意控制SCR入口處NO2/NOx不超過0.5。
2.3 ASC中N2O的生成特性
試驗研究了SCR空速為30 000/h、不同排氣溫度下,ASC催化器中N2O的生成特性,結果如圖5所示。由圖可見,ASC催化器在低溫下生成了大量的N2O,明顯高于2.1節和2.2節中DOC和SCR造成的N2O生成量。ASC催化器后的N2O濃度隨著催化器平均溫度的升高呈現出先增后減的趨勢,在230℃時出現峰值。一般認為,NH3在ASC中被氧化的過程中,會生成一些諸如NHx(x=0,1,2,3)、O和NO之類的自由基,吸附在催化劑的貴金屬表面,在適當條件下,N會與NO反應生成N2O[8]。由于貴金屬催化劑的存在,NH3氧化生成N2O所需的溫度大大降低,在低溫下,有較多的NH3被氧化為N2O,而當溫度較高時,NH3主要被氧化為N2,從而N2O生成量大大減少。
為了考察NH3濃度對ASC中N2O生成量的影響,試驗研究了SCR空速30 000/h、排氣溫度230℃時,氨氮比不同時N2O的生成規律,結果如圖6所示。由圖可見,在該工況條件下,尿素噴射后SCR下游出現一定量的氨泄漏。隨著尿素噴射速率的增加,ASC催化器入口處NH3濃度也逐漸上升,ASC下游生成的N2O也隨之增加。但當尿素噴射過量后,ASC后N2O的濃度上升緩慢,這可能是由于NH3被氧化生成N2O的過程中需要NOx的參與,ASC入口處的NOx濃度限制了N2O的生成量。
3 結論
(1)柴油機使用DOC、DPF、SCR、ASC等后處理技術后,會產生明顯的N2O排放,應將其作為一種重要污染物進行研究和控制。
(2)DPF主動再生時,柴油在DOC中不完全氧化產生的HC會與排氣中的NOx在貴金屬催化劑表面發生副反應生成N2O,且N2O生成量隨DOC出口溫度的升高呈現先增后減的趨勢,試驗所用DOC在出口溫度為350~400℃時,N2O生成量達到最大。
(3)與Fe沸石和釩基SCR催化劑相比,Cu沸石催化劑更易生成N2O。當SCR入口處NO2/NOx大于0.5時,SCR催化器的N2O排放迅速增加。
(4)SCR催化劑后泄漏的氨氣在ASC中被氧化時會生成N2O,排氣溫度在200~250℃時N2O生成量較大,并隨SCR下游氨泄漏的增加而增大。
[1] Hu Z, Lee J W, Chandran K, et al. Nitrous Oxide (N2O) Emission from Aquaculture: A Review[J]. Environmental Science & Technology, 2012, 46(12): 6470-6480.
[2] Graham L A, Rideout G, Rosenblatt D, et al. Greenhouse Gas Emissions from Heavy-duty Vehicles[J]. Atmospheric Environment, 2008, 42(19): 4665-4681.
[3] Kamasamudram K, Henry C, Currier N, et al. N2O Formation and Mitigation in Diesel Aftertreatment Systems[C]. SAE Paper 2012-01-1085.
[4] Suzuki H, Ishii H. Analysis of Emission and Formation Characteristics of Nitrous Oxide (N2O) Under Urea SCR[J]. Transactions of Society of Automotive Engineers of Japan, 2009, 40(4):991-996.
[5] Gil E S. Evaluation of Ammonia Slip Catalysts[D]. Master’s Thesis of Chalmers University of Technology, 2013.
[6] Glover L, Douglas R, McCullough G, et al. Performance Characterisation of a Range of Diesel Oxidation Catalysts: Effect of Pt∶Pd Ratio on Light off Behaviour and Nitrogen Species Formation[C].SAE Paper 2011-24-0193.
[7] Iwasaki M, Shinjoh H. A Comparative Study of “Standard”, “Fast” and “NO2” SCR Reactions over Fe/Zeolite Catalyst[J]. Applied Catalysis A: General, 2010, 390(1-2):71-77.
[8] Kamasamudram K, Yezerets A, Chen X, et al. New Insights into Reaction Mechanism of Selective Catalytic Ammonia Oxidation Technology for Diesel Aftertreatment Applications[C].SAE Paper 2011-01-1314.

