不同劑量右美托咪定對全身麻醉蘇醒期應激反應的影響
于鐵莉,岳文慧△,王金城,李 艷,李汝泓,張曉俠,王志學
(1.承德醫學院附屬醫院麻醉科,河北承德 067000;2.河北醫科大學第三醫院麻醉科,石家莊 050051)
鹽酸右美托咪定是一種新型、高選擇性的α2腎上腺素能受體激動劑,具有鎮痛、鎮靜和抑制交感活性等作用[1]。對呼吸抑制作用小,能減輕應激反應,減少全身麻醉后的術后并發癥[2]。氣管拔管是全身麻醉過程中應激反應較強的時期,可造成患者血壓升高,心率加快,嚴重者甚至發生心肌梗死或心律失常。因此全身麻醉蘇醒期的平穩對患者至關重要,也是麻醉醫師的管理目標。本研究通過比較全身麻醉期間持續應用不同劑量的鹽酸右美托咪定,觀察拔管期血流動力學及應激反應的變化,尋找其在臨床應用中合理的量效關系,為臨床應用提供一定的依據。
1 資料與方法
1.1一般資料 本研究所有病例均獲得了本院倫理委員會和患者本人的同意。選擇擇期全身麻醉下行胃癌根治術患者90例,ASA分級為Ⅰ~Ⅱ級,年齡40~65歲,體質量45~80 kg,體質量指數(BMI)<30 kg/m2。心肺功能均正常,無神經及內分泌系統疾病,無電解質紊亂。分為3組,每組各30例。3組患者的性別、年齡、體質量及手術時間差異無統計學意義(P>0.05)。見表1。

表1 3組患者的一般情況
1.2方法
1.2.1麻醉方法 所有患者均常規禁飲食,進入手術室后開放靜脈通路,監測心電圖(ECG)、心率(HP)與血氧飽和度(SpO2)。局部麻醉下行橈動脈穿刺,建立有創血壓監測。靜脈注射鹽酸戊乙奎醚0.5~1.0 mg。將200 μg /2 mL鹽酸右美托咪定用0.9%生理鹽水稀釋到50 mL(4 μg/mL)。中劑量組(D1組)誘導前10 min內緩慢泵入右美托咪定負荷劑量0.5 μg/kg,術中以0.5 μg·kg-1·h-1維持泵入;高劑量組(D2組)誘導前10 min內緩慢泵入右美托咪定負荷劑量0.8 μg/kg,術中以0.8 μg·kg-1·h-1維持泵入;對照組(C組),誘導前及術中均給予等量的生理鹽水。3組均持續輸注至縫皮前。在給予右美托咪定負荷劑量后開始誘導,3組患者麻醉誘導用藥均為咪達唑侖0.1 mg/kg,順苯磺酸阿曲庫胺0.15 mg/kg,芬太尼3~5 μg/kg,丙泊酚2 mg/kg。誘導后行氣管內插管,要求一次成功,排除困難插管患者。然后進行機械通氣,調整通氣參數:潮氣量8~10 mL/kg,頻率10~12次/min,維持呼氣末二氧化碳分壓(PETCO2)35~40 mm Hg,吸呼比(I∶E)1∶1.5,呼氣末正壓通氣(PEEP)為0。術中以2%~3%七氟醚維持,順式阿曲庫銨按需給藥,并根據術中監測情況給予芬太尼1~3 μg/kg,手術結束前30 min,并不再追加任何靜脈麻醉藥,縫皮前停止泵入右美托咪定及吸入藥。
1.2.2監測指標 記錄3組患者的手術結束時(T1)、拔管后即刻(T2)、拔管后5 min(T3)各時點HR、收縮壓(SBP)、舒張壓(DBP)、平均動脈壓(MAP),并抽取各時點動脈血測量血漿皮質醇(Cor)和血糖(Glu)水平。記錄拔管時間和不良反應情況,如呼吸抑制、高血壓、低血壓、HR加快、心動過緩、寒顫等。
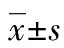
2 結 果
2.13組患者血流動力學變化 組間比較:在T1與T3時刻3組患者HR、SBP、DBP、MAP比較差異無統計學意義(P>0.05);在T2時刻C組患者的HR、SBP、DBP、MAP明顯高于D1組和D2組(P<0.05),D1組與D2組相比差異無統計學意義(P>0.05)。組內比較:C組患者的HR、SBP、DBP、MAP在T2時刻,明顯高于T1和T3時刻(P<0.05);D1與D2組各時點HR、SBP、DBP、MAP變化不大(P>0.05)。見表2。
2.2Cor與Glu濃度變化 3組患者的Cor與Glu濃度在T1~T3時刻均呈現一致增加。組間比較:在T3時點C組的Cor與Glu濃度均明顯高于D1、D2組,差異有統計學意義(P<0.05);D1和D2組雖有升高,但兩組間變化差異無統計學意義(P>0.05)。組內比較:各組在T3時點Cor、Glu濃度均升高,與T1時刻比差異有統計學意義(P<0.05)。見表3。
2.3拔管時間的比較 3組患者拔管時間比較,C組(5.10±3.12)min與D1組(5.50±3.14)min之間差異無統計學意義(P>0.05);C組和D1組短于D2組(8.01±2.02)min,差異有統計學意義(P<0.05)。
2.4不良反應發生情況 3組患者在麻醉清醒期均未發生躁動,高血壓與HR加快的發生率C組明顯高于D1和D2組(P<0.05);D2組出現心動過緩與低血壓與D1組相比有增多的趨勢,但兩組間比較差異無統計學意義(P>0.05)。見表4。

表2 3組患者蘇醒期血壓、HR的變化
a:P<0.05,與D1、D2組比較。

表3 3組患者蘇醒期Cor及Glu的變化
a:P<0.05,與D1、D2組比較;b:P<0.05,組內比較。

表4 3組患者的不良反應情況
a:P<0.05,與 D1、D2組比較。
3 討 論
右美托咪定是高選擇性的α2腎上腺素能受體激動藥,具有抑制交感活性,鎮痛作用強,可控性好,不抑制呼吸等優點。能夠維持圍術期心血管系統的穩定性,減輕應激反應[3],同時降低全身麻醉藥的用量,這在大量的臨床試驗中已經得到證實[4-5]。本研究在此基礎上進一步比較了能夠有效抑制全身麻醉拔管引起的應激反應的用藥劑量。
在全身麻醉蘇醒期,由于麻醉減淺,手術切口的疼痛以及吸痰、氣管拔管等氣道內刺激,會導致患者交感神經系統的過度興奮,引起一些應激激素的分泌[6],如Cor、去甲腎上腺素、腎上腺素和β內啡肽等釋放。Cor是反映機體應激水平的一個較敏感指標,有時用來專指“應激激素”。血漿Cor濃度與Glu水平也有著密切的相關性,隨著Cor濃度的迅速升高,可直接和間接升高Glu,而高Glu也是影響預后轉歸的重要指標[7]。因此,本研究選擇了血漿Cor與Glu濃度來判斷不同劑量右美托咪定抑制應激反應的程度,尋找達到平穩麻醉的合理劑量。
右美托咪定作為麻醉的輔助用藥,能夠有效的抑制手術和麻醉引起的交感神經興奮,避免術中血流動力學的劇烈波動,減少心血管等不良事件的發生[8]。在本研究中,3組患者的血漿Cor及Glu濃度在整個過程中均呈現一致增加,但在拔管后5 min C組的Cor與Clu濃度均明顯高于D1、D2組,而D1、D2組雖有升高,但兩組間差異無統計學意義(P>0.05)。這說明3種方法均不能完全抑制應激反應的發生,但應用右美托咪定組的應激反應較輕。在血流動力學波動上,C組患者在蘇醒期波動較大,組內比較血壓和HR差異有統計學意義(P<0.05),而D1、D2組血壓和HR在各時點變化不明顯(P>0.05);組間比較發現:對照組在各時點血壓和HR變化均較D1和D2組明顯,尤其在插管畢即刻血流動力學變化差異有統計學意義(P<0.05)。這說明右美托咪定能較好地維持心血管系統的穩定性。
本研究中,3組患者的拔管時間D2組明顯長于其他兩組(P<0.05);D1組和C組之間差異無統計學意義(P>0.05)。說明隨著右美托咪定劑量的加大,呼吸恢復時間會延長,拔管時間明顯延長。有研究證明[9],應用較大劑量的右美托咪定產生明顯鎮靜時,可輕微減少分鐘通氣量,但仍然不會出現動脈血氧或pH的變化,而且對高碳酸血癥的興奮性通氣反應性始終存在。而隨右美托咪定血藥濃度增加,呼吸頻率會相應增加,從14 次/min增至25 次/min。本研究中D2組拔管時間延長,可能與增加右美托咪定劑量而引起分鐘通氣量減少有關。不良反應上C組較D1、D2組多,尤其是高血壓和HR加快,差異有統計學意義(P<0.05);D2組不良反應比D1組有增多趨勢,且拔管時間延長。所以認為0.5 μg·kg-1·h-1的右美托咪定更適于臨床應用。
綜上所述,中等劑量的右美托咪定能夠安全有效的維持患者全身麻醉蘇醒期的血流動力學穩定性,較好地抑制全身麻醉拔管引起的應激反應。
[1]Menda F,Kóner O,Sayin M,et al.Dexmedetomidine as an adjunct to anesthetic induction to attenuate hemodynamic response to endotracheal intubation in patients undergoing fast-track CABG[J].Ann Card Anaesth,2010,13(1):16-21.
[2]吳新民,許幸,王俊科,等.靜脈注射右美托咪定輔助全身麻醉的有效性和安全性[J].中華麻醉學雜志,2009,27(9):773-776.
[3]Yildiz M,Tavlan A,Tuncer S,et al.Effect of dexmedetomidine on haemodynamic responses to laryngoscopy and intubation:perioperative haemodynamics and anaesthetic requirements[J].Drugs R D,2006,7(1):43-52.
[4]Shukry M,Kennedy K.Dexmedetomidine as a total intravenous anesthetic in infants[J].Paediatr Anaesth,2007,17(6):581-583.
[5]Anschel DJ,Aherne A,Soto RG,et al.Successful intraoperative spinal cord monitoring during scoliosis surgery using a total intravenous anesthetic regimen including dexmedetomidine[J].J Clin Neurophysiol,2008,25(1):56-61.
[6]Talke P,Chen R,Thomas B,et al.The hemodynamic and adrenergic effects of perioperative dexmedetomidine infusion after vascular surgery[J].Anesth Analg,2000,90(4):834-839.
[7]Mccowen KC,Malhotra A,Bistrian BR.Stress-induced hyperglycemia[J].Crit Care Clin,2001,17(1):107-124.
[8]Wijeysundera DN,Naik JS,Beattie WS.Alpha-2 adrenergic agonists to prevent perioperative cardiovascular complications:a meta-analysis[J].Am J Med,2003,114(9):742-752.
[9]Ebert TJ,Hall JE,Barney JA,et al.The effects of increasing plasma concentrations of dexmedetomidine in humans[J].Anesthesiology,2000,93(2):382-394.

