IL-10基因多態性與幽門螺桿菌相關胃癌易感性的關系*
吳紹燕,任 磊△,王永紅,羅 蓉,向 瑜
(重慶醫科大學附屬第一醫院:1.健康體檢部;2.檢驗科 400016)
幽門螺桿菌感染是慢性活動性胃炎、消化性潰瘍、淋巴瘤和胃癌的主要致病因素。自澳大利亞學者巴里·馬歇爾和羅賓·沃倫發現并證明幽門螺桿菌感染胃部會導致胃炎、胃潰瘍、十二指腸潰瘍和胃淋巴瘤甚至胃癌以來,幽門螺桿菌掀起了全世界的研究熱潮。1994年WHO將幽門螺桿菌列為第1類高危致惡變因子,幽門螺桿菌具有極強的傳染性,人是幽門螺桿菌的惟一傳染源[1]。大量研究表明,超過90%的十二指腸潰瘍和80%左右的胃潰瘍,都是由幽門螺桿菌感染導致的,在我國胃癌的死亡率占所有惡性腫瘤的23.02%[2]。絕大多數幽門螺桿菌感染者不會發展成為消化性潰瘍和胃癌,這與感染菌株的型別、宿主基因型的差異及所暴露的環境因素有關。IL-10是重要的抗炎細胞因子,在胃癌患者中IL-10的表達量減少[3]。在人群中,IL-10基因型等遺傳因素會影響幽門螺桿菌感染者發展成為胃癌的危險性。
IL-10基因在啟動子區-1082 G/A、-819 C/T和-592 C/A存在基因多態性[4]。本研究從宿主的角度討論幽門螺桿菌感染后IL-10基因型與胃癌易感性的關系,旨在尋找胃癌發生的易感基因型,為胃癌的預防及治療提供新思路。
1 資料與方法
1.1一般資料 選取本院2010~2013年住院患者中胃癌且伴有幽門螺桿菌感染者作為胃癌組(n=100),同時選取本院2010~2013年體檢者中的幽門螺桿菌感染者作為相應的對照組(n=140),與志愿者簽署知情同意書,同時取得本院倫理委員會同意。胃癌組:男39例,女61例,年齡(47.02±14.48)歲;所有患者均行胃鏡檢查,胃癌的診斷均通過組織病理學確診。對照組:男68例,女72例,年齡(45.69±16.19)歲,無胃潰瘍及胃癌的病史。所有研究對象均為漢族,相互間無血緣關系。
1.2材料 胃幽門螺桿菌抗體檢測試劑盒(廣州健倫生物科技有限公司);快速檢測試紙(北京北瑞達醫藥科技有限公司);DNA片段長度標準DL2000和限制性內切酶RsaⅠ(大連寶生物公司);IL-10-592引物(上海英駿生物技術有限公司)。
1.3方法
1.3.1幽門螺桿菌感染的檢測 胃癌組采取快速檢測試紙(尿素酶試紙片)法,對照組采取C13呼氣試驗進行檢測;上述兩組研究者均提取血清,并采用膠體金技術定性檢測。
1.3.2細胞因子基因多態性檢測
1.3.2.1DNA模板的制備 取所有受試者靜脈血3 mL,EDTA-Na2抗凝,用改良碘化鈉法[5]提取白細胞DNA,在-20 ℃條件下保存。
1.3.2.2引物的設計 設計檢測IL-10-592的引物,正向引物:5′-CCT AGG TCA CAG TGA CGT GG-3′,反向引物:5′-GGT GAG CAC TAC CTG ACT AGC-3′。
1.3.2.3限制性片段長度多態性PCR(PCR-RFLP)的反應條件 PCR反應體系中包括10 μL Premix Taq (dNTP,Taq DNA聚合酶,Mg2+),4 μL DNA模板,引物5 pmol,加去離子水至20 μL[6]。檢測IL-10-592基因的PCR條件:94 ℃ 2 min;94 ℃ 30 s,60 ℃ 45 s,72 ℃ 1 min,35 個循環。
1.3.2.4酶切產物檢測及分析 PCR擴增產物由限制性內切酶在37 ℃水浴箱進行酶切,酶切產物在3%瓊脂糖凝膠電泳分離,Goldview染色后用凝膠成像儀進行觀察,同時分析DNA條帶[6]。
1.4統計學處理 采用SPSS17.0統計軟件進行統計分析。各基因型以及等位基因頻率用頻數計算,然后通過H-W遺傳平衡定律進行檢驗。胃癌組與對照組之間的比較用χ2檢驗。各基因型發生胃癌和胃潰瘍的危險性用優勢比(OR)以及95%CI來表示,以P<0.05表示差異有統計學意義。
2 結 果
2.1基因多態性的檢測結果IL-10-592 PCR產物通過限制性內切酶RsaⅠ酶切后進行電泳分型,其基因型分別為:A/A型 236 bp 和176 bp,C/C型412 bp,A/C型412、236、176 bp,見圖1。
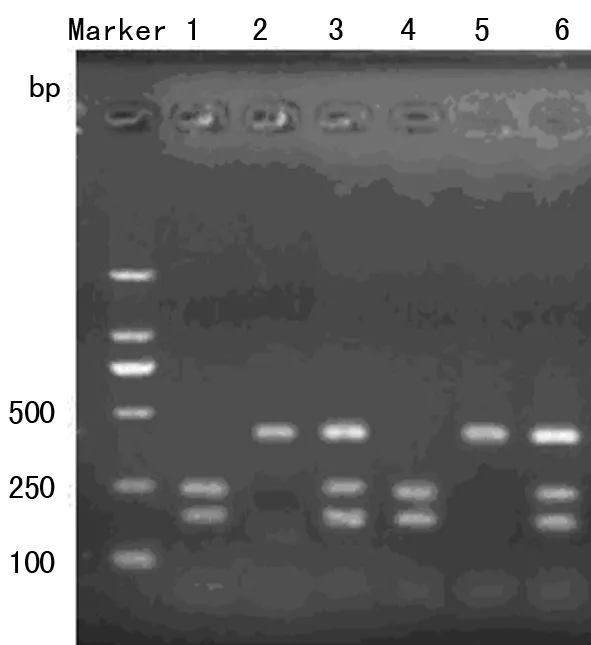
1、4:IL-10-592A/A型;2、5:IL-10-592C/C型;3、6:IL-10-592A/C型;Marker:DNA分子標記物。
圖1IL-10-592基因多態性的檢測結果
2.2各基因型分布頻率χ2檢驗表明,3種基因型以及等位基因頻率均符合H-W遺傳平衡,且具有群代表性。在胃癌組中IL-10-592的各基因型的頻率(A/A型26%,A/C型40%,C/C型34%)與對照組(A/A型10%,A/C型33%,C/C型 57%)比較,分布差異有統計學意義(χ2=16.36,P<0.01)。見表1。

表1 各基因型分布頻率[n(%)]
2.3IL-10-592各基因型胃癌發生的危險性分析 本研究中,應變量Y表示是否患病以及患何種疾病:對照以Y=0 表示,胃癌用Y=1來表示;IL-10-592的基因型以自變量X1表示:C/C型用X1=1表示,A/C型用X1=2表示,A/A型用X1=3表示;建立Logistic回歸模型,分析IL-10-592 各基因型發生胃癌的危險性。與攜帶IL-10-592C/C者比較,攜帶IL-10-592A/A者發生胃癌的危險性為OR=4.37(95%CI:2.04~9.38),差異有統計學意義(P<0.01)。攜帶IL-10-592A/C者發生胃癌的危險性為OR=2.05 (95%CI:1.14~3.67),差異無統計學意義(P>0.05)。
3 討 論
幽門螺桿菌能夠促使胃黏膜上的炎性細胞產生多種細胞因子,從而導致胃、十二指腸的炎癥加重,引起黏膜損傷,胃酸分泌異常。目前胃癌的發病機制并未完全闡明,Toller等[7]發現幽門螺桿菌使胃黏膜細胞發生致死性損傷(即DNA雙鏈斷鏈),與胃癌的發生相關。目前研究表明在幽門螺桿菌引起的胃癌中,幽門螺桿菌感染、遺傳因素、環境因素在這個過程中均起到了相關的作用。宿主遺傳因素,包括基因多態性、HLA基因型等可能影響到幽門螺桿菌相關性胃、十二指腸疾病的易感性。隨著基因組學的進步,基因組不穩定性在胃癌中的作用日益顯現,包括基因的缺失、癌基因的激活和抑癌基因功能的喪失等[8]。近年來細胞因子的基因多態性對幽門螺桿菌感染的影響已成為研究的熱點。IL-10是參與抗炎重要的細胞因子,它的表達量減少會促使IL-1、TNF-α等促炎因子的表達增加,IL-1、TNF-α等促炎因子能夠抑制胃酸的分泌,有利于幽門螺桿菌在胃黏膜內定植,從而導致胃、十二指腸疾病的發生[9]。
基因多態性可表現為單核苷酸多態性(SNP),不同物種、個體基因組DNA序列同一位置上的單個核苷酸存在差別的現象。有這種差別的基因座、DNA序列等可作為基因組作圖的標志,其中有些SNP可能與疾病有關,尋找這些特定的SNP是發現相關疾病易感基因的重要途徑[10]。IL-10的基因多態性與幽門螺桿菌感染導致胃癌的關系還未完全明確。El-Omar等[11]對賁門癌和非賁門癌患者進行IL-10等細胞因子基因多態性的研究中發現,IL-10的低表達,最終導致了胃癌的發生。與攜帶IL-10-592C/C者比較,攜帶IL-10-592A/A者發生胃癌的危險性為OR=4.37(95%CI:2.04~9.38),在胃癌組中A等位基因頻率高于對照組,提示IL-10基因多態性與幽門螺桿菌相關的胃癌相關[12],IL-10-592是幽門螺桿菌相關的胃癌的易感基因。攜帶IL-10-592A/A基因型患者表達IL-10減少,IL-10的抗炎作用減弱,IL-1等促炎因子表達增加,加重了胃黏膜的炎性反應,也利于幽門螺桿菌在胃內的定植,從而為胃癌的發生提供了有利條件[13]。Lee等[14]對胃癌、消化性潰瘍患者進行研究,研究中發現IL-10-1082、-592兩個位點基因型在胃癌、消化性潰瘍、對照組之間并無顯著性差異,與幽門螺桿菌感染程度、胃癌發生的部位、胃癌家族史之間無相關性,認為IL-10-1082、-592基因多態性與韓國人群發生胃癌無關。本研究的結果與其他研究結果之間的差異,原因可能是研究對象的遺傳背景不同。
[1]Pounder RE,Ng D.The prevalence of Helicobacter Pylori infection in different countries[J].Aliment Pharmacol Ther,1995,9(2):33-39.
[2]韓鋒產,閻小君,蘇成芝.幽門螺桿菌細胞毒素相關蛋白A及細胞空泡毒素A的研究[J].華人消化雜志,1998,6(2):72-73.
[3]吳迪,李玉民,曹文娟,等.白細胞介素10-1082基因多態性與胃癌遺傳易感性的Meta分析[J].中華消化外科雜志,2014,13(1):34-38.
[4]Turner DM,Williams DM,Sankaran D,et al.An investigation of polymorphism in the interleukin-10 gene promoter[J].Eur J Immunogenet,1997,24(1):1-8.
[5]李艷,黃憲章,張平安,等.雌激素受體基因多態性與急性心肌梗死關系的研究[J].中華醫學雜志,2001,81(7):8-11.
[6]向瑜,張莉萍,陳瀑,等.白介素-1和腫瘤壞死因子-α基因多態性與幽門螺桿菌相關性胃十二指腸疾病的關系[J].中國微生態學雜志,2010,22(7):609-613.
[7]Toller IM,Neelsen KJ,Steger M,et al.Carcinogenic bacterial pathogen Helicobacter pylori triggers DNA double-strand breaks and a DNA damage response in its host cells[J].Proc Natl Acad Sci U S A,2011,108(36):14944-14949.
[8]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[9]Lee JY,Kim HY,Kim KH,et al.Association of polymorphism of IL-10 and TNF-A genes with gastric cancer in Korea[J].Cancer Lett,2005,225(2):207-214.
[10]Lu W,Pan K,Zhang L,et al.Genetic Polymorphisms of interleukin(IL)-1B,IL-1RN,IL-8,IL-10 and tumor necrosis factor alpha and risk of gastric cancer in a Chinese population[J].Carcinogenesis,2005,26(3):631-636.
[11]El-Omar EC,Gammon MD.Increased risk of noncardia gastric cancer associated with proinflammatory cytokine gene polymorphisma[J].Gastroenterology,2003,124(5):1193-1201.
[12]Rad R,Dossumbekova A,Neu B,et al.Cytokine gene polymorphisms influence mucosal cytokine expression,gastric inflammation,and host specific colonisation during Helicobacter pylori infection[J].Gut,2004,53(8):1082-1089.
[13]Roh JW,Kim MH,Seo SS,et al.Interleukin-10 promoter polymorphisms and cervical cancer risk in Korean women[J].Cancer Lett,2002,184(1):57-63.
[14]Lee KM,Lee JS,Jung HS,et al.Late reactivation of sonic hedgehog by Helicobacter pylori results in population of gastric epithelial cells that are resistant to apoptosis:implication for gastric carcinogenesis[J].Cancer Lett,2010,287(1):44-53.

