環境條件對sua41 突變體表型的影響
黃國文
(湖南科技學院 生命科學和化學工程學院,湖南 永州 425199)
環境條件對sua41突變體表型的影響
黃國文
(湖南科技學院 生命科學和化學工程學院,湖南 永州 425199)
突變體表型分析是基因功能研究的重要組成部分,通過對突變體的分析可以預見突變序列的未知功能。本文研究了sua41突變體的表型特征和可塑性變化。結果表明,與Col-0相對照,sua41的蓮座葉和莖生葉片較小,植株的莖細小,花序軸頂端的花蕾較少,在果枝上有聚合果現象;sua41突變體的早花表型與光照強度和光質無關;不同光照條件下sua41根長與野生型相比有差異;不同光質條件下sua41下胚軸長度比野生型的稍長;低溫條件下sua41突變體根長比野生型的短,下胚軸長度比野生型的稍微長些。說明,SUA41基因除了調節開花時間之外,還調節莖、葉、上胚軸和根的生長以及花芽的形成。SUA41基因是一個多功能的基因。
sua41突變體;表型;光照;溫度
表型(phenotype)是生物體的遺傳性狀,是基因與環境相互作用的結果,對植物在不同環境中生存和繁殖是很重要的[1,2]。植物的表型具有可塑性,生物受到環境影響后同一基因型能夠做出相應改變而產生不同表型,來適應其生存的時空異質環境
[3,4]。植物在光照、溫度、水分、養料等變化的環境中,能夠發生遺傳變異,接受自然選擇,表現出可塑性響應。可塑性使植物的形態、生理或發育性狀發生改變,使其能夠適應生存環境,有利于植物在不同環境中生存和繁殖。所以,研究植物的表型變化能夠反映出基因型的變化,表型是基因型變化的指示者。在以基因敲除或RNA干涉[5,6]為目的產生突變體中,表型可以作為一種工具解釋遺傳成分在分子水平的作用過程并且理解其生物學過程。通過對突變體的分析可以預見序列的未知功能。擬南芥sua41突變體是一個T—DNA標簽插入來敲除基因的突變體。目前研究表明,SUA41基因參與調節擬南芥開花時間,并且在開花自主途徑和溫敏途徑中起調節作用[7],參與生長素的信號轉導途徑的調節[8],并能夠調節基礎免疫和系統獲得性抗性[9]。SUA41基因啟動子與GUS融合表達載體在擬南芥中的表達特性和qPCR分析野生型Col-0中SUA41基因的表達水平,表明SUA41基因在植株的根、下胚軸、子葉、芽、莖、葉、花和角果中都有表達,且表達量無顯著區別[7]。SUA41基因的表達模式反映出這種基因可以參與了植株各個器官的生命活動或者生長發育。本文研究sua41突變體的表型特征,用以揭示SUA41基因的調節功能。
1 材料和方法
1.1 植物材料
實驗中所使用的植物材料為擬南芥 (Arabidopsis thaliana)野生型Columbia (Col-0) 生態型。sua41突變體(SALK-109959)雜合體為T-DNA插入突變體,其種子來自美國Ohio州立大學ABRC(ArabidopsisBiological Resource Center)。
1.2 植物開花時間的統計方法
把Col-0和sua41種子放在濕潤的濾紙上或者用酒精消毒的種子放在MS培養基上。在4℃處理3天,然后種在特定光照:長日照(16h光照/8h黑暗)不同光照強度、藍光(2.0μmol/m2.s)、紅光(66μmol/m2.s)等條件下,讓植物生長,當材料開花時,記錄植物產生第一朵花時植株的總葉片數(蓮座葉和莖生葉)作為植物的開花時間指標,統計的每種植物數目不低于25株。進行了三次生物學重復實驗。將數據統計在Excel表中進行分析。
1.3 測定sua41突變體的下胚軸長度和根長度的方法
把sua41突變體和Col-0野生型種子播在含MS培養基的培養皿中,經過4℃低溫處理3天以及光誘導處理4小時以后,放在不同的光照:長日(16h光照/8h黑暗)、短日(8h光照/16h黑暗)、連續紅光(66μmol/m2.s)、連續藍光(2.0μmol/m2.s),黑暗等條件處理7天后,測定其下胚軸的長度;對在各種條件下生長14天幼苗,測定其根的長度。進行三次生物學重復實驗。將數據統計在Excel表中進行分析。
2 結果和分析
2.1 sua41突變體的表型特征觀察
與野生型比較,sua41突變體除了具有早花表型以外,還有其它的一些特征(圖1)。植株的蓮座葉和莖生葉片較小,植株的莖細小。主枝花序軸上角果的數目較少且單位長度上角果的數量也較少,角果有聚合在同一節上的現象。花序軸頂端的花蕾較少。在各個發育階段植株都很弱小。在盛花期,蓮座葉開始變黃,在果實成熟后期,蓮座葉枯死。但是在株型上與野生型Col-0沒有明顯區別,主莖上也有分枝。這些結果表明,SUA41基因突變導致植株的莖和葉片的大小以及花朵和角果的數目改變;SUA41基因影響植株莖葉的生長和花的發育,暗示SUA41基因可能影響莖節間細胞分裂和花分生組織特征基因的作用。

圖1. sua41突變體的表型特征
2.2 不同光照條件對sua41根和下胚軸生長以及開花時間的影響
為了了解不同光照條件對sua41突變體的下胚軸和根生長的影響,測定了sua41突變體幼苗根的長度。結果(圖2A)所示,在不同光照條件下,突變體和野生型都是以連續紅光和連續遠紅光的根最長,分別為2.6,2.9和2.8,2.6cm;而以連續白光照的根最短,分別為1.0和1.4cm;連續藍光下分別為1.9和1.9 cm;在長日和短日條件下,分別為1.4,1.9和1.8,2.0 cm。說明,在同一光照條件下,與野生型比較,sua41突變體的根長有一定變化,但是變化不大;與白光相比在連續藍光、連續紅光和遠紅光條件下,sua41突變體根長有較大變化。所以SUA41突變對根的生長有一定影響,并且與光照強度和光質有一定關系,但是這種影響是比較弱的。(A) 不同光照條件下的sua41的根長度 (cm)。 (B) 不同光照條件下的sua41的下胚軸長度(cm)。 A, 黑暗. B, 長日照. C,短日照. D, 連續白光照. E, 連續藍光照 F, 連續紅光照 G, 連續遠紅光照. (C) 不同光照度下sua41的開花時間(天數)。(D) 不同光照度下sua41的開花時間(葉片數)。1 (184.62μmolm-2s-1), 2 (133.04μmolm-2s-1), 3 (109.40μmolm-2s-1) 和 4 (98.94μmolm-2s-1) 。 數值顯示平均值± SE。

圖2. 不同光照條件下sua41突變體的根長度(cm)、下胚軸長度(cm)和開花時間
在多種光照條件下,測定了Col-0和sua41的下胚軸的長度(圖2B)。表明,在黑暗條件下,sua41的下胚軸長度比Col-0的稍微短1cm左右,但是在紅光、藍光、長日照和短日照條件下,sua41突變體的下胚軸長度比野生型的稍長1cm左右,但變化程度不明顯。與黑暗比較,光照條件下Col-0和sua41的下胚軸較短。說明,sua41突變體下胚軸對各種光照有反應;SUA41基因能夠參與光照條件下抑制植株下胚軸的伸長,但是與光照種類無關。
在長日條件和四個光照強度處理下,sua41突變體開花時所需要的天數不同(圖2C)。Col-0的天數依次為24.6,24.9,30.8和34天。sua41的天數依次為19.7,20.6,24.9和26.8天。同一光強下,sua41的開花天數與Col-0的開花天數的比值都為0.8,所以它們變化的值相同。四種光照強度下,野生型和sua41突變體的開花葉片數如下(圖2D)所示。野生型的開花葉片數分別為14.2片,14.2片,15.9片和15.6片,sua41突變體的開花葉片數分別為8.6片,8.4片,8.7片和8.4片。表明,在不同光照強度下Col-0和sua41的開花葉片數都相差不是很大。光照強度能夠影響擬南芥的生長發育,較高光照強度能夠使擬南芥Col-0和sua41生長發育較快,開花較早,而較低光照強度能使擬南芥Col-0和sua41突變體生長發育較慢,開花較遲。SUA41基因影響開花天數與光強無關,影響開花時葉片數與光強無關。SUA41基因參與的開花反應不受光照強度的影響。
2.3 光質對sua41下胚軸生長和開花時間的影響
為了更好地理解光質對sua41下胚軸生長的影響,有必要對不同強度的紅光和藍光進行實驗。PHYB是一種紅光受體,主要調節植物對紅光的反應,促進幼苗的下胚軸縮短,其過表達使幼苗矮化,其突變導致幼苗的下胚軸伸長[10]。在不同紅光強度下,測定了sua41突變體的下胚軸的長度,結果如下(圖3A)。在不同紅光強度下,與Col-0相比,phyB的下胚軸有一定的變化,但是,隨著光強增強,sua41突變體的下胚軸有一定程度的增加。說明,sua41突變體的下胚軸對紅光有一定反應,SUA41基因能夠參與紅光調節植株下胚軸的生長。
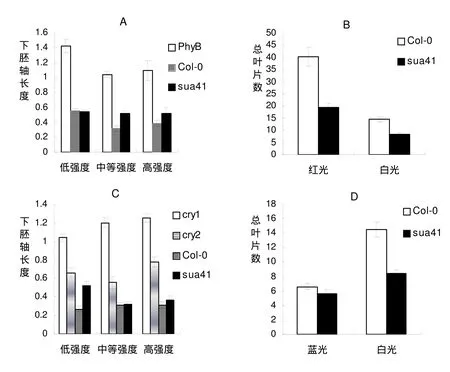
圖3. 不同光照條件下sua41突變體的下胚軸長度(cm)和開花時間
(A) 不同紅光強度下sua41的下胚軸長度。低強度、中等強度和高強度紅光分別是 31μmol/m2.s, 66μmol /m2.s, 88μmol/m2.s。 (B) 不同連續的光照條件下sua41的開花時間。紅光強度是21μmol. m-2. s-1,白光強度是70 μmol. m-2. s-1。 (C)不同藍光條件下sua41的下胚軸長度。低等強度、中等強度和高強度的藍光分別是0.5μmol/m2.s, 2.0μmol/m2.s 和4.15μmol/m2.s. (D) 不同連續光照條件下sua41的開花時間。藍光強度是25 μmol. m-2. s-1,白光強度是70μmol. m-2. s-1. 資料顯示平均值(n =50) ±SD.
CRY1和CRY2是兩種藍光受體,主要調節植物向光性運動和其他藍光反應(包括抑制下胚軸伸長、刺激子葉張開、調節開花時間等),其突變導致幼苗的下胚軸伸長[11]。在不同藍光強度下,以cry1、cry2和Col-0為對照,測定了sua41突變體的下胚軸的長度,結果如下(圖3C)。在不同藍光強度下的下胚軸以cry1的最長,cry2的次之,說明各種強度藍光在調節下胚軸生長時有作用。在低光強下sua41突變體的下胚軸比Col-0的較長,但在高光強下,Col-0和sua41突變體的下胚軸長度幾乎一樣長,說明在中等和高藍光下sua41突變體的下胚軸長度受藍光的影響較小,SUA41基因能夠參與低強度藍光調節植株下胚軸的伸長。
光質影響植物的開花時間。藍光是促進擬南芥開花的環境因素之一。將擬南芥Col-0和sua41播種在含有MS的培養瓶中,放入藍光和白光培養箱(光照強度為 25μmolm-2s-1)中進行光照培養。開花時計算葉片數(圖3D)。在藍光培養條件下,Col-0和sua41的葉片數分別為6.6片和5.5片。比較白光條件下,Col-0和sua41的葉片數分別為14.5片和8.5片,藍光條件下Col-0和sua41開花時的葉片數都減少了。在藍光和白光光照條件下,sua41突變體的葉片數與Col-0的葉片數的比值分別為0.8和0.6,雖然比值有變化,但是變化的幅度不大,說明sua41突變體仍然能夠響應藍光信號早開花。即SUA41突變雖然影響開花時間,但不影響植物對藍光信號的感受,SUA41基因不在藍光促進開花途徑中起作用。
紅光是抑制擬南芥開花的因素。將擬南芥Col-0和sua41播種在土壤中,放入紅光和白光培養箱中進行光照培養。開花時計算葉片數(圖3C)。在紅光培養條件下,Col-0和sua41的葉片數分別為40.3片和19.6片。比較白光條件下,Col-0和sua41的葉片數分別為14.5片和8.5片,紅光條件下Col-0和sua41開花時的葉片數都增加了。在紅光和白光光照條件下,sua41的葉片數與Col-0的葉片數的比值分別為0.5和0.6,比值雖然有變化,但是變化的幅度不大。說明,紅光抑制了sua41突變體的開花,同樣也抑制了Col-0的開花,但是抑制的程度相似。說明SUA41基因不參與紅光抑制植物開花的過程。
2.4 低溫對sua41突變體下胚軸和根長的影響
把Col-0和sua41播種在MS培養基上,在4℃黑暗處理3天,放在16℃和長日條件下,讓其生長12天,測定它們的下胚軸和根的長度(圖4)。表明,在常溫條件下,

圖4. 在低溫條件下sua41突變體的下胚軸和根的長度(cm)
(A) 在22℃ 和16℃ 條件下Col-0 和sua41幼苗的下胚軸長度. (B) 在22℃ 和 16℃ 條件下Col-0 和sua41根長度. 資料顯示平均值 (n =50) ±SD.
sua41突變體的下胚軸長度0.36cm比Col-0的0.31cm多0.05cm;在16℃條件下,sua41突變體的下胚軸長度0.10cm比Col-0的0.16cm少0.05cm,所以低溫條件抑制sua41突變體的下胚軸的伸長。在常溫條件下,sua41突變體的根長度0.95cm比Col-0的1.34cm少0.39cm;在16℃條件下,sua41突變體的根長0.53cm比Col-0的0.88cm少0.35cm,所以低溫條件抑制sua41突變體根的伸長。說明SUA41突變影響植株下胚軸的生長,并且與溫度有關。SUA41突變抑制植株根的生長,但是與溫度無關。
3 討論
植物表型及其可塑性分析是理解植物適應異質環境的一種研究方法[12],也是闡明基因功能的重要手段。本文對sua41突變體的表型及可塑性分析表明,sua41突變體植株葉片小、莖細,花序軸頂端的花蕾較少,有角果聚合現象。sua41突變體的早花表型與白光照強度和光質無關,說明,SUA41基因獨立于光質途徑來調節植株的開花時間。sua41突變體的下胚軸比野生型的長些,與光照、光照強度和溫度有關,說明SUA41基因能夠調節下胚軸的生長,但是作用較弱;特別是在低強度藍光下sua41突變體的下胚軸明顯地比野生型長,說明有一種與SUA41蛋白相互作用的感受低強度藍光的蛋白存在[13]。sua41突變體的根長比野生型的短些,與光質有關,但是變化不明顯,與光照強度和溫度無關,說明其調節根的生長作用較弱。sua41突變體的開花時間與光質無關,但是其根和下胚軸的伸長與光質有關,說明SUA41基因調節各個器官的生長發育機制是不一樣的。因此,SUA41基因是一個多功能的基因,不僅影響植株葉片細胞分裂和花分生組織特征基因的活動,而且影響植株下胚軸和根的細胞分裂和生長。SUA41基因調節各個器官的生長的機制有待于進一步研究。
[1] Bradshaw A D.Evolutionary significance of phenotypic plasticity in plants[J].Advanced in Genetics,1965,13:115-155.
[2] Pintado A,Valladares F,Sancho L G.Exploring phenotypic plasticity in the lichenRamallina capitata:morphology,water relations and chlorophyll content in north and south facing populations[J],Annals of Botany,1997,80:345-353.
[3]Sultan S E. Evolutionary implications of phenotypic plasticity in plants[J].Journal of Evolutionary Biology,1987,21:127-178.
[4]Bradshaw A D.Unravelling phenotypic plasticity- why should we bother?[J].New Phytologist,2006,170:644-648.
[5]Hannon G J. RNA interference[J].Nature,2002,418(6894):244-251.
[6]Shi Y. Mammalian RNAi for the masses[J].Trends in Genetics,2003,19(1):9-12.
[7]黃國文,韓玉珍,傅永福.擬南芥SUA41基因的表達和功能分析[J].遺傳,2013,35(1):93-100.
[8]Parry G, Ward S, Cernac A, et al. TheArabidopsisSUPPRESSOR OF AUXIN RESISTANCE proteins are nucleoporins with an important role in hormone signaling and development[J]. Plant Cell, 2006,18(7):1590-1603.
[9]Zhang Y L, Li X. A putative nucleoporin 96 is required for both basal defense and constitutive resistance responses mediated bysuppressor of npr1-1, constitutive 1[J].Plant Cell,2005,17(4):1306-1316.
[10]Zheng X,Wu S, Zhai H, et al. Arabidopsis Phytochrome B Promotes SPA1 Nuclear Accumulation to Repress Photomorphosgenesis under Far-Red Light[J].Plant Cell,2013,25(1):115-33.
[11]Lin C, Yang H, Guo H, et al. Enhancement of blue-light sensitivity ofArabidopsisseedings by a blue light receptor cryptochrome 2 [J].Proceedings of the National Academy of Sciences of USA,1998,95:2686-2690.
[12]胡啟鵬,郭志華, 李春燕,等. 植物表型可塑性對非生物環境因子的響應研究進展[J].林業科學.2008,44(5):135-142.
[13]Lin C. Plant blue-light receptors[J].Trends in Plant Science,2000,5:337-342.
Q7
A
1673-2219(2014)05-0092-05
2013-03-20
黃國文(1965-),湖南郴州人,博士,從事細胞工程技術教學和科研工作。
(責任編校:何俊華)

