子癇前期患者血脂水平及脂蛋白脂酶基因多態性相關性研究
湯琳琳,徐友娣,薛鑫源
(南京醫科大學附屬南京醫院(南京市第一醫院)婦產科,江蘇南京 210006)
子癇前期(preeclampsia,PE)是孕20周后發生的,以高血壓、蛋白尿為主要特征的多臟器損害性疾病。該病嚴重影響母嬰健康,是孕產婦和圍生兒病率及死亡率升高的主要原因之一,其發病機制至今尚未完全闡明,各家學說不一,可能與遺傳易感性、免疫適應不良、胎盤缺血和氧化應激反應有關。目前國內外大部分研究認為其發病起源于胎盤病理生理改變,進一步導致全身血管內皮細胞損傷,后者引起PE的一系列臨床癥狀。血管內皮細胞損傷是PE一系列病理生理改變的基礎。
研究表明,人體脂質代謝異常與PE密切相關。脂蛋白脂酶(LPL)與血脂代謝密切相關。而LPL基因決定了LPL的表達,推測LPL基因多態性亦與血脂代謝及PE存在著一定的相關性。本研究通過血脂測定,從全血中提取DNA,采用聚合酶鏈反應-限制性片斷長度多態性(PCR-RFLP)技術檢測實驗組與對照組孕婦在LPL基因HindⅢ和PvuⅡ兩個酶切位點的多態性及其對血脂水平的影響,并探討PE的發生與LPL基因多態性之間的關系,為今后進一步研究PE的發病機理奠定基礎,也為今后臨床上的預防、早期診斷、干預性治療和尋找藥物作用靶點闡明機理。
1 資料與方法
1.1 一般資料
實驗組按樂杰主編《婦產科學》第7版[1]標準,選取2007年7月至2010年8月在南京醫科大學附屬南京醫院產科住院的確診為PE的孕婦142例;對照組選取2007年7月至2010年8月在南京醫科大學附屬南京醫院產科住院的157例年齡、孕周與實驗組均無統計學差異的正常孕婦。所有孕婦均無其它合并癥和慢性病史,如糖尿病、腎病綜合征等。
1.2 實驗方法
1.2.1 一般指標、血脂測定及24 h尿蛋白定量測定取研究對象空腹靜脈血送醫院OLYMPUS全自動生化分析儀進行血常規、肝功能及血脂等檢測,并記錄研究對象一般情況及檢測結果。收集24 h尿液貯存于容器內,全部送檢,采用免疫比濁法進行24 h尿蛋白定量測定。檢測前要先用量杯量取總尿量后攪勻,取其中100 ml測蛋白量,再根據實際尿量進行計算。
1.2.2 DNA提取 取全血3 ml,選用美國OMEGA公司提供的全血DNA試劑盒,提取基因組DNA后置-80℃冰箱保存備用。
1.2.3 PCR 所有引物購自上海英駿生物技術有限公司。限制性內切酶HindⅢ對應LPL基因內含子8區所需PCR引物參照Wang等[2]合成:上游引物為5'-GAT GTC ACC TGG ATA ATC AAA G-3';下游引物為5'-CTT CAGCTA GACATT GCT AG-3';內含子6區所需PCR引物參照Mead等[3]合成:上游引物為5'-ATG GCA CCC ATG TGT AAG GTG-3';下游引物為5'-GTG AAC TTC TGA TAA CAA TCT C-3'。PCR總反應體系50 μl,組成如下:PCR Master Mix(2 ×)25 μl,上游引物1.0 μl,下游引物1.0 μl,模板 DNA 3.0 μl,滅菌水20μl。混勻后按下列循環擴增:94℃預變性5 min,94 ℃變性30 s,55 ℃退火40 s,72 ℃ 延伸90 s,72 ℃保溫延伸10 min,共35個循環,最后 72℃延伸10 min,4℃保存。PCR產物經溴化乙錠染色的1.5%瓊脂糖凝膠電泳,出現特異性條帶。限制性內切酶HindⅢ對應條帶為365 bp,PvuⅡ對應條帶為440 bp。
1.2.4 RFLP LPL基因內含子8區及6區PCR產物分別與限制性內切酶HindⅢ、PvuⅡ混合,水浴37℃過夜。成分如下:PCR產物 10μl,HindⅢ或 PvuⅡ1.0 μl,10×buffer R 2.0 μl,滅菌雙蒸餾水 17 μl。取各自酶切產物10μl在1.5%瓊脂糖凝膠上電泳30 min,溴化乙錠染色后凝膠成像系統成像分析。LPL基因內含子8區PCR擴增產物為365 bp,經HindⅢ限制性內切酶水解后可得到3種基因型,含HindⅢ酶切位點的等位基因記為“H+”,無酶切位點記為“H-”,即H+H+型,終產物為205、160 bp的2個條帶;H+H-型,終產物為365、205、160 bp 3個條帶;H-H-型,終產物為365 bp的1個條帶。LPL基因內含子6區PCR擴增產物為440 bp,經PvuⅡ限制酶水解后可得到3種基因型,含PvuⅡ酶切位點的等位基因記為“P+”,無酶切位點的記為“P-”,即P+P+型,終產物為330、110 bp的2個條帶;P+P-型,終產物為440、330、110 bp的 3個條帶;P-P-型,終產物為440 bp的1個條帶(圖1)。
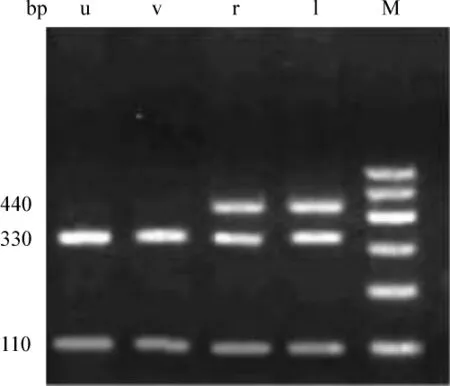
M為Marker;u、v為P+P+基因型條帶;r、l為P+P-基因型條帶
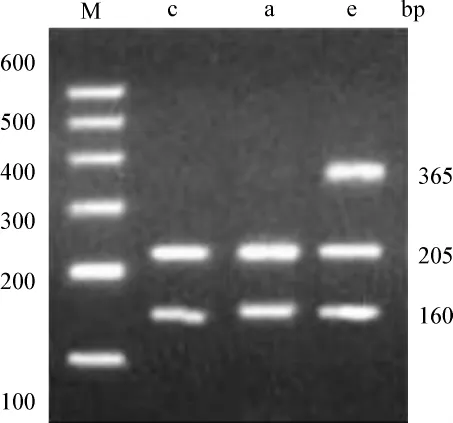
M為Marker;c、a為H+H+基因型條帶;e為H+H-基因型條帶

圖1 PCR-RFLP技術檢測結果
1.3 統計學處理
研究對象血脂水平及HindⅢ和PvuⅡ限制性內切酶酶切結果均經SPSS 13.0統計軟件分析,血脂水平用均數±標準差表示,比較用t檢驗;兩組基因型分布頻率及等位基因表型頻率的比較均采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1 臨床資料比較
實驗組和對照組組間的年齡、孕周構成差異無統計學意義。實驗組均為晚發型子癇前期患者,包括輕重兩型。兩組的收縮壓和舒張壓均有明顯差異,有統計學意義(P<0.01)。實驗組24 h尿蛋白定量為(4.69±1.74)g。實驗組總蛋白、白蛋白及血紅蛋白均比對照組低,差異有統計學意義(P<0.01);兩組間丙氨酸轉氨酶、天冬氨酸轉氨酶及血小板計數差異無統計學意義(P>0.05)(表1)。

表1 實驗組及對照組的基本資料
2.2 實驗組與對照組血脂水平比較
實驗組甘油三酯(TG)、總膽固醇(TC)及載脂蛋白B(ApoB)均明顯高于對照組(P<0.01),低密度脂蛋白(LDL)亦高于對照組(P<0.05),差異均有統計學意義;高密度脂蛋白(HDL)低于對照組,但差異無統計學意義(P>0.05),其中的脂質成分LP(a)高于對照組,但差異無統計學意義(P>0.05);載脂蛋白A1(ApoA1)低于對照組(P<0.01),差異有統計學意義。實驗組動脈粥樣硬化指數[(TC-HDL)/HDL,AI]較對照組顯著升高(P<0.01)(表2)。
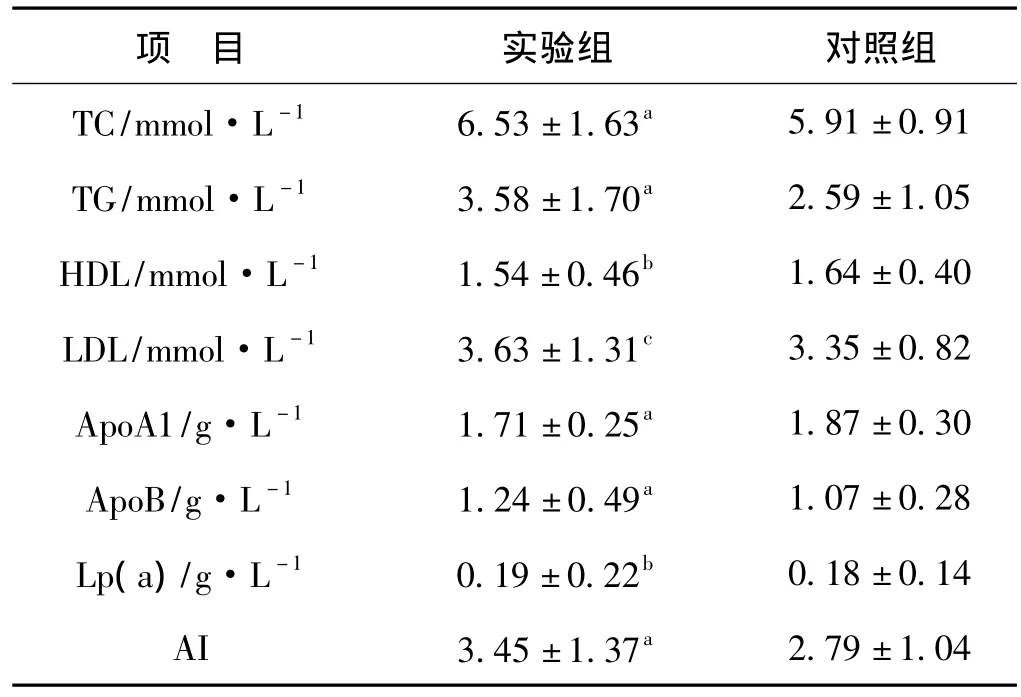
表2 實驗組與對照組血脂水平比較
2.3 LPL基因HindⅢ和PvuⅡ酶切多態性
LPL基因HindⅢ酶切位點H+H+、H+H-、HH-基因型,實驗組分別為 117(82.4%)、19(13.4%)、6(4.2%);對照組分別為 108(68.8%)、36(22.9%)、13(8.3%)。實驗組等位基因 H+253(89.1%)、H-31(10.9%);對照組等位基因 H+252(80.3%)、H-62(19.7%)。基因型及等位基因分布頻率組間比較P值均小于0.05(基因型P=0.024,等位基因P=0.003),差異有統計學意義。LPL基因PvuⅡ酶切位點P+P+、P+P-、P-P-基因型,實驗組分別為 74(52.1%)、39(27.5%)、29(20.4%);對照組分別為 78(49.7%)、43(27.4%)、36(22.9%)。實驗組等位基因P+187(65.8%)、P-97(34.2%);對照組等位基因 P+199(63.4%)、P-115(36.6%)。基因型及等位基因分布頻率組間比較P值均大于0.05(基因型P=0.86,等位基因P=0.528),差異無統計學意義。見表3、4。
2.4 LPL基因多態性與血脂水平的關系
LPL-HindⅢ實驗組和對照組各基因型之間血脂水平差異顯著,H+H+基因型的 TC、TG、LDL、ApoB及AI明顯高于另兩種基因型(P<0.01),HDL及ApoA1低于另兩種基因型(P<0.01),Lp(a)無明顯差異(P>0.05)。實驗組和對照組LPL-PvuⅡ各基因型間血脂水平差異均無統計學意義(P>0.05)(表5、6)。
3 討 論
PE高血脂病理學理論認為,血管的抗毒活性降低引起了內皮細胞毒性及TG在細胞內堆積,在PE癥狀出現前,孕5~20周時血中游離脂肪酸(free fatty acid,FFA)已經升高,高濃度FFA可增加胰島素抵抗、內皮細胞功能損傷及改變血管活性物質產生[4]。本研究
結果顯示實驗組TG、TC及ApoB均明顯高于對照組(P<0.01),LDL亦高于對照組(P<0.05),差異均有統計學意義;HDL低于對照組,但差異無統計學意義(P>0.05),其中的脂質成分LP(a)高于對照組,但差異無統計學意義(P>0.05);ApoA1明顯低于對照組,差異有統計學意義(P<0.01)。實驗組AI較對照組顯著升高(P<0.01),具有動脈粥樣硬化高風險。這與多數研究結果[5-9]相一致,進一步證實了PE患者存在脂質代謝紊亂。
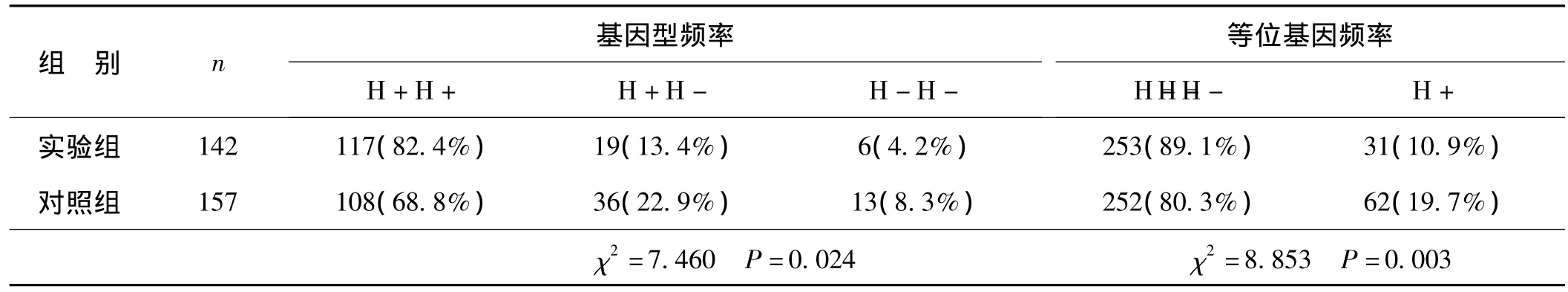
表3 實驗組與對照組LPL-HindⅢ基因多態性統計結果

表4 實驗組與對照組LPL-PvuⅡ的基因多態性統計結果

表5 LPL基因HindⅢ多態性與血脂水平的關系

表6 LPL基因PvuⅡ多態性與血脂水平的關系
LPL是一種糖蛋白,主要由脂肪細胞、心肌細胞、骨骼肌細胞等合成和分泌,其主要生理功能是分解脂蛋白核心成分TG,是血漿中清除TG的限速酶,可以催化乳糜微粒(chylomicron,CM)和極低密度脂蛋白(very low density lipoprotein,VLDL)核心中的 TG水解,以供組織氧化供能和儲存需要,同時,它還參與VLDL及HDL中載脂蛋白和磷脂之間的轉換,影響HDL和LDL的成熟。LPL基因位于第8號染色體短臂P22區,長約30 kb,由10個外顯子和9個內含子組成。LPL基因第8內含子HindⅢ位點多態性是由堿基G→T互換引起,根據有無HindⅢ內切酶位點分別將兩個等位基因稱為H+和H-等位基因。研究表明,LPL基因第8內含子HindⅢ位點多態性對血脂水平有明顯的影響。Long等[10]發現高脂血癥組H+等位基因頻率明顯高于血脂正常組,且在高脂血癥組中H+H+基因型表現有更高的血漿TG、ApoB100、TG/HDLC,血脂正常組中H+H+基因型有更高的血漿TG和HDL-C3c。H+H+基因型的血漿TG水平顯著升高,而HDL-C水平顯著降低[11-12];攜帶H+等位基因個體較H-個體具有較高的 TG 水平[13]。楊志明等[14]對哈薩克族人LPL基因HindⅢ、S447X多態性與代謝綜合征(metabolic syndrome,MS)及其組分(腰圍、收縮壓、舒張壓、TG、HDL-C、空腹血糖)關系的研究表明,與對照組相比,MS組H+H-/H-H-基因型、H-等位基因頻率明顯低。隨著MS組異常的增多,H+H+攜帶率有相應增加趨勢。本研究結果與國內外文獻相似,表明實驗組和對照組LPL-HindⅢ各基因型之間血脂水平差異顯著,H+H+基因型的TC、TG、LDL、ApoB及AI明顯高于另兩種基因型(P<0.01),HDL及ApoA1低于另兩種基因型(P<0.01),Lp(a)無明顯差異(P>0.05)。實驗組 LPL基因H+H+基因型及H+等位基因的攜帶率均較對照組高,差異有統計學意義(P<0.05)。表明LPL基因HindⅢ酶切位點多態性與PE的發生存在一定相關性,攜帶H+等位基因的孕婦可能更易發展成為PE。
LPL的PvuⅡ酶切位點在內含子6區,是由一個C→T堿基置換引起,目前相關研究結果不一致。國外Chamberlain等[15-16]發現P+P+基因型者血清TG水平顯著高于其它基因型者,而國內樊蕓等[17]認為P+等位基因與血漿HDL的下降沒有關聯,盡管P+P+基因型者的血清HDL水平較P+P-基因型者和PP-基因型者有增高的趨勢,但差異無統計學意義(P>0.05)。崔曉棟等[18]通過對78名2型糖尿病患者和49名正常對照個體比較發現,雖然病例組P+P+基因型HDL低于P-P-組(P=0.013),但兩組TG、TC相比并無明顯差別。李建新等[19]研究發現P+P+基因型可引起血漿TG升高、HDL降低;妊高征組和對照組不同基因型間血漿TG、LDL差異無統計學意義。本研究表明實驗組和對照組LPL-PvuⅡ各基因型間血脂水平差異均無統計學意義(P>0.05)。LPL基因PvuⅡ酶切位點基因型(P+P+,P+P-,PP-)及等位基因(P+,P-)分布頻率在實驗組與對照組之間差異無統計學意義(基因型P=0.86,等位基因P=0.528)。
LPL基因HindⅢ和PvuⅡ酶切位點均位于內含子區,它們所導致的基因變異并不會直接影響LPL活性,推測H+H+基因型可能通過連鎖不平衡作用或通過與個體血脂水平以及動脈粥樣硬化發生發展密切相關的ApoE等其他基因的協同作用影響血漿LPL活性,從而調節脂質代謝,影響LPL對CM和VLDL-C中TG的脂解作用,進而形成異常脂質血癥,進一步引起血管內皮損傷等一系列病理生理改變而引起PE的發生。而PvuⅡ酶切位點的多態性可能并不參與影響LPL的活性,抑或其影響很小。分析LPL基因HindⅢ酶切位點多態性,對檢測PE高危人群,預測、預防及早期發現PE有非常重要的意義。
目前,國內外的研究在LPL基因HindⅢ酶切多態性與血脂水平及PE的關系上具有較強的一致性。而PvuⅡ酶切位點多態性與血脂水平及PE的關系研究有較大的差異,考慮可能與人群、種族、地域或樣本量有關,或是某些基因雖未發生突變,但其基因活性的改變也可能與發病相關,同時PE是一種多因素疾病,屬遺傳易感性疾病,是遺傳因素與環境因素共同作用的結果。探求PE的發病原因以及將研究成果應用于臨床以篩選PE的高危人群,還需要更大規模的、多方面的、多地域的、多民族的流行病學和進一步的實驗室研究加以證實。
[1]樂杰.婦產科學[M].7版.北京:人民衛生出版社,2008:92.
[2]WANG X L,McCREDIE R M,WILCKEN D E.Common DNA polymorphisms at the lipoprotein lipase gene:association with severity of coronary artery disease and diabetes[J].Circulation,1996,93(7):1339-1345.
[3]MEAD J R,IRVINE S A,RAMJI D P.Lipoprotein lipase:structure,function,regulation,and role in disease[J].J Mol Med,2002,80:753-769.
[4]VILLA PM,LAIVUORIH,KAJANTIEE,et al.Free fatty acid profiles in preeclampsia[J].Prostaqlandins Leukot Essent Fatty Acids,2009,81(1):17-21.
[5]TIAN Y,LONG SY,XU Y H,et al.Study on ApoE gene polymorphism and subclasses of serum high density lipoprotein in type Ⅳ hyperlipidemia[J].Chinese J Med Genetics,2005,22(1):96-98.
[6]RAY JG,DIAMOND P,SINGH G,et al.Brief overview of maternal Iriglycerides as a risk factor for preeclampsia[J].BJDG,2006,113(4):379-386.
[7]BELO L,CASLAKE M,GAFFNEY D,et al.Changes in LDL size and HDL concentration in normal and pre-eclampsia pregnancies[J].Atherosclerosis,2002,162(2):425-432.
[8]徐友娣,殷惠蓉.妊娠高血壓綜合征與脂類、載脂蛋白、血漿蛋白代謝的關系[J].現代醫學,2003,31(6):390-391.
[9]BIRKELAND K I,KILHOVD B,THORSBY P,et al.Heterogeneity of non-insulin-dependent diabetes expressed as variability in insulin sensitivity,beta-cell function and cardiovascular risk profile[J].Diabet Med,2003,20(1):37-45.
[10]LONG SY,TIAN Y,ZHANG R,et al.Relationship between plasma HDL subclasses distribution and lipoprotein lipase gene HindⅢpolymorphism in hyperlipidemia[J].Clin Chim Acta,2006,366(1-2):316-321.
[11]MA Y Q,THOMAS G N,NG M C,et al.The lipoprotein lipase gene HindⅢpolymorphism is associated with lipid levels in early-onset type 2 diabetic patients[J].Metabolism,2003,52(3):338-343
[12]蘇慧,黃晨,孫新,等.LPL基因HindⅢ多態性與高脂血癥和冠心病的關系[J].心臟雜志,2005,17(6):599-601.
[13]孫琳,陳璐璐,耿厚法,等.LPL基因多態性與2型糖尿病合并腦血管病變及血脂的關系[J].山東大學學報:醫學版,2009,47(8):5-9.
[14]楊志明,郭淑霞,張景玉,等.HindⅢ、S447X基因多態性與哈薩克族 MS關系[J].中國公共衛生,2010,16(6):705-707.
[15]CHAMBERLAIN JC,THORN JA,OKA K,et al.DNA polymorphisms at lipoprotein lipase gene:Associations in normal and hypertriglyceridaemia subjects[J].Atherosclerosis,1989,79(1):85-91.
[16]COLAGIURI S.Lipoprotein lipase gene may shape diabetic future[J].CA Lancet,1997,350:269-273.
[17]樊蕓,張蓉,劉秉文,等.中國人內源性高甘油三酯血癥與脂蛋白脂酶基因PvuⅡ多態性關聯的研究[J].中華醫學遺傳學雜志,2001,18(4):296.
[18]崔曉棟,姜妙娜,宋林萱.2型糖尿病及胰島素抵抗與脂蛋白脂酶基因HindⅢ和PvuⅡ酶切位點多態性相關性的研究[J].中國慢性病預防與控制,2007,15(6):532.
[19]李建新,李焱,黃越玲,等.妊高征與脂蛋白酯酶基因PvuⅡ多態性與血脂指標關系[J].解剖學研究,2006,28(4):28-283.

