麻醉藥物通過胎盤轉運的研究進展
呂卓辰,羅 艷,薛慶生,于布為
(上海交通大學醫學院附屬瑞金醫院麻醉科,上海 200025)
自1985年美國的Uemura[1]等學者研究發現,妊娠大鼠接觸亞麻醉濃度的氟烷可影響新生大鼠大腦神經細胞的突觸發育以來,目前已從細胞培養、組織培養、動物實驗、臨床研究及流行病學調查等諸多領域得到證據,顯示麻醉藥物能夠誘導廣泛的神經細胞凋亡,對處于大腦發育期的胎兒產生不同程度的中樞抑制作用[2-3],引起了包括麻醉學、產科學、兒科學等諸多專家學者的關注。
近年來,隨著孕婦妊娠期間接受非產科手術、病理產科和急癥產科的日益增多,包括全身麻醉藥物在內的諸多麻醉藥物在孕婦中的應用越來越多。毋庸置疑,產科麻醉用藥的安全性問題是一個需要最大確定性的醫學領域,但由于倫理的限制,其相關資料卻并不多見。為此,本文將概括目前臨床常用麻醉藥物胎盤轉運情況的研究進展,并簡要介紹有關胎盤屏障通透性的研究方法。
1 胎盤屏障
胎盤是胎兒與母體之間進行物質交換的器官,由羊膜、葉狀絨毛膜和底蛻膜構成,具有物質轉運、代謝、分泌、防御以及合成功能[4]。人類與靈長類、嚙齒類動物同屬絨毛胎盤[5],這是動物實驗中普遍使用靈長類和嚙齒類動物研究胎盤屏障通透性的原因之一。
1.1 生理解剖 在胎盤內,母體循環經由子宮螺旋動脈、絨毛間隙、子宮螺旋靜脈組成,胎兒循環經由臍動脈、絨毛血管、臍靜脈組成。由于胎盤屏障的分隔,胎兒血與母血互不直接相通,主要通過胎兒小葉絨毛處的絨毛合體滋養細胞無核區胞質、合體滋養層基膜、絨毛間質、毛細血管基膜和毛細血管內皮細胞5層結構進行物質交換。
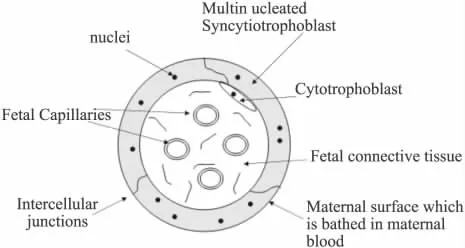
圖1 胎盤屏障的解剖結構[27]
1.2 胎盤發育 人類胎盤的發育分為兩個時期:從受精至第2月末為胚胎期,從第3月至出生為胎兒期。胚胎期的胎盤不具備屏障功能,母體內幾乎所有的藥物及其他化學成分均能通過胎盤進入胎兒體內,容易引起胎兒嚴重畸形、死胎或流產。胎兒期的胎盤開始行使屏障功能,但許多藥物仍然能夠通過胎盤,不利的環境因素、化學物質也同樣會直接或間接危害胎兒的發育。
人類胚胎的神經管發育始于妊娠第5周,尤其在缺氧、創傷、病理妊娠等情況下,胎盤毛細血管的完整性破壞,造成非選擇性的胎盤轉運,使藥物更容易通過胎盤[4]。統計數據表明[6],有將近50%的孕婦在孕期接受過藥物治療,其中4%的藥物在動物實驗或人類研究中具有潛在的胎兒毒性,這一數據使得探究胎盤屏障通透性問題具有重要的現實意義。
1.3 胎兒循環 胎兒循環的特點決定了藥物在胎兒體內的分布。來自胎盤的臍靜脈中,50%以上流經肝臟,剩余血液經靜脈導管流入下腔靜脈。流經肝臟的血內藥物大部分被迅速代謝清除,其余藥物經體循環到達心腦等器官。因此,經臍靜脈血中測得的血藥濃度高于經胎兒體循環后測得的臍動脈血藥濃度,為此,胎兒循環的特殊結構一定程度上保護了胎兒器官免受高濃度藥物的影響[4]。
2 常用麻醉藥物胎盤轉運情況研究
高濃度、小分子量(小于500 u)、離子化程度低、脂溶性高及蛋白結合率低的麻醉藥物能夠促進胎盤轉運,反之,低濃度、大分子量、離子化程度高、脂溶性低及蛋白結合率高會阻礙麻醉藥物通過胎盤。同時,還有許多其他因素通過藥物的吸收、分布、代謝和排泄等方面影響母體與胎兒的血藥濃度:(1)母體因素:母體血藥濃度、給藥途徑、合并用藥、妊娠相關疾病。(2)胎盤因素:成熟度、代謝能力、血流動力學情況。(3)胎兒因素:胎肝成熟度、對藥物的攝取程度、體內分布、代謝和排泄能力。
在麻醉藥物的胎盤轉運研究中,通常通過測定胎兒與母體血藥濃度比(F/M ratio)來反映藥物的胎盤轉運情況[7]。分娩過程中在胎兒離開母體即刻,通過外周靜脈采集母體血樣(MV),通過臍靜脈(UV)或臍動脈(UA)采集胎兒血樣,其中UV代表藥物通過胎盤的代謝情況,UA代表藥物在胎兒體內的代謝情況。有了這些部位采集的具體數據,就可以根據已知的給藥劑量、給藥時間和采樣時間,進一步計算相關藥代動力學參數。
2.1 靜脈麻醉藥
2.1.1 丙泊酚 丙泊酚靜脈給藥后,首相迅速分布(半衰期2~4 min),2 min后血藥濃度達峰值,然后迅速消除(半衰期30~60 min)。研究顯示[8],無論單次誘導還是誘導后持續泵注,丙泊酚在UV和MV中的血藥濃度比均約為0.70,表明丙泊酚極易通過胎盤屏障。單次誘導時,UA的血藥濃度平均為0.42 mg·L-1,稍高于UV(UA/UV=1.09),提示已經分布到胎兒組織中的丙泊酚又再分布到胎盤循環中。單次誘導后持續泵注時,UA的血藥濃度平均為0.78 mg·L-1,稍低于UV(UA/UV=0.70),提示胎兒有對丙泊酚持續攝取和代謝的能力。持續輸注丙泊酚分娩后2 h采集的新生兒足跟血中,丙泊酚的濃度僅為分娩時UA血藥濃度的十分之一,提示藥物在新生兒體內被迅速代謝清除。一般認為,臨床使用誘導劑量小于2.5 mg·kg-1,維持劑量小于6 mg·kg-1·h-1是安全有效的[9]。
2.1.2 氯胺酮 氯胺酮靜脈給藥后,首相分布迅速(半衰期2~11 min),1 min后血藥濃度達到峰值,消除半衰期186 min。目前暫無人類氯胺酮胎盤轉運的藥代動力學研究數據,但已知氯胺酮能快速通過胎盤,對心血管和呼吸系統有擬交感作用,尤其適用于低血容量和哮喘患者。臨床使用誘導劑量1~1.5 mg·kg-1安全有效,對有出血傾向的產婦尤其適用[9]。
2.1.3 硫噴妥鈉 硫噴妥鈉靜脈給藥后分布迅速(半衰期8.5 min),1 min后在胎兒血中出現峰值,消除緩慢。Kosaka等[10]研究顯示,硫噴妥鈉4 mg·kg-1經母體靜脈注射后,第30 s至第90 s內UV血藥濃度從0 mg·L-1升至13.8 mg·L-1,然后迅速下降;UA血藥濃度在注射后50 s能夠測得,在3.5 min時達峰值7.8 mg·L-1,然后緩慢下降。提示硫噴妥鈉能夠迅速通過胎盤,且胎兒有對硫噴妥鈉攝取和代謝的能力。一般推薦臨床使用誘導劑量小于4 mg·kg-1安全有效[9]。
2.2 吸入麻醉藥
2.2.1 鹵化麻醉藥 Daizou等對行剖宮產的產婦進行研究[11],顯示分別吸入0.5%氟烷、1%恩氟烷、0.8%七氟烷和0.6%異氟烷進行麻醉誘導后,UV與MA血藥濃度之比分別為0.44、0.49、0.38和0.27,一旦使4種吸入麻醉藥的作用時間保持一致(13 min),顯示UV與MA血藥濃度比值均為0.4,提示其胎盤通透程度相似。Dwyer等進一步研究發現[12],比較吸入麻醉藥臍靜脈分壓(Puv)與產婦吸入氣體總壓力(Pi)的比值,顯示接受0.8%異氟烷麻醉誘導的產婦為0.32,而接受0.5%氟烷麻醉誘導的產婦為0.26,提示異氟烷比氟烷更容易吸收。
2.2.2 其他麻醉藥 對吸入麻醉藥的胎盤通透性研究數據非常匱乏,除了鹵化麻醉劑,目前臨床常用的氧化亞氮暫無人類胎盤轉運的藥代動力學數據,但顯示70%氧化亞氮能迅速通過胎盤屏障,應當嚴格限制麻醉誘導至分娩的時間。目前普遍采用的小劑量鹵化麻醉藥復合氧化亞氮維持麻醉,能夠降低氧化亞氮的抑制效應,同時降低鹵化麻醉藥引起的子宮收縮乏力[4]。一般推薦臨床使用低劑量(小于0.75 MAC)的吸入麻醉藥,能夠在保證新生兒安全的基礎上維持麻醉深度,且不增加術中及產后出血[9]。
2.3 麻醉性鎮痛藥
2.3.1 芬太尼 芬太尼靜脈給藥后,1 min內在胎兒血中能夠測到,5 min達到峰值,維持30~60 min。除非娩出前立即靜脈給予大劑量芬太尼(大于1 μg·kg-1),否則不會對新生兒產生明顯影響[4]。對硬膜外途徑給予芬太尼的剖宮產研究顯示[13],經硬膜外腔注射0.1 mg芬太尼,其分布半衰期為13.5 min,消除半衰期為192.5 min,MV血藥濃度為0.310 μg·L-1,UV 血藥濃度為 0.245 μg·L-1,UV 與 MV之比為0.892,提示芬太尼能迅速通過硬膜外腔吸收入血,其中約90%的藥物能迅速通過胎盤屏障。
2.3.2 瑞芬太尼 瑞芬太尼靜脈給藥后30 s起效,峰值效應時間1 min,作用時間持續3~5 min,半衰期3~5 min,停藥后迅速消除。對硬膜外麻醉復合瑞芬太尼的剖宮產研究顯示[14],以 0.1 μg·kg-1·min-1瑞芬太尼持續泵注,UV 與MA血藥濃度之比為0.88±0.87,提示瑞芬太尼極易通過胎盤屏障;UA與UV血藥濃度之比為0.29±0.07,提示瑞芬太尼在胎兒體內快速代謝或再分布,說明胎兒也具備代謝瑞芬太尼的能力。
2.4 肌肉松弛劑 肌肉松弛劑多為大分子量、低脂溶性、高解離度的藥物,臨床常用劑量未發現其通過胎盤屏障。去極化肌松藥琥珀膽堿(分子量397 u),非去極化肌松藥如維庫溴銨(分子量637 u)、羅庫溴銨(分子量609 u)、順苯磺酸阿曲庫銨(分子量1 243 u)等,臨床常用劑量均未觀察到明顯的新生兒抑制作用發生。
2.5 局部麻醉藥 各種局部麻醉藥物均能夠通過胎盤,主要受pKa、母體和胎兒pH以及蛋白結合率的影響[4]。與布比卡因和羅哌卡因相比,利多卡因在人體中pKa較低、蛋白結合率較低(70%),這樣的生化特性使其更加容易通過胎盤。研究顯示[15],以0.75%羅哌卡因和0.5%布比卡因分別行硬膜外阻滯,母體血藥濃度均在15~30 min內達高峰,UV與MV血藥濃度之比分別為0.42±0.12和0.48±0.15,遠低于可致中樞神經毒性反應的濃度。通過鞘內或硬膜外腔注射局部麻醉藥物,正常情況下很少吸收入血,對新生兒的影響可以忽略不計。
2.6 產科相關麻醉輔助藥物 大多數麻醉輔助用藥均容易通過胎盤屏障,母體給予麻黃堿、去氧腎上腺素、阿托品、抗組胺類藥物等均可轉運至胎兒[4]。臨床研究顯示,無論應用微泵持續輸注[16](麻黃堿維持4 g·L-1,去氧腎上腺素維持50 mg·L-1)或分次推注[17](麻黃堿每次 5 ~10 mg,去氧腎上腺素每次50~100 μg)的方式維持母體基礎血壓,顯示兩者對治療低血壓同樣有效,與麻黃堿組相比,去氧腎上腺素組的胎兒酸中毒發生率更低。
3 胎盤屏障通透性研究方法
3.1 人類研究
3.1.1 在體研究 上述測定胎兒與母體血藥濃度比(F/M ratio)的方法,能夠用來反映母體與胎兒循環中的血藥濃度情況。除此之外,通過獲取胎盤標本測定胎兒與胎盤血藥濃度比、母體與胎盤血藥濃度比,通過獲取羊水標本測定胎兒與羊水血藥濃度比、母體與羊水血藥濃度比,也能夠間接反映血藥濃度情況。
3.1.2 離體研究 包括胎盤子葉灌注模型(單側開放循環、雙側閉合循環)、滋養層組織培養等。
胎盤子葉灌注模型[18]選取剛娩出的、完整的健康人胎盤,用灌流液沖洗,模擬人體子宮內各種條件建立母體和胎兒的血液循環,在母體側灌流液中加入一定濃度的待測藥物,待平衡一段時間后,從胎兒側灌流液中抽取樣本,即可測得藥物的濃度以確定其胎盤通透性。
滋養層組織的研究樣本包括:胎盤切片、合體滋養層組織切片、微絨毛膜囊泡、亞細胞結構如微粒體等。前三者廣泛運用于評估藥物的胎盤通透性研究,而微粒體樣本多運用于研究藥物的代謝。
3.2 動物實驗
3.2.1 在體實驗 目前大多選擇在體血管插管法,能夠實時獲得動物母體與胎兒血藥濃度。選用犬類[19]、羊類[20]、靈長類[21]等體型較大的動物建立模型,將妊娠動物麻醉后行股動靜脈或頸動靜脈置管,同時對胎兒進行股動靜脈置管,待麻醉恢復動物蘇醒后,可于分娩時采集血樣行血藥濃度測定,能夠對動物的胎盤屏障通透性研究提供可靠的數據。
3.2.2 離體實驗 滋養層組織培養能夠研究藥物在胎盤組織中的吸收能力,間接反映胎盤通透性情況。植入后全胚胎培養方法將動物胚胎組織完整取出,暴露于不同的處理因素,一段時間后評估胚胎的各項數據及檢測指標。
3.3 影像學研究 研究認為,超聲造影技術中使用的造影劑在正常情況下不能透過胎盤屏障[22]。有學者運用實時超聲造影連續脈沖對比技術(CPS)合并SonoVue造影劑,利用造影劑與紅細胞相似的流變學特征,計算造影劑灌注的各種參數,實時評估胎盤血流灌注的情況[23]。還有學者運用PET和MRI配準技術[24],利用18F-FDG示蹤劑對待測藥物進行標記,通過全身顯影的方法將解剖與功能相結合,提供藥代動力學和藥效學的信息。
3.4 藥物濃度測定方法 科研及臨床廣泛應用的血藥濃度測定方法包括高效液相色譜法(HPLC)、氣相色譜法(GC)、色譜質譜聯用法(LC-MS,LC-MS/MS,GC-MS,GC-MS/MS)和熒光分光光度法等。由于以上方法只能提供時間點的藥物濃度信息,數據分散,容易造成信息丟失。有學者進行了實時監測呼氣中丙泊酚及其揮發性代謝物的可行性研究,利用質子遷移反應-質譜(PTR-MS)技術[25]和離子分子反應-質譜(IMR-MS)技術[26],研究呼氣中低濃度(ppb級)待測藥物的含量,無疑對無創靜脈麻醉藥物監測技術方面提供了全新的思路。
4 總結與展望
全身麻醉藥物對新生兒影響的研究是麻醉學、產科學、兒科學密切關注的話題。總結現有的研究結果發現,幾乎所有的全身麻醉藥物都能夠通過胎盤屏障,對新生兒產生潛在的神經毒性,在今后的研究中,應當以提供準確的全身麻醉藥物胎盤轉運的藥代動力學數據為目標,為評估準確的暴露時間和暴露劑量提供參考。隨著全身麻醉藥物在產科麻醉中應用的不斷增加,對全身麻醉藥物胎盤轉運情況的研究將在麻醉學、產科學和兒科學中發揮積極的作用,為指導臨床安全用藥提供重要參考。
[1]Uemura E,Levin E D,Bowman R E.Effects of halothane on synaptogenesis and learning behavior in rats[J].Exp Neurol,1985,89(3):520-9.
[2]許佩龍,劉 健,李雪飛,等.丙泊酚麻醉對新生大鼠海馬BDNF及Trk-B的影響[J].中國藥理學通報,2012,28(6):858-61.
[2]Xu P L,Liu J,Li X F,et al.Effects of propofol anesthesia on the expression of BDNF and Trk-B in hippocampus in neonatal rats[J].Chin Pharmacol Bull,2012,28(6):858-61.
[3]Mintz C D,Wagner M,Loepke A W.Preclinical research into the effects of anesthetics on the developing brain:promises and pitfalls[J].J Neurosurg Anesthesiol,2012,24(4):362-7.
[4]Morgan G E,Mikhail M S,Murray M J.摩根臨床麻醉學[M].1版,北京:人民衛生出版社,2009,731-43.
[5]Dunn P F.麻省總醫院臨床麻醉手冊[M].1版,天津:科技翻譯出版公司,2009,440-51.
[6]Riley E H,Fuentes-Afflick E,Jackson R A,et al.Correlates of prescription drug use during pregnancy[J].J Womens Health(Larchmt),2005,14(5):401-9.
[7]Sastry B V.Techniques to study human placental transport[J].Adv Drug Deliv Rev,1999,38(1):17-39.
[8]黃紹強.丙泊酚在產科麻醉中應用的爭議和進展[J].復旦學報醫學版,2009,36(4):499-502.
[8]Huang S Q.Propofol in obstetric anesthesia[J].Fundan Univ J Med Sci,2009,36(4):499-502.
[9]Datta S,Kodali B S,Segal S.Obstetric Anesthesia Handbook fifth edition[M].New York:Springer,2010.
[10]Kosaka Y,Takahashi T,Mark L C.Intravenous thiobarbiturate anesthesia for cesarean section[J].Anesthesiol,1969,31(6):489-506.
[11]Satoh D,Iwatsuki N,Naito M,et al.Comparison of the placental transfer of halothane,enflurane,sevoflurane,and isoflurane during cesarean section[J].J Anesthesia,1995,9(3):220-3.
[12]Dwyer R,Fee J P,Moore J.Uptake of halothane and isoflurane by mother and baby during caesarean section[J].Br J Anaesth,1995,74(4):379-83.
[13]Moisés E C,de Barros Duarte L,de Carvalho Cavalli R,et al.Pharmacokinetics and transplacental distribution of fentanyl in epidural anesthesia for normal pregnant women[J].Eur J Clin Pharmacol,2005,61(7):517-22.
[14]Kan R E,Hughes S C,Rosen M A,et al.Intravenous remifentanil:placental transfer,maternal and neonatal effects[J].Anesthesiology,1998,88(6):1467-74.
[15]王愛忠,張曉麗,包艷屏,等.羅哌卡因與布比卡因硬膜外阻滯用于產科麻醉的效果及母體和胎兒血藥濃度變化的比較[J].中華麻醉學雜志,2002,22(10):597-9.
[15]Wang A Z,Zhang X L,Bao Y P,et al.Clinical effect and placental transfer of epidural ropivacaine vs bupivacaine during for cesarean section[J].Chin J Anesthesiol,2002,22(10):597-9.
[16]王 猛,韓傳寶,錢燕寧.麻黃堿與去氧腎上腺素對腰麻剖宮產產婦及新生兒的影響[J].臨床麻醉學雜志,2010,26(8):664-6.
[16]Wang M,Han C B,Qian Y N.Effects of ephedrine and phenylephrine on maternal and infant outcomes during spinal anesthesia for cesarean delivery[J].J Clinical Anesthesiol,2010,26(8):664-6.
[17]周金萍,袁 飛,馬連軍,金原野.不同升壓藥物對剖宮產患者新生兒臍血pH的影響[J].中國藥業,2012,21(3):53-4.
[17]Zhou J P,Yuan F,Ma L J,Jin Y Y.Effects of different vasopressors on pH value of neonatal cord blood in cesarean section[J].China Pharmaceuticals,2012,21(3):53-4.
[18]孫谷韻,吳 暉,張 峻.人類胎盤藥物透過性實驗的研究進展[J].中國藥理學與毒理學雜志,2011,25(3):327-9.
[18]Sun G Y,Wu H,Zhang J.Progress in drug-transport across the human placenta[J].Chin J Pharmacol Toxicol,2011,25(3):327-9.
[19]李宏全,王俊東,于俊平,等.妊娠犬及其胎兒股動脈血管插管技術[J].中國獸醫學報,2002,22(1):68-9.
[19]Li H Q,Wang J D,Yu J P,et al.Maternal and fetal femoral artery catheterization of pregnant dogs[J].Chine J Veterinary Sci,2002,22(1):68-9.
[20]Musk G C,Netto J D,Maker G L,Trengove R D.Transplacental transfer of medetomidine and ketamine in pregnant ewes[J].Lab Anim,2012,46(1):46-50.
[21]Brambrink A M,Evers A S,Avidan M S,et al.Ketamine-induced neuroapoptosis in the fetal and neonatal rhesus macaque brain[J].Anesthesiology,2012,116(2):372-84.
[22]朱莉萍,李 銳,華 興,等.診斷性超聲造影對胎盤屏障通透性影響的實驗研究[J].中國超聲醫學雜志,2007,23(10):734-6.
[22]Zhu L P,Li R,Hua X,,et al.Effects of diagnostic contrast-enhanced ultrasound on placental barrier permeability:Experimental study[J].Chin J Ultrasound in Med,2007,23(10):734-6.
[23]Yuan M L,Li R.Evaluation of placental blood perfusion under different condition by real-time contrast-enhanced ultrasound[D].The Third Military Medical University,Chongqing,2010.
[24]Benveniste H,Fowler J S,Rooney W D,et al.Maternal-fetalin vivoimaging:a combined PET and MRI study[J].J Nucl Med,2003,44(9):1522-30.
[25]Harrison G R,Critchley A D,Mayhew C A,et al.Real-time breath monitoring of propofol and its volatile metabolites during surgery using a novel mass spectrometric technique:a feasibility study[J].Br J Anaesth,2003,91(6):797-9.
[26]Hornuss C,Wiepcke D,Praun S,et al.Time course of expiratory propofol after bolus injection as measured by ion molecule reaction mass spectrometry[J].Anal Bioanal Chem,2012,403(2):555-61.