抑癌基因PTEN與腫瘤血管生成研究進展
沈存思,范方田,陶 麗,陳文顯,2,王愛云,2,陸 茵,2
(1.南京中醫藥大學藥學院;2.江蘇省中藥藥效與安全性評價重點實驗室,江蘇南京 210023)
1997年由三個研究小組分別從10q23.3上定位克隆了同一種抑癌基因,并從各自角度給予了命名,稱為抑癌基因PTEN,另外也叫MMACI或TEP1。該基因自發現起就一直在腫瘤治療研究中受到重視和關注,如今已發現PTEN在腫瘤增殖,侵襲,遷移過程中發揮極其重要的作用。近年來,國內外愈來愈多的研究發現PTEN與腫瘤血管生成的關系十分密切,它可以通過激活PI3K信號通路,調控缺氧誘導因子1(HIF1),血管內皮生長因子(VEGF)等,起到抑制腫瘤血管生成的作用。本文就近年來關于抑癌基因PTEN在腫瘤血管生成中的作用及其分子調節信號通路進行的概述,期望對腫瘤血管抑制劑的研發及腫瘤血管生成機制的研究提供參考。
1 PTEN突變或缺失可引起腫瘤發生和發展
PTEN抑癌基因是雙特異蛋白磷酸酶家族(DSPs)的成員,具有脂質磷酸酶和蛋白酪氨酸磷酸酶活性[1],PTEN被發現在多數惡性腫瘤中缺失,突變或者被抑制。它的突變首先影響了PTEN磷酸酶區域并且導致許多疾病,如小腦發育不良性節細胞瘤,BRR綜合征,并增加了乳腺,甲狀腺,子宮等器官癌變發生[2]。隨著相關研究的不斷深入,近年來研究發現PTEN突變可以促進腫瘤血管生成導致腫瘤的發展。
2 抑癌基因PTEN調控腫瘤血管生成途徑促腫瘤的發展
PTEN的表達主要受miRNA(如miR-21),磷酸化,乙酰化,泛素化等轉錄后調控[3]。大量的研究表明,PTEN基因的缺失在腫瘤的發生發展中起到了重要的作用,而它對腫瘤的血管生成過程可以通過影響磷脂酰肌醇-3激酶(PI3K)/絲-蘇氨酸激酶(AKT)信號途徑來實現[4-5],主要過程是:PTEN通過其脂質磷酸酶活性,可逆轉PI3K的磷酸化作用,將磷脂酰肌醇-3磷酸(PIP3)的磷酸基團移除,使之還原成磷脂酰肌醇-2磷酸(PIP2),維持胞內低PIP3水平。到目前已有大量的實驗研究報道了PTEN對腫瘤血管生成過程部分關鍵信號都有調控作用,下面分別進行闡述。
2.1 PTEN與HIF1信號的關系 HIF1與腫瘤血管生成密切相關,腫瘤的發展開始被限制在1~2 mm3是由于供氧,供能不足,腫瘤在低氧狀態下會優先首先觸發血管生成機制HIF1信號通路,它是血管生成信號途徑的關鍵性的轉錄調控因子[6]。在研究中發現PTEN在膠質母細胞瘤中有抑制HIF1的穩定以及它的轉錄因子活性。此外,一些研究報道在腎透明細胞癌中,HIF1通路中2個重要的調控者VHL和PTEN基因都會有相伴性的丟失[7-8]。另外又有研究證明了在卵巢腫瘤細胞中PTEN表達上調會導致HIF1α,VEGF,和增殖細胞核抗原表達的下調[9]。胃癌的微陣列芯片分析實驗顯示PTEN的表達與VEGF以及MMPs的表達呈現負相關[10],在一些胰腺癌中,miR-21對于提高VEGF和MMPs的表達也有著重要作用,而這些影響通過PI3K抑制劑治療有可能被消除[11]。更廣泛的細胞系(如PC-3,HepG2等細胞)進行的相關實驗[12-13]也得到了類似的結果,綜合上述實驗提示,PTEN影響腫瘤血管生成的機制之一有可能是通過調控PI3K通路影響來HIF1信號進而調控VEGF的表達,基于這一點,基于HIF1信號途徑為靶點的腫瘤血管生成的藥物研究應考慮對PTEN的調控。
2.2 PTEN對血管生成中Ang/Tie2體系的影響 Ang/Tie2(促血管生成素/血管緊張素2)體系在腫瘤血管生成也起到了重要的作用。該途徑主要作用機制:VEGF會引起血管的出芽生長,但此時血管腔不完整,通透性高,缺少周細胞等。Ang1的表達增高后,能夠募集周細胞和平滑肌細胞等使血管穩定。Ang2則起到雙重作用,既可阻斷Ang1的血管穩定作用,導致血管床退化,血管外基質降解。還可促進血管新生,其機制可能是Ang2結合Tie2,抑制Ang1的活性,誘導血管旁細胞從內皮細胞上分離,增加內皮細胞的凋亡。Ang2的活化導致腫瘤血管數量的大規模減少和血管直徑增大。血管的減少導致缺氧,進而上調腫瘤細胞 VEGF的表達,導致腫瘤的周圍明顯的血管生成[14]。另外也有研究報道VEGF被抑制后,Ang1/tie2有利于腫瘤的生長以及血管生存[15]。近年相關研究發現Ang-1刺激Tie-2觸發了PI3K通路的激活[16]。初步揭示了Ang/Tie-2體系與PI3K通路的關聯性。另外,有相關研究報道稱脫落的Tie2受體能與Ang-1和Ang-2結合,從而抑制Tie2的磷酸化作用以及激活,而這一過程的調控是通過VEGF依賴性的PI3K通路激活來實現的,并證明 PTEN的過表達增加了 Tie-2的釋放[17]。該研究進一步提示了是PTEN可能調控了Ang/Tie-2體系,進而影響腫瘤血管生成,并且VEGF是該途徑的一個重要參與者。因此,以Ang/Tie靶向治療腫瘤血管生成的藥物也應考慮到PTEN的影響因素。
2.3PTEN與鈉氫交換調控因子1(NHERF1)的關系 鈉氫交換調控因子1(NHERF1)是一種氨基酸組成的多功能連接蛋白,其分布位置與表達水平將決定其功能。當其位于細胞膜上,可能表現為一個腫瘤抑制因子。當其處于細胞質中,可能成為致癌蛋白,其功能機制主要是通過調控血小板衍生因子(PDGF)、外向整流氯離子通道(ORCC)等信號通路等促進腫瘤發生以及腫瘤血管生成[18]。PTEN定位在細胞內部也是PTEN調控作用的一部分,因為在細胞膜上缺損PTEN的轉位會削弱它對PI3K的信號的控制[19-20]。另外一些研究發現鏈接蛋白NHERF1與細胞膜上PTEN轉位是有關聯的。它們也證實了缺損PTEN的轉位會導致持續的Akt激活。有研究發現NHERF1能夠引起一些受體酪氨酸激酶(RTK)間的相互作用,例如 PDGFR,EGFR[21],它們都在腫瘤血管生成中發揮著重要作用,PTEN可能通過影響NHERF1的途徑干預腫瘤血管生成過程,另外有研究發現PTEN在細胞膜上的轉位不僅僅與RTK下游信號的調控有關,還與自身的表達調控相關[22],可作為一個新的腫瘤血管生成研究切入點進行深入探究。
2.4 PTEN對血管內皮細胞(EC)的影響 血管內皮細胞在腫瘤血管生成中起到起關鍵作用,腫瘤組織新生血管需要募集血管內皮細胞,包括鄰近已有的內皮細胞出芽,增殖和遷移經過重塑形成的腫瘤血管,或者腫瘤細胞自身形變貼附血管壁發生血管生成擬態以及骨髓源性內皮祖細胞整合到局部腫瘤血管分化為成熟內皮細胞。PTEN對內皮細胞的行為也具有調控作用。一些實驗表明在大部分的細胞基質和內皮細胞中擾亂PTEN的表達,這樣能夠減少PTEN信號在內皮細胞中PI3K的激活,并導致了內皮細胞增殖,生存以及遷移能力的增加,這些變化往往都是腫瘤血管生成重要因素及標志[23]。此外最近有相關研究也顯示PTEN可能影響到內皮細胞的周期[24],進而影響其分化增殖。該相關研究表明在腫瘤血管生成過程中,PTEN對內皮細胞在腫瘤血管生成中的行為的影響不僅是間接的,還有可能使是直接的作用。
2.5PTEN與內皮一氧化氮合成酶(eNOS)、NO關系 近年的研究表明[25],eNOS來源的NO參與了腫瘤新生血管的生成,有文獻報道eNOS在腫瘤組織中有廣泛的表達。并通過生成NO來調節內皮細胞的狀態以及骨髓內皮祖細胞(EPC)的動員和歸巢[26]。NO在血管生成中也促成了脈管膨脹。又有人通過eNOS的基因敲除或抑制其活性,抑制了外周血管內皮祖細胞的歸巢以及腫瘤新生血管的生成[27],也再次驗證了氧化產物在腫瘤血管生成中的重要性。有文獻報道了在腫瘤細胞以及內皮細胞中,PTEN都參與了eNOS的調控,另外又有證明VEGF誘導的內皮NO產物能維持急性髓細胞白血病細胞的生長,并且發生機制涉及到 PI3K通路[28]。上述研究揭示了癌細胞和內皮細胞中PTEN與內皮含氮氧化物合酶調控是相關的,并且影響到了腫瘤血管生成,進一步的作用機制有待探究。
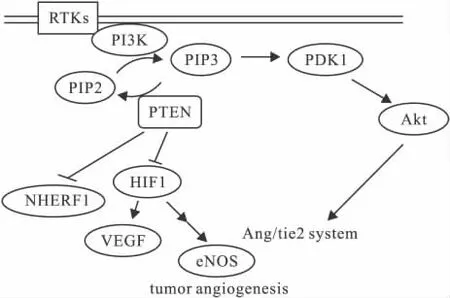
Fig 1 PTEN participates in regulation of tumor angiogenesis
3 PTEN與腫瘤的抗血管生成治療
綜上所述,PTEN與多種影響腫瘤血管生成的因素相關,盡管PI3K途徑被認為在腫瘤血管生成中是一個重要的信號調控節點,而PTEN對PI3K的信號又起到了重要的調控因素,從而與PI3K具有同等調控腫瘤血管生成的作用,也被視為調控腫瘤血管生成的一個關鍵節點。目前,臨床上針對腫瘤血管生成的治療主要集中在對抗VEGF,EGF等信號的過度活化,例如單克隆抗體針對VEGF-A如貝伐單抗,VEGFR的絡氨酸酶抑制劑如索拉菲尼。然而長期治療會出現腫瘤耐藥的問題。這些耐藥性機制通常與VEGF,bFGF或EGF誘導HIF-1和PI3K信號通路相關[29-30]。值得注意的是臨床研究證實腫瘤細胞對抗抗EGFR治療的效果與PTEN相關,并且抗EGFR治療效果與PTEN表達量呈正相關。這為EGFR耐藥的問題提供了新的思路[31-32]。與此同時,臨床研究還發現MMPs的過表達是耐藥的又一機制,而PTEN和MMPs表達也呈負相關,因此此類抗TKI的耐藥也可能通過上調PTEN解決。目前抗酪氨酸激酶抑制劑(TKI)耐藥的研究熱點主要集中在PI3K,AKT和mTOR抑制劑,但均處于臨床試驗階段[33-34]。但是目前為止沒有發現PTEN的誘導劑進入臨床試驗研究,慶幸的是針對PTEN的基因治療已處實驗階段,有報道野生型PTEN轉染到人類前列腺癌細胞,可以減少腫瘤血管生成[35]。雖然這項工作是一個巨大的挑戰,卻能為抗TKI耐藥帶來希望。
4 結語與展望
腫瘤血管生成是在腫瘤發生發展過程中的一個關鍵因素。抗腫瘤血管生成是目前抗腫瘤治療其中一個重要的有效的手段。抑癌基因PTEN自發現以來一直作為抗腫瘤研究中一個重要的研究對象,隨著國內外對PTEN與腫瘤關系研究的不斷深入,逐步發現了PTEN與腫瘤血管生成機制中關鍵因素HIF1﹑VEGF﹑Ang/Tie-2體系﹑NHERF1、EC以及eNOS等都有著密切聯系,從而綜合調控影響了腫瘤血管的新生,但是目前的研究也存在一些問題,PTEN調控因素較多,被影響的這些分子信號相互關系網絡復雜,它們是否具有更深層次的關聯性尚不十分明確,有待更深入研究。本文通過對于近年來PTEN與腫瘤血管生成關系較全面的綜述,PTEN很可能成為治療靶點,應用于研究腫瘤抗血管生成機制以及抗腫瘤血管生成相關藥物的研發中,為癌癥的治療提供一個新的可行途徑。
[1]劉倫華,樓麗廣.PTEN功能調節的研究進展[J].中國藥理學通報,2005,21(7):778-81.
[1]Liu L H,Lou L G.Recent advance in the regulation of PTEN’s function[J].Chin Pharmacol Bull,2005,21(7):778-81.
[2]Wang X,Jiang X.Post-translational regulation of PTEN[J].Oncogene,2008,27(41):5454-63.
[3]Meng F,Henson R.Wehbe-Janek H.MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer[J].Gastroenterol,2007,133(2):647-58.
[4]許成芳,李小毛,李 田,等.紫杉醇對PTEN不同狀態的子宮內膜癌細胞株的作用及其機制探討[J].中國藥理學通報,2011,27(11):1528-32.
[4]Xu C F,Li X M,Li T,et al.The effect of taxol on endometrial cancer cells with different PTEN status[J].Chin Pharmacol Bull,2011,27(11):1528-32
[5]Maehama T,Taylor G S.Dixon J E.PTEN and myotubularin:novel phosphoinositide phosphatases[J].Annual Review of Biochemistry,2001,70:247-79 .
[6]Sonveaux P,Copetti T,De Saedeleer C J,et al.Targeting the lactate transporter MCT1 in endothelial cells inhibits lactate-induced HIF-1 activation and tumor angiogenesis[J].PLoS One,2012,7(3):e33418.
[7]Von Teichman A,Comperat E,Behnke S,et al.VHL mutations and dysregulation of pVHL-and PTEN-controlled pathways in multilocular cystic renal cell carcinoma[J].Modern Pathol,2010,24(4):571-8.
[8]Frew I J,Thoma C R,Georgiev S,et al.pVHL and PTEN tumour suppressor proteins cooperatively suppress kidney cyst formation[J].EMBO J,2008,27(12):1747-57.
[9]Takei Y,Saga Y,Mizukami H,et al.Overexpression of PTEN in ovarian cancer cells suppresses i.p.dissemination and extends survival in mice[J].Mol Cancer Ther,2008,7(3):704- 11.
[10]Zheng H,Takahashi H,Murai Y,et al.Expressions of MMP-2,MMP-9 and VEGF are closely linked to growth,invasion,metastasis and angiogenesis of gastric carcinoma[J].Anti Res,2007,26(5):3579-83.
[11]Sekuklu S D,Donoghue T A,Spillane C.miR-21 as a key regulator of oncogenic processes[J].Biochemical Society Transactions,2009,37(4):918-25.
[12]Fang J,Ding M,Yang L,et al.PI3K/PTEN/AKT signaling regulates prostate tumor angiogenesis[J].Cellular Signalling,2007,19(12):2487-97.
[13]Tian T,Nan K J,S.Wang S H,et al.PTEN regulates angiogenesis and VEGF expression through phosphatasedependent and-independent mechanisms in HepG2 cells[J].Carcinogenesis,2010,31(7):1211-9.
[14]Wu X,Liu N.The role of Ang/Tie signaling in lymphangiogenesis[J].Lymphol,2010,43(2):59-72.
[15]Huang J,Bae J,Tsai J P.Angiopoietin-1/tie-2 activation contributes to cascular survival and tumor growth during VEGF blockade[J].Int J Oncol,2009,34(1):79-87.
[16]DeBusk L M,Hallahan D E,Lin P C.Akt is a major angiogenic mediator downstream of the Ang1/Tie2 signaling pathway[J].Exp Cell Res,2004,298(1):167-77.
[17]Findley C M,Cudmore M J,Ahmed A,et al.VEGF induces Tie2 shedding via a phosphoinositide 3-kinase/Akt-dependent pathway to modulate Tie2 signaling[J].Arterioscler Thromb Vasc Biol,2007,27(12):2619-26.
[18]Theisen C S,Wahl J K 3rd,Johnson K R,et al.NHERF lnks the N-Cadherin/Catenin complex to the platelet-derived growth factor receptor to modulate the actin cytoskeleton and regulate cell motility[J].Mol Biol Cell,2007,18(4):1220-32.
[19]Vazquez F,Devreotes P.Regulation of PTEN function as a PIP3 gatekeeper through membrane interaction[J].Cell Cycle,2007,5(14):1523-7.
[20]Molina J R,Morales F C,Hayashi Y,et al.Loss of PTEN binding adapter protein NHERF1 from plasma membrane in glioblastoma contributes to PTEN inactivation[J].Cancer Res,2010,70(17):6697-703.
[21]Takahashi Y,Morales F C,Kreimann E L,et al.PTEN tumor suppressor associates with NHERF proteins to attenuate PDGF receptor signaling[J].EMBO J,2007,25(4):910 –920.
[22]Vivanco I,Rohle D,Versele M,et al.The phosphatase and tensin homolog regulates epidermal growth factor receptor(EGFR)inhibitor response by targeting EGFR for degradation[J].Proc National Acad Sci United States Am,2010,107(14):6459-64.
[23]Trimboli A J,Cantemir-Stone C J,Li F,et al.Pten in stromal broblasts suppresses mammary epithelial tumours[J].Nature,2009,461(7267):1084-91.
[24]Tarnawski A S,Pai R,Tanigawa T,et al.PTEN silencing reverses aging-related impairment of angiogenesis in microvascular endothelial cells[J].Biochem Biophys Res Commun,2010,394(2):291-6.
[25]Fukumura D,Kashiwagi S,Jain R K.The role of nitric oxde in tumor progression[J].Nat Rev Cancer,2006,6(6):521-34.
[26]Beleslin-Cokic B B,Cokic V P,Yu X,et al.Erythropoietin and hypoxia stimulate erythropoietin receptor and nitric oxide production by endothelial cells[J].Blood,2004,104(7):2073-80.
[27]Lim K H,Ancrile B B,Kashatus D F,et al.Tumor maintenance is mediated by eNOS[J].Natue,2008,452(7187):646-9.
[28]Church J E,Qian J,Kumar S,et al.Inhibition of endothelial nitric oxide synthase by the lipid phosphatase PTEN[J].Vascular Pharmacol,2010,525(6):191-8.
[29]Alessi P,Leali D,Camozzi M,et al.Anti-FGF2 approaches as a strategy to compensate resistance to anti-VEGF therapy:long-pentraxin3 as a novel antiangiogenic FGF2-antagonist[J].European Cytokine Network,2009,20(4):225-34.
[30]Shi Y H,Bingle L,Gong L H,et al.Basic FGF augments hypoxia induced HIF-1-alpha expression and VEGF release in T47D breast cancer cells[J].Pathol,2007,39(4):396-400.
[31]Martinelli E,Troiani T,Morgillo F,et al.Synergistic anti-tumor activity of sorafenib in combination with epidermal growth factor receptor inhibitors in colorectal and lung cancer cells[J].Clin Cancer Res,2010,16(20):4990-5001.
[32]Cohen E E,Davis D W,Karrison T G,et al.Erlotinib and bevacizumab in patients with recurrent or metastatic squamous-cell carcinoma of the head and neck:a phase Ⅰ/Ⅱ study[J].The Lancet Oncol,2009,10(3):247-57.
[33]Engelman J A.Targeting PI3K signalling in cancer:opportunities,challenges and limitations[J].Nature Rev Cancer,2009,9(8):550-62.
[34]Marone R,Cmiljanovic V,Giese B,et al.Targeting phosphoinositide 3-kinase—moving towardstherapy[J].Biochim Biophys Acta,2008,1784(1):159-85.
[35]Anai S,Goodison S,Shiverick K,et al.Combination of PTEN gene therapy and radiation inhibits the growth of human prostate cancer xenografts[J].Human Gene Therapy,2006,17(10):975-84.