釀酒酵母GSH I基因的克隆、表達與結構分析
宋冬梅,朱益波,周麗麗,鄭麗雪,齊 斌,*
(1.吉林農業大學,食品科學與工程學院,吉林長春130118;2.常熟理工學院發酵工程技術研究中心,蘇州食品生物技術重點實驗室,江蘇常熟215500)
谷胱甘肽(glutathione,GSH)是在γ-谷氨酰半胱氨酸合成酶(GSH I)和谷胱甘肽合成酶(GSHⅡ)的連續催化下合成的含巰基活性三肽,具有解毒、抗氧化和抗衰老等重要的生理功能[1-3],在食品、醫藥和生物等領域有著廣泛地應用[4-7]。但是我國GSH的生產滿足不了市場的需求。近年來,GSH生產研究的熱點是利用DNA重組技術構建高產GSH的重組菌。Murata等[8]構建了具有較高GSH催化活性的重組 Escherichia coli。沈立新等[9]構建了含 GSH I及GSHⅡ基因的質粒pTrc-gsh,并在E.coli中得到了活性表達。Liao等[10]構建的E.coli GSH I和GSH Ⅱ基因融合表達質粒,提高了胞內GSH含量。這些研究在一定程度上提高了重組菌GSH的產量,但總的來說都不理想。GSH I是GSH合成途徑的關鍵酶和限速酶[11],構建高GSH I活性的菌株將有助于提高重組菌GSH的產量。本文從實驗室保存的一株高產GSH的Saccharomyces cerevisiae 2-10515出發,采用PCR技術擴增得到GSH I基因,并在E.coli中實現表達,同時利用生物信息學方法對GSH I基因序列和結構進行分析和預測,為進一步提高GSH I表達量和活性提供理論依據。
1 材料與方法
1.1 材料與儀器
S.cerevisiae 2-10515、E.coli JM109、E.coli BL21(DE3)、質粒pET-28a 本實驗室保藏;DNA限制性內切酶Sac I和HindⅢ、Taq DNA聚合酶、T4 DNA Ligase、pMD19-T 載體、DNA Marker、質粒小量提取試劑盒、DNA純化及膠回收試劑盒等 TaKaRa公司;其他試劑 均為國產分析純;YEPD培養基、LB培養基 配方見文獻[12]。
高速臺式離心機Legend Micro 17R Thermo公司;PCR儀、Gel Doc XR、水平電泳系統、垂直電泳系統、凝膠電泳成像儀 Bio-RAD公司;恒溫金屬浴Eppendorf公司;SW-CJ-ZF凈化工作臺 蘇州凈化設備有限公司;恒溫培養箱 太倉市華美生化儀器廠;電子天平 Mettler公司。
1.2 實驗方法
1.2.1 引物設計 根據Gene bank里已公布的S.cerevisiae S288c的gsh I基因設計引物,分別在上游和下游引物中引入酶切位點Sac I和HindⅢ:
P1(Forward):CACGAGCTCATGGGACTCTTAGCTTT酶切位點Sac I
P2(Reverse):CCCAAGCTTTTAACATTTGCTTTCTA酶切位點HindⅢ
1.2.2 克隆載體的構建 采用周小玲等人[13]的方法提取S.cerevisiae 2-10515的基因組 DNA,以其為模板,P1和P2為引物進行PCR擴增,得到gsh I基因。PCR 反應參數為:95℃ 5min;94℃ 30s,58℃ 30s,72℃ 2min(30cycles);72℃ 10min。將gsh I連接到克隆載體pMD19-T上,構建克隆質粒 pMD19-T-gsh I,并轉化E.coli JM109,得到E.coli JM109(pMD19-T-gsh I),提取克隆質粒進行酶切驗證,送上海生工生物有限公司測序。
1.2.3 E.coli重組表達載體的構建 分別用限制性內切酶Sac I和HindⅢ酶切克隆質粒pMD19-T-gsh I和質粒pET-28a,酶切產物經膠回收純化,16℃連接過夜,轉化E.coli DH5α。抽提重組質粒,經酶切驗證后測序。
將重組表達質粒 pET-28a-gsh I熱激轉化到E.coli BL21(DE3)。
1.2.4 GSH I的誘導表達 挑取單菌落接入LB培養基(含100mg/mL Amp),37℃培養至 OD550為 0.5左右時,在34℃,IPTG(0.1mmol/L)條件下,誘導表達。
1.2.5 SDS-PAGE檢測 按《分子克隆》[14]操作說明進行SDS-PAGE電泳后,考馬斯亮藍R-250染色,脫色過夜,觀察結果。
1.2.6 GSH I酶活性的測定 取5mL培養液12000×g離心5min,棄上清,用50mmol/L,pH7.0的磷酸緩沖液洗滌,離心后收集菌體。用同樣的磷酸緩沖液4mL懸浮菌體后超聲波破碎[15],加入GSH前體反應液(谷氨酸、甘氨酸和半胱氨酸濃度均為40mmol/L,MgCl2和ATP濃度均為50mmol/L,GSH I濃度為2g/L)4mL,37℃反應 30min,沸水浴 2min以終止反應,用ALLOXAN試劑法[16]測GSH的生成量。酶活力單位(U)定義為37℃,pH7.0條件下,每分鐘催化合成1μg GSH所需的酶量。
1.2.7 GSH I的結構分析 利用DNAMAN軟件推導出目的基因的氨基酸序列,分析其與Gene bank數據庫中其它物種同源蛋白氨基酸序列的一致性。
通過蛋白分析專家系統(ExPASy,http://ca.expasy.org/)提供的分析工具分別預測蛋白質的理化性質、一級結構和二級結構。
利用3D-JIGSAW模擬GSH I的三級結構。
2 結果與分析
2.1 基因克隆
以S.cerevisiae 2-10515基因組DNA為模板進行PCR擴增反應,擴增產物純化后電泳結果見圖1。圖1顯示:目的條帶在2000bp附近,與預計的條帶大小相吻合。
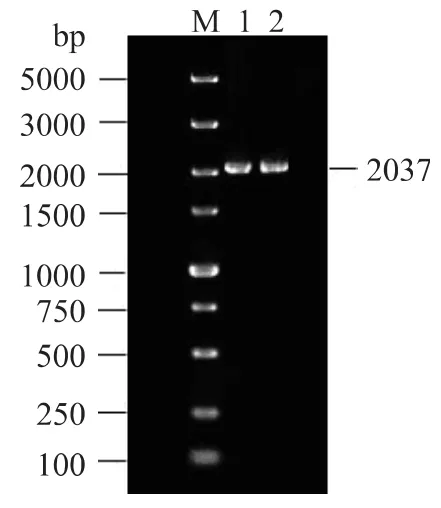
圖1 gsh I基因的PCR純化產物Fig.1 PCR purification product of gsh I
2.2 重組表達載體的構建
成功構建的表達載體pET-28a-gsh I的結構示意圖如圖2。將其用Sac I和HindⅢ酶切鑒定,結果如圖3。經酶切的重組質粒含有單一的約2Kb插入片段,這表明gsh I基因已插入質粒pET-28a中。測序結果證明閱讀框插入位點正確。
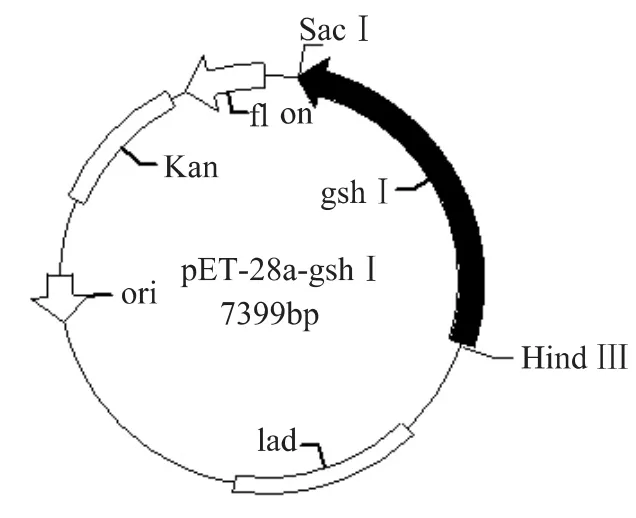
圖2 重組表達載體pET-28a-gsh I結構示意圖Fig.2 Construction of recombinant expression plasmid pET-28a-gsh I simple

圖3 重組質粒pET-28a-gsh I/Sac I+HindⅢ酶切鑒定Fig.3 pET-28a-gsh I digested by Sac I and Hind Ⅲ
2.3 SDS-PAGE電泳分析
SDS-PAGE電泳后考馬斯亮藍染色,脫色過夜,觀察結果如圖4所示:2、3、4泳道與陰性對照(1泳道)相比,在81Ku附近有一條明顯的蛋白條帶,除去載體上的his-tag(分子量約為3ku),其實際的蛋白質分子量約為78ku,與預測的GSH I蛋白大小相符,很可能為表達的GSH I蛋白,該蛋白以融合蛋白的形式存在。
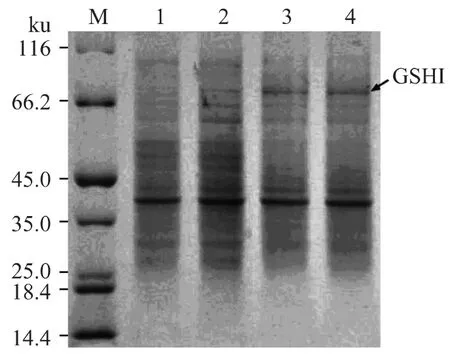
圖4 SDS-PAGE分析圖譜Fig.4 SDS-PAGE analysis of expression products
2.4 酶活力的測定
重組菌的GSH I活力測定結果見圖5,34℃誘導4h時,其活力達到46.09U/mg濕菌,隨著誘導時間的延長,GSH I活力并沒有增加,最佳誘導時間為4h。優化各種表達條件,酶活力無明顯改善。
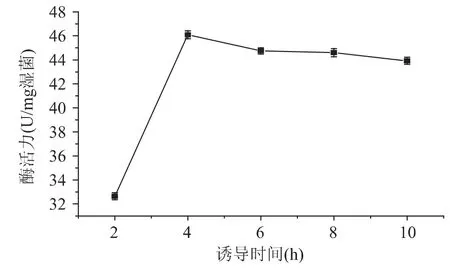
圖5 重組菌GSH I酶活力曲線Fig.5 GSH I enzymatic activity curve of recombinant strain
2.5 GSH I基因的結構分析
2.5.1 Blast分析結果 該基因全長為2037bp,編碼678個氨基酸。對GSH I氨基酸序列進行同源多重序列比對(如圖6)發現:序列中部為保守序列,其關鍵氨基酸都在該保守序列中;與Gene bank中S.cerevisiae S288c、Macaca mulatta、Musmusculus、Branchiostoma floridae同源基因的氨基酸序列一致性分別為99%、42%、42%、41%。

圖6 GSH I的Clustal多重序列比對Fig.6 Multiple alignment of GSH I by Clustal
2.5.2 GSH I蛋白質的理化性質 利用ExPASy中ProtParam預測GSH I的理論分子量為78281.6u;等電點為5.87;含有9個半胱氨酸;其中第164位和第642位半胱氨酸有形成二硫鍵的可能性;該蛋白質的性質不穩定,在溶液中的不穩定指數為42.19,高于閾值40;脂溶性指數為77.52;親水指數(GRAVY)為-0.507,為親水性蛋白。其成熟肽N端為蛋氨酸時,在哺乳動物網狀紅細胞體外表達的半衰期為30h,在酵母和大腸桿菌中表達的半衰期分別為20、10h。
2.5.3 GSH I的二級結構 利用ExPASy中PredictProtein分析蛋白的拓撲結構和二級結構,該蛋白沒有信號肽,為非分泌蛋白;在253~272aa、285~308aa和484~511aa處有三個跨膜區;α-螺旋∶延伸鏈:β-折疊∶無規則卷曲 =35.10∶16.52∶8.85∶39.53,表明蛋白質二級結構的主要結構元件是α-螺旋和無規則卷曲,具有較多的無規則卷曲,不利于其穩定;mRNA的二級結構在起始密碼子處形成發卡結構。
2.5.4 GSH I的三級結構 將GSH I的氨基酸序列提交到3D-JIGSAW服務器預測GSH I三級結構,用Pymol軟件打開,如圖7所示,發現酶結構較松散,側鏈間相互作用不強,這與ProtParam的預測結果相一致。
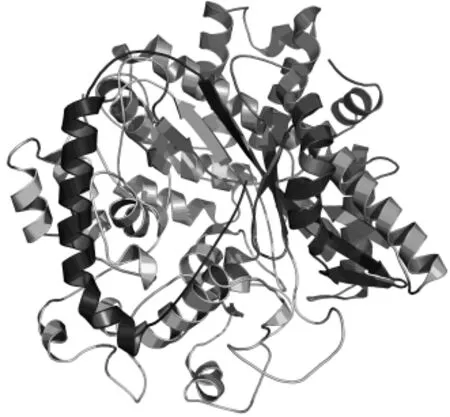
圖7 GSH I三級結構圖Fig.7 3D structure of GSH I
3 結論與討論
已有學者在S.cerevisiae和Pichia pastoris中表達了 GSH I[17-18],但這些報道中 GSH I 的表達量不高,酶活力也較低,使得構建好的菌株無法達到工業化生產的要求。S.cerevisiae是高產GSH的菌株,將其GSH I在E.coli中表達,有望構建高活性的GSH I重組菌,為工業化生產GSH奠定基礎。本研究成功克隆了S.cerevisiae 2-10515的gsh I基因,將編碼GSH I的基因定向克隆到pET-28a載體上,構建了重組菌株 E.coli BL21(DE3)/pET-28a-gsh I,34℃ 誘導 4h時,活力達到 46.09U/mg 濕菌,高于 Fan[17]、饒志明[18]等構建的重組菌株。
利用生物信息學方法分析S.cerevisiae 2-10515 GSH I序列可知:a.gsh I基因轉錄出的mRNA在5'端起始部位區形成了發卡結構,有研究證實這種發卡結構會遮蔽SD序列和起始密碼子部位能阻止30s核糖體亞基的結合,從而減慢翻譯起始頻率[19],降低相應蛋白質的表達量。B.GSH I在溶液中的不穩定指數為 42.19,高于閾值 40;GSH I親水指數為-0.507,為親水性蛋白;該酶分子中含有較多的無規則卷曲,結構比較松散。這些都說明GSH I穩定性較差[20],不利于活性的提高。所以,從基因水平對S.cerevisiae 2-10515進行分子改造能進一步提高該酶的表達量和活性。
Huang[21]通過對 mRNA 結構的改造,消除了起始密碼子附近mRNA的二級結構,從而提高了木聚糖酶的表達量;Jeong[22]、Mahadevan[23]等通過同源建模及結構分析,利用定點突變增加了酶的穩定性。這些研究都為后續對S.cerevisiae GSH I分子改造提供了很好的基礎。本文在 E.coli中成功表達了S.cerevisiae來源的GSH I,為工業應用奠定了基礎;并對其進行了初步的生物信息學分析,為后續研究指明了方向。
[1]Grill E,L?ffler S,Winnacker E L,et al.Phytochelatins,the heavy metal binding peptides of plants,are synthesized from glutathionebyaspecific γ-glutamylcysteine dipeptidyl transpeptid-adse(phytochelatin synthase)[J].Proc Natl Acad Sci USA,1989,86:6838-6840.
[2] MeisterA.Glutathione metabolism and its selective modification[J].Biol Chem,1988,263:27205-27208.
[3]Sanchez-Femandez R,Fricker M,Corben L B,et al.Cell proliferation and hair tip growth in the Arabidopsis root are under mechanistically different forms of redox control[J].Proc Natl Acad Sci USA,1997,94:2745-2750.
[4]楊培慧,齊劍英.谷胱甘肽的應用及其檢測方法[J].中國生化藥物雜志,2002,23(1):52-54.
[5]冮潔,單立峰.谷胱甘肽的制備及其應用[J].飼料工業,2007,28(15):15-17.
[6]周宇光,付國平,肖仔軍.谷胱甘肽的生產和應用研究進展[J].食品工業科技,2003,24(3):89-91.
[7]Spector D,Laban J,Toledanom B.A genetic investigation of the essential role of glutathione[J].Biol Chem,2001,276(10):7011-7016.
[8]Murata K,Miya T,Gushima H,et al.Cloning and amplification of a gene for glutathione synthetase in E.coli B[J].A gric Biol Chem,1982,47:1381-1383.
[9]沈立新,魏東芝,趙哲峰,等.谷胱甘肽合成酶系的克隆、測序與表達[J].生物工程學報:2001,17(1):98-100.
[10]Liao X Y,Shen W,Chen J.Improved glutathione production by gene expression in Escherichia coli[J].Letters in Applied Microbiology,2006,43:211-214.
[11]Ohtake Y,Watanabe K,Tezuka H,et al.Expression of glutathione synthetase gene of Escherichia coli B in Saccharomyces cerevisiae[J].J Ferment Bioeng,1989,68(6):390-394.
[12]黃培堂 .分子克隆實驗指南[M].北京:科學出版社,2005.
[13]周小玲,沈微,饒志明,等.一種快速提取真菌染色體DNA 的方法[J].微生物學通報,2004,31(4):89-92.
[14]Sambrook J,E F Fritsch,T Maniatis.Molecular cloning:A laboratory manual(Second edition)[M].NY:Cold spring harbor laboratory,1989.
[15]沈立新,魏東芝,趙哲峰,等.谷胱甘肽合成酶在大腸桿菌中的高效表達及性質[J].華東理工大學學報,2000,26(4):342-345.
[16]李從軍,謝愛娣.酵母提取液中谷胱甘肽定量測定方法的比較[J].食品發酵工業,2010,36(7):158-162.
[17]Fan XY,He XP,Guo XN,et al.Increasing glutathione formation by functional expressing of the γ-glutamylcysteine synthetase gene in Saccharomyces cerevisiae[J].Biotechnol Lett,2004,26(5):415-417.
[18]饒志明,艾麗靜,沈微,等.gsh I基因的克隆及其在巴斯德畢赤氏酵母中的表達[J].應用與環境生物學報,2007,13(2):257-260.
[19]Cruz-Vera L R,Magos-Castro M A,Zamora-Romo E,et al.Ribosome stalling and peptidyltRNA drop- off during translational delay at AGA codons[J].Nucleic Acids Res,2004,32(15):4462-4468.
[20]王大成.蛋白質工程[M].北京:化學工業出版社,2002.
[21]Huang H Q,Yang P L,Luo H Y,et al.Hingh-level expressin of a truncated 1,3-1,4-β-D-glucanase from Fibrobacter succinogenes in Pichia pastoris by optimization of codons and fermentation[J].Appl Microbiol Biotechnol,2008,78(1):95-103.
[22]Jeong M Y,Kim S,Yun C W,et al.Engineering a denovo internal disulfide bridge to improve the thermal stability of xylanase from Bacillus stearothermophilus No.236[J] .J Biotechnol,2007,127(2):300-309.
[23]Mahadevan S A,Wi S G,Lee D S,et al.Site-directed mutagenesisand CBM engineering ofCel5A(Thermotoga maritima)[J].FEMS Microbiol Lett,2008(2):205-211.

