十二烷醇對酵母細胞影響的研究
楊 攀,袁永俊,*,王 健,胡麗麗,代亞民,代 斌
(1.西華大學生物工程學院,四川成都610039;2.四川省產品質量監督檢驗檢測院,四川成都610031)
固定化酵母又叫固定化活細胞或固定化增殖細胞,是指用適當的載體材料和科學的方法將活酵母固定在載體上,使該細胞能在適宜的條件下不斷生長繁殖,從而能促使有機物質連續地進行反應[1]。固定化酵母細胞的應用,使乙醇萃取發酵得到迅速的發展。Minier和 Coma較早提出了乙醇發酵的方案[2],他們將酵母細胞固定化,并在培養基中加入十二烷醇進行內部隨程萃取發酵,結果葡萄糖轉化比較徹底,乙醇產率也比較高。本研究在游離酵母細胞和固定化酵母細胞中加入十二烷醇萃取劑,并通過測定內部隨程發酵和外部隨程發酵后殘糖含量以及細胞生的OD值作為指標分析,探討十二烷醇對酵母游離細胞和固定化細胞的影響。
1 材料與方法
1.1 材料與儀器
十二烷醇、葡萄糖、海藻酸鈉 成都科隆試劑有限公司;安琪牌活性干酵母 湖北安琪酵母股份有限公司。
電子天平 北京塞多利斯天平有限公司;SHB-A型水浴恒溫振蕩器 榮華有限公司;UV-2600型紫外可見分光光度計 龍泥科上海有限公司;PHS-25型酸度計 成都方舟科技開發公司。
1.2 實驗方法
1.2.1 酵母細胞的固定化 按每100mL蔗糖加入3~4g活性酵母的比例,在2%蔗糖水中32℃條件下活化2h。加入糖度為10Be的麥芽汁培養基[3],放入搖床中在28℃,120r/min條件下增殖24h。將增殖后的培養液無菌條件下用離心管分裝,在3000r/min、4℃下離心10min棄去上清液,加入適量無菌生理鹽水,將其振蕩打散以清洗菌體,重復三次,最后一次用無菌水混合菌體制備菌懸液(每1mL菌懸液中含有0.2g 濕菌體)[4]。與 3% 的海藻酸鈉溶液[5]混合均勻,利用注射器吸取混合液,無菌條件下滴入2%CaCl2溶液,形成球狀顆粒。冷凍或常溫下靜置2h以上,使其充分固化后,再用無菌水洗滌三遍[6]。
1.2.2 固定化酵母的增殖 每50g固定化酵母顆粒中加100mL增殖培養基,搖床30℃,120r/min,震蕩培養 24h[7]。
1.2.3 細胞生長OD值的測定 細胞生長狀況的測定采用分光光度計法,在600nm處測吸光度[8]。
游離細胞生長測定:吸取1mL樣品菌液于微量離心管中,1200r/min離心1min,棄上清夜,再充分震蕩將菌體完全分散,定容至10mL,搖勻,以蒸餾水為對照,在600nm處測定OD值。
固定化細胞生長測定;將一粒固定化小球溶于含有7mL磷酸溶液的試管中(8%KH2PO4+7%K2HPO4,pH6.5),震蕩 2h 溶解,4000r/min 離心10min,生理鹽水定容至10mL,以蒸餾水為對照,在600nm處測定OD值。
1.2.4 殘糖測定方法 剩余殘糖的測定采用斐林試劑法[9]。
2 結果與分析
內部隨程萃取是指萃取劑在反應器中與培養基直接接觸,以便將產物萃取到溶劑中去。外部隨程萃取是指將培養液引出反應器,萃取劑和培養液在另外的萃取裝置中接觸,從而萃取產物的過程[10]。
2.1 萃取劑對游離細胞發酵的影響(內部隨程萃取發酵系統)
從圖1可以看出,隨著萃取劑濃度的增加,細胞生長OD值下降,萃取劑對游離細胞毒害增加,4條細胞生長曲線分散,差別比較大,酵母細胞的生長受到較大抑制。造成這種現象的原因可能是有機溶劑對細胞存在“相”毒性和“分子”毒性,“相”毒性由兩相界面引起,“分子”毒性由溶解于水中的有機溶劑作用而引起[11]。由于游離的酵母細胞在培養基中直接和萃取劑接觸,萃取劑的濃度越大,根據擴散現象,進入細胞里面的濃度也越大,產生的毒害作用越強,細胞生長就會下降。
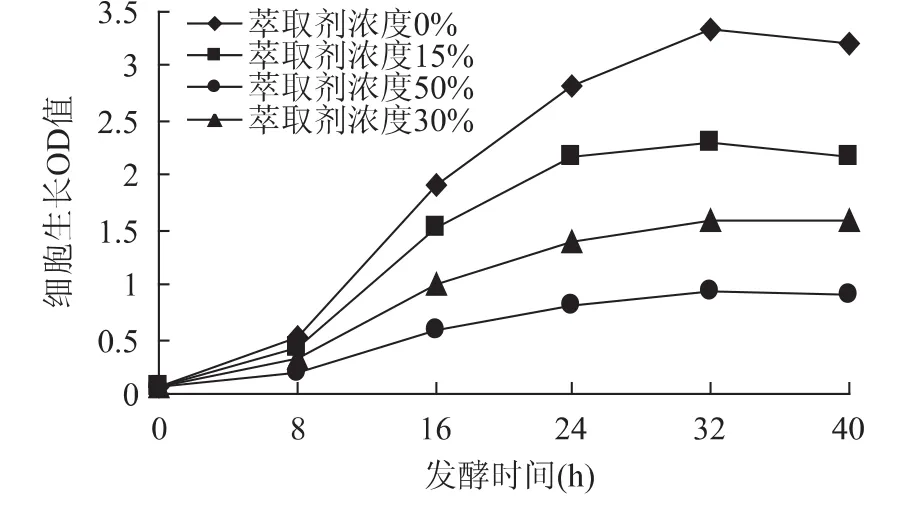
圖1 萃取劑濃度對細胞生長OD值的影響Fig.1 Effect of extraction solvent’s concentration on cell’s growth
從圖2可以看出,隨著萃取劑濃度增加,糖的降解率降低,這正與圖1中細胞生長下降的現象相符合,萃取劑濃度高時酵母菌的生長受到抑制,葡萄糖沒有被酵母菌充分利用,從而導致殘糖的含量很高,在發酵40h左右時,殘糖含量最高達8%左右,沒添加萃取劑的殘糖含量僅為1.5%,兩者差別大。
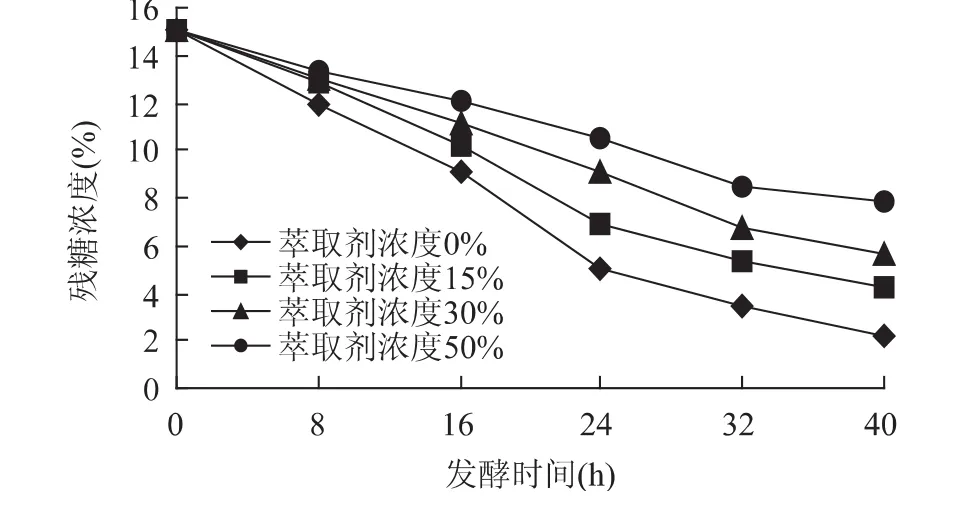
圖2 萃取劑濃度對殘糖濃度的影響Fig.2 Effect of extraction solvent’s concentration on residual sugar
2.2 萃取劑對固定化細胞的影響(內部隨程萃取發酵系統)
從圖3變化可以看出,隨著萃取劑濃度的增加,萃取劑對固定化細胞的毒害仍然存在,但是相比較游離細胞來說明顯有所改善,內部隨程萃取發酵時高濃度的十二烷醇與培養液存在“相”現象,有機溶劑會部分擴散到培養液中,由于兩者在同一裝置中,培養液中萃取劑的濃度會維持在一個穩定的狀態,培養液中的有機溶劑分子就會滲透到細胞內,對細胞產生毒害作用,對發酵產生了一定影響。相比游離細胞,細胞固定化,可以較大程度地減少有機溶劑和生物細胞的接觸,減小了“分子”毒性的影響,因而有效地緩解有機溶劑的毒害作用。4條細胞生長曲線已經稍微接近,證明固定化細胞對萃取劑的毒性有良好的抵抗能力。
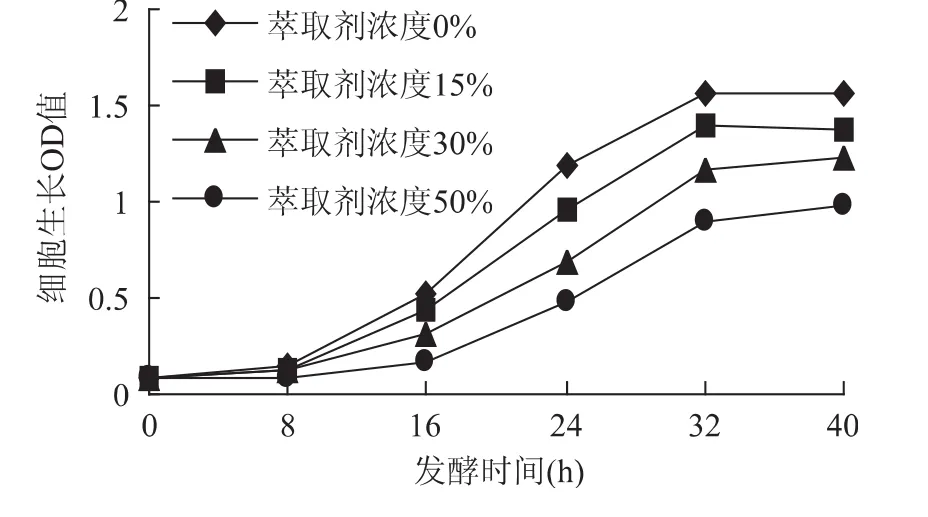
圖3 萃取劑濃度對細胞生長OD值的影響Fig.3 Effect of extraction solvent’s concentration on cell’s growth
從圖4可以進一步看出,固定化細胞所帶來的實際效果,由于細胞的生長不再像之前那樣受萃取劑的嚴重毒害,降糖效果比較良好,各條降糖曲線相對比較接近,固定化細胞內部隨程萃取發酵系統已經有了較好的結果,殘糖含量剩下了3%左右,但是,仍然可以看到萃取劑對細胞的毒害以及其他方面的抑制作用存在。
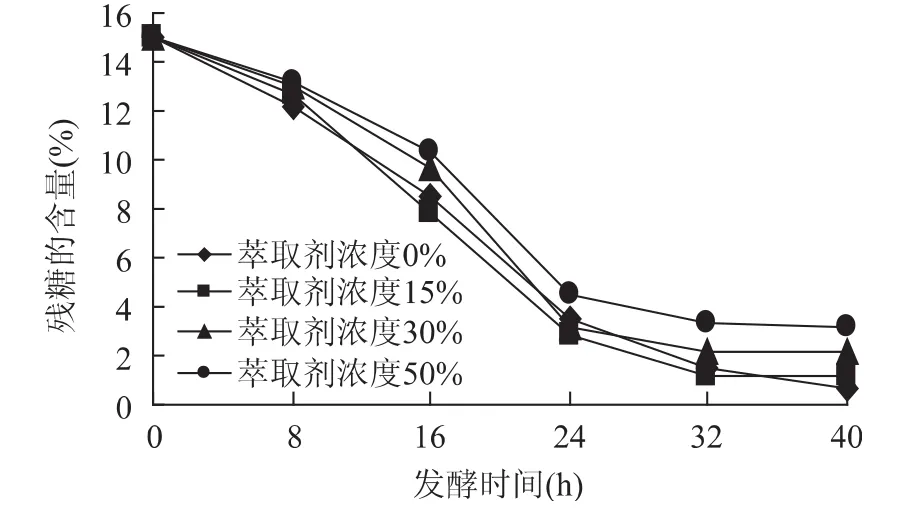
圖4 萃取劑濃度對殘糖濃度的影響Fig.4 Effect of extraction solvent’s concentration on residual sugar
2.3 萃取劑對固定化細胞的影響(外部隨程萃取發酵系統)
從圖5和圖6可以看出,隨著萃取劑濃度的增加,萃取劑對固定化細胞毒害再次降低,各條曲線進一步接近。而殘糖的變化趨勢曲線幾乎有合攏的趨勢,殘糖在發酵40h后基本上是在1%左右。從細胞生長OD值和殘糖的變化趨勢兩個指標,足以證明萃取劑對固定化細胞外部隨程萃取發酵系統的影響已經達到令人滿意的效果。因為固定化細胞外部隨程萃取時,由于萃取劑和培養液在兩個裝置中,消除了“相”毒性的存在,同時由于培養液中的萃取劑僅為萃取結束后培養液返回時攜帶的少量溶劑,“分子“毒性降低到了最小,因此對細胞的毒害作用很小。從殘糖的含量對比就可以得出來。不同濃度的萃取劑其殘糖含量差別很小。
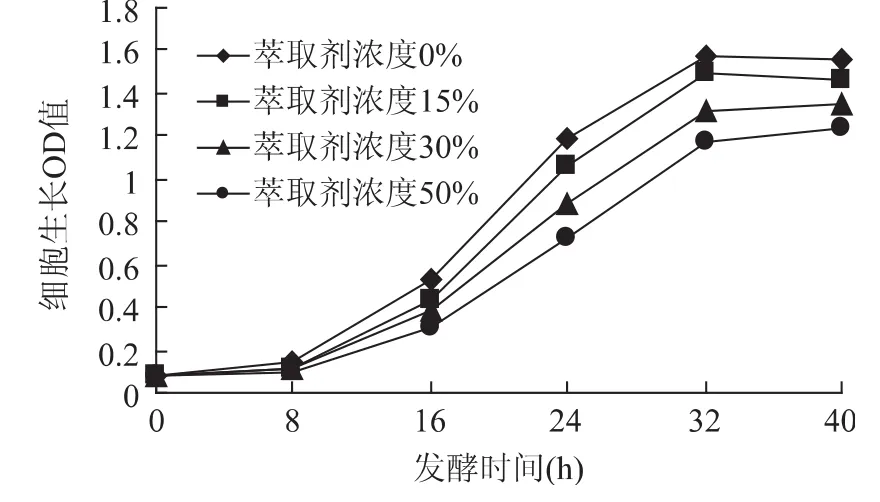
圖5 萃取劑濃度對細胞生長OD值的影響Fig.5 Effect of extraction solvent’s concentration on cell’s growth
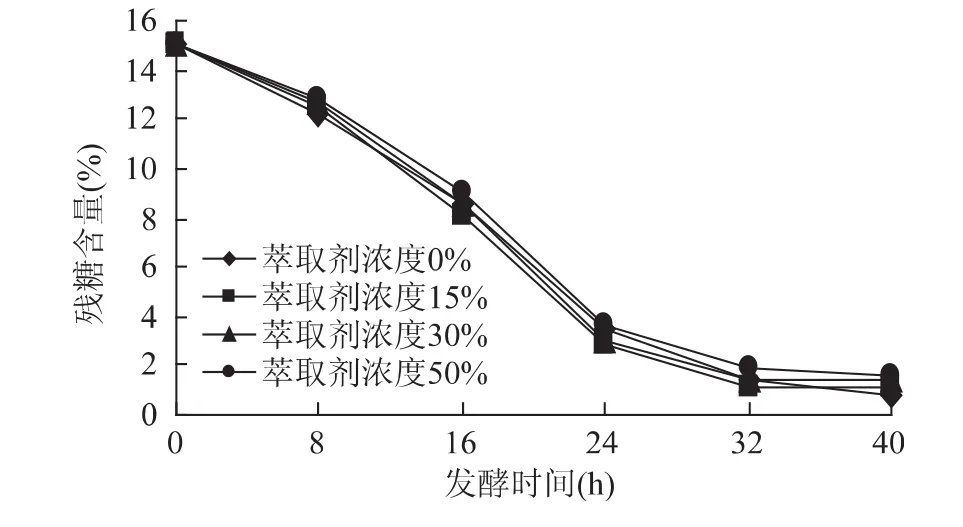
圖6 萃取劑濃度對殘糖濃度的影響Fig.6 Effect of extraction solvent’s concentration on residual sugar
3 結論
3.1 采用不同濃度的萃取劑對游離酵母細胞和固定化酵母細胞的毒害性進行分析,從生長曲線和殘糖含量兩個指標考察,隨著萃取劑濃度的增加,對游離的細胞的毒害也在增加,生長曲線很散,酵母生長受到抑制,使得殘糖含量也比較大。
3.2 萃取劑對固定化細胞毒害性相對較小,外部隨程發酵效果比內部隨程發酵效果更明顯,從生長曲線和殘糖含量知道萃取劑的影響很小。因此對固定化細胞采取外部隨程發酵是最佳的方法。
[1]宋向陽,余世袁.生物細胞固定化技術及研究進展[J].化工時刊,2000(11)37-38.
[2]王軼雄,方序,陳敏.非常規介質中細胞生化反應研究進展[J].中國生物工程雜志,2002,22(4):80-83.
[3]熊有枝.麥芽汁糖化溫度對糖化時間的影響[J].武漢工業學院學報,2003(2):58-62.
[4]王巖.固定化增殖酵母載體與活性干酵母在酒精生產中對照試驗[J].釀酒,2003(3):56-57.
[5]王宇光,許文友,王克明.混合載體固定化酵母酒精萃取發酵的研究[J].煙臺大學學報,2001(4):249-254.
[6]趙玲,孫清,劉榮厚,等.固定化酵母流化床生物反應器木薯淀粉酒精發酵的研究[J].可再生能源,2005(1):16-19.
[7]呂躍剛,馬家津.固定化細胞顆粒珠制備條件的研究[J].北京工商大學學報,2004(4):12-14.
[8]陳敏,王軼雄,方序.非常規介質中乳酸萃取發酵條件的研究[J].中國食品學報,2004(3):45-46.
[9]張正奇.分析化學[M].北京:科學出版社,2006.
[10]李寅,陳堅,郁明.生物反應與產物分離組合技術的研究進展[J].化學進展,1997,9(3):283-290.
[11]Bar R.Effect of interphase mixing on a water-organic solvent two-liquid phase microbial systems:ethanal fermentation[J].J Chem Techno1 Biotechnol,1988(43):49-62.

