立方晶系Li0.29Ni0.71O的電化學性質
陳 紅, 王慶偉, 別曉非, 杜 菲, 王春忠, 寇春雷
(1. 北華大學 物理學院, 吉林 吉林 132013; 2. 吉林師范大學 環境友好材料制備與應用省部共建教育部重點實驗室, 吉林 四平 136000; 3. 吉林大學 物理學院, 長春 130012)
鋰離子二次電池在筆記本電腦、 移動電話、 相機、 混合動力汽車(HEV)、 無間斷電源(UPS)、 太空及軍事等領域應用廣泛. 在具有商用前景的正極/負極材料中, NiO和LiNiO2分別作為負極材料[1-4]和正極材料[5-9]已引起人們廣泛關注. 但整數比例的LiNiO2不易制備, 所合成獲得的材料通常為非整數比LixNi1-xO(或LixNi2-xO2)化合物[10-11]. 由于NiO中Li+部分取代Ni2+將改變材料的微結構, 因此制備的LixNi1-xO材料與純NiO材料具有不同的電化學性能[12-14].
本文通過熔鹽法制備Li+取代材料Li0.29Ni0.71O. 利用X射線衍射、 循環伏安法、 充放電循環測試及電化學阻抗譜研究材料的結構及電化學性能.
1 實 驗
Li0.29Ni0.71O由熔鹽法制備. 按V(硝酸鋰)∶V(硝酸鎳)=2的比例研磨, 混合4 h后壓片置于坩堝中. 混合物先在氮氣氣氛下預燒至400 ℃并保溫2 h, 再加熱至650 ℃保溫48 h. 加熱及冷卻速率為1 ℃/min. 樣品冷卻至室溫后, 用去離子水清洗. 在200 ℃下烘干制得最終產物.
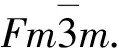
在電化學實驗中, 電池負極為金屬鋰箔, 電極材料為質量分數為80%的活性物質+質量分數為10%的乙炔黑+質量分數為10%的粘結劑(PVDF)在N甲基吡咯烷酮中攪拌混合所得. 混合后漿液均勻涂抹在銅箔上并用真空烘箱烘干. 電解液為1 mol/L LiPF6EC/DMC溶液. 在Land電池測試系統進行恒流充放電實驗. 在VSP多通道電化學工作站(Bio-Logic SAS, 法國)上進行循環伏安及電化學阻抗測試.
2 結果與分析
Li0.29Ni0.71O材料的循環伏安曲線如圖1所示, 其中掃描速率為0.1 mV/s. 由圖1可見, 在0.8 V處出現還原峰, 對應電極材料表面膜的形成以及Li+和Li0.29Ni0.71O的反應[6]. 反應化學方程式為

(1)
與典型的過渡金屬氧化物類似[7], Li0.29Ni0.71O晶體在化學反應過程中粉化為納米級顆粒. 反應式(1)表明, Li0.29Ni0.71O材料理論容量(1.71 mol Li+插入)小于NiO(2.0 mol Li+插入). 在氧化過程中, 位于2.2 V處的氧化峰對應部分表面膜分解及單質Ni氧化為Ni2+過程, 其反應式為

(2)
由式(1)和式(2)可見, 在首次放電充電循環后, 約有0.29 mol Li+在電極內形成Li2O.
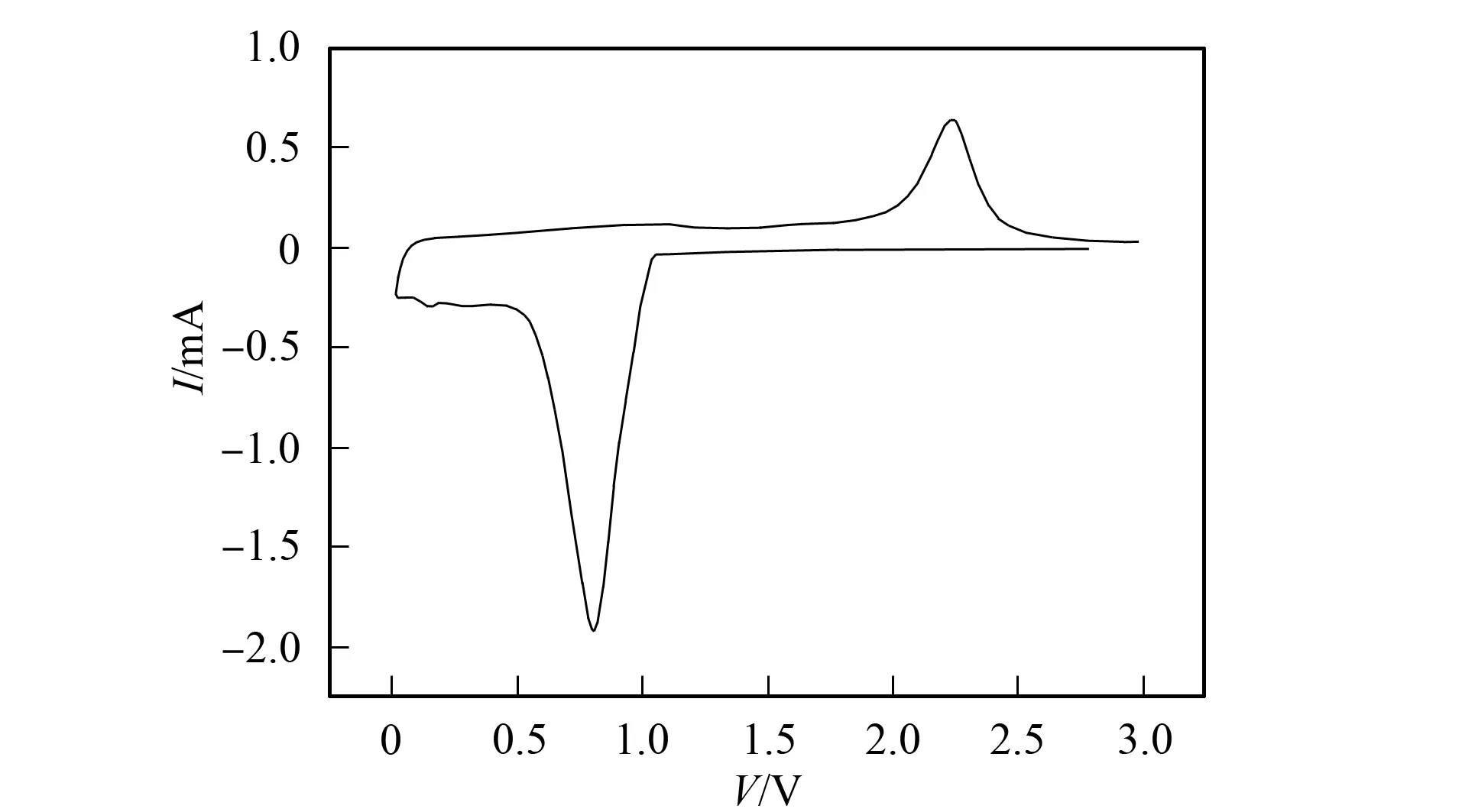
圖1 Li0.29Ni0.71O材料的循環伏安曲線Fig.1 Cyclic voltammogram of Li0.29Ni0.71O
Li0.29Ni0.71O材料以100 mA/g電流密度充放電曲線如圖2所示. 由圖2可見, 放電曲線先迅速降至約為1.0 V, 隨后逐漸降至0.1 V. 在該過程中, 約有1.7 mol Li+插入材料, 與Li0.29Ni0.71O理論容量相符. 由于形成SEI膜, 因此所有活性物質并未全部參與電化學反應. 在首次充放電循環中, 存在較大的不可逆容量損失, 對應的庫侖效率為63.4%. 不可逆容量損失也是由電解液沉降反應在電極表面形成SEI表面膜所致.
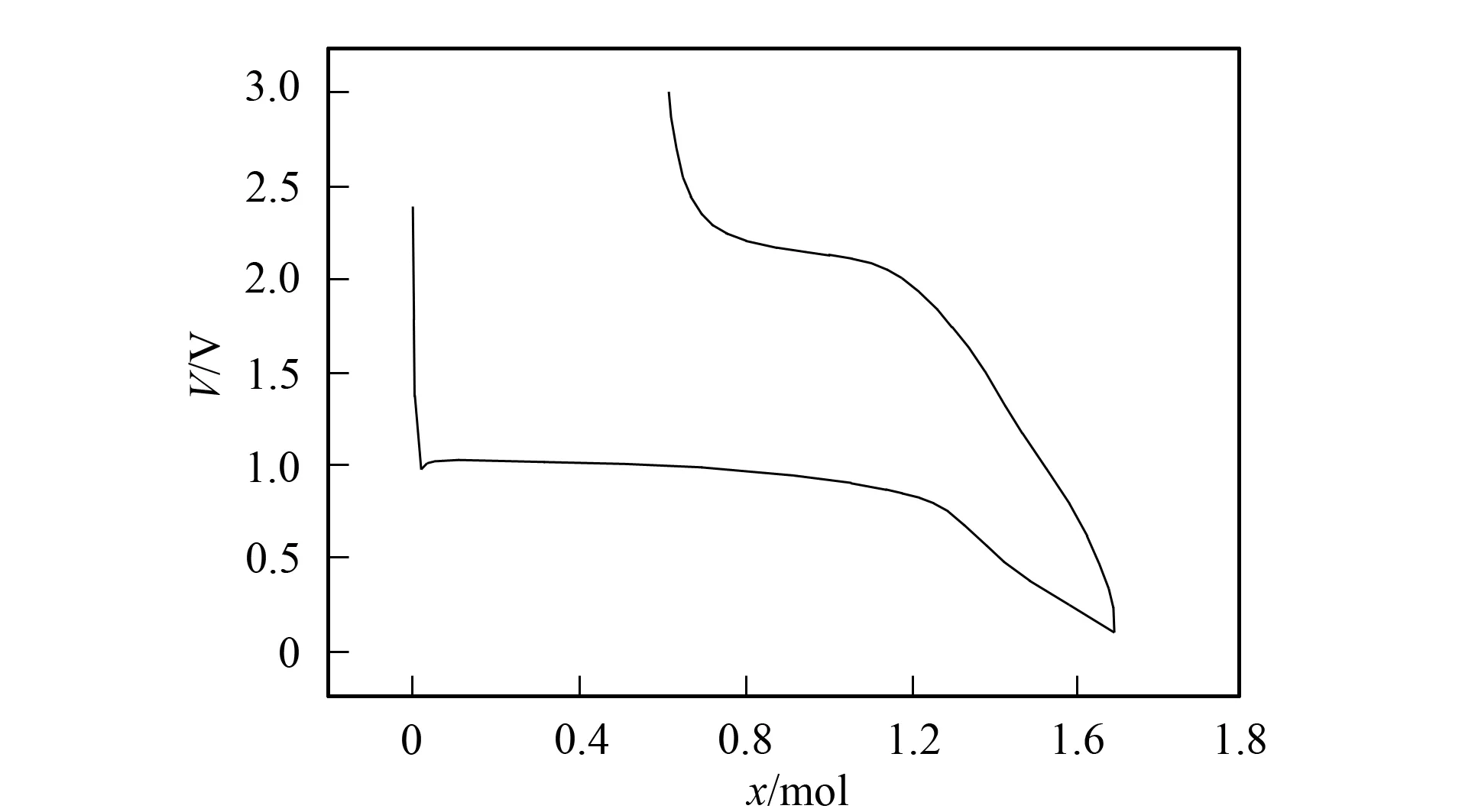
圖2 Li0.29Ni0.71O材料充放電曲線Fig.2 Charge-discharge curve of Li0.29Ni0.71O
圖3 Li0.29Ni0.71O材料的電化學循環性能曲線Fig.3 Curve of electrochemical cycling performance of Li0.29Ni0.71O
Li0.29Ni0.71O材料的電化學循環性能曲線如圖3所示. 由圖3可見, 材料的首次放電比容量為756 mA·h/g, 通常純NiO的首次放電比容量大于1 000 mA·h/g[7-9]. 材料的循環容量衰減迅速, 30次循環后的放電比容量為208 mA·h/g. 由于Li2O不具有電化學活性, 因此, 隨著循環進行, 較大的容量損失是由于未反應的Li2O在電極中累積所致.
圖4(A)為Li0.29Ni0.71O電極經過首次、 第三次和第五次循環后的Nyquist曲線. 由圖4(A)可見, 所有曲線在高中頻區間均呈半圓形, 在低頻區間為傾斜線. 其中高頻區間的半圓與SEI膜的形成有關, 中頻區間的半圓與電荷轉移有關[7,15], 低頻區間(Warburg區間)的傾斜線與電極中Li+擴散有關. Nyquist曲線可用圖4(B)的等效電路分析, 其中Rs為電極的歐姆電阻,Rf和Rct為SEI膜和電荷的轉移電阻,Q1和Q2為常相角元件. Li0.29Ni0.71O材料在不同循環次數后電化學阻抗譜(EIS)的等效電路擬合數據列于表1.
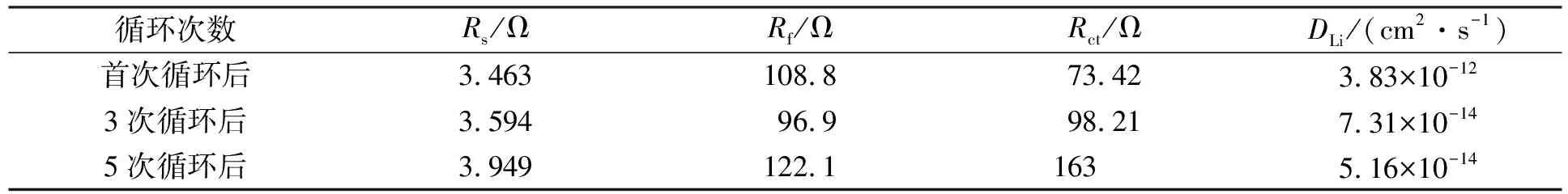
表1 Li0.29Ni0.71O材料在不同循環次數后的EIS等效電路擬合數據
由表1可見, Li0.29Ni0.71O材料從首次到30次循環后,Rf降低, 這是由于Li0.29Ni0.71O晶體顆粒在電化學過程中受到粉化作用, 使得電極比表面積逐漸增大所致. 結構變化完成后, 比表面積穩定, SEI膜的厚度隨電解液沉積而增加. 由于Rf與SEI膜厚度成正比, 因此Rf從第三次到第五次循環中開始增大. 此外,Rct隨充放電循環次數的增加而增大, 表明在SEI膜的形成及結構轉變中不易發生電荷轉移.
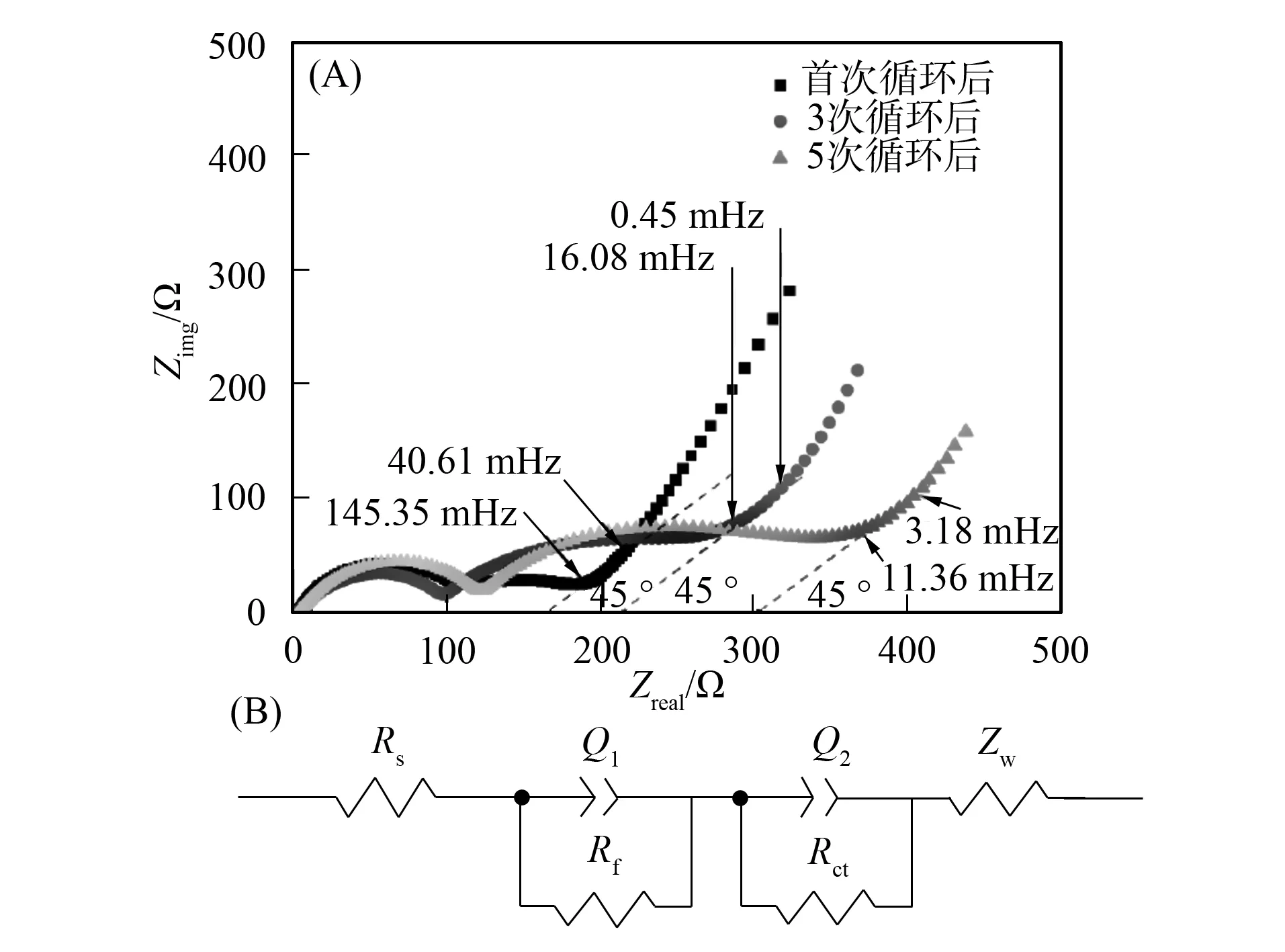
圖4 Li0.29Ni0.71O材料的Nyquist曲線(A) 和擬合等效電路(B)Fig.4 Nyquist plots for Li0.29Ni0.71O (A) and equivalent circuit for fitting of the Nyquist plots (B)
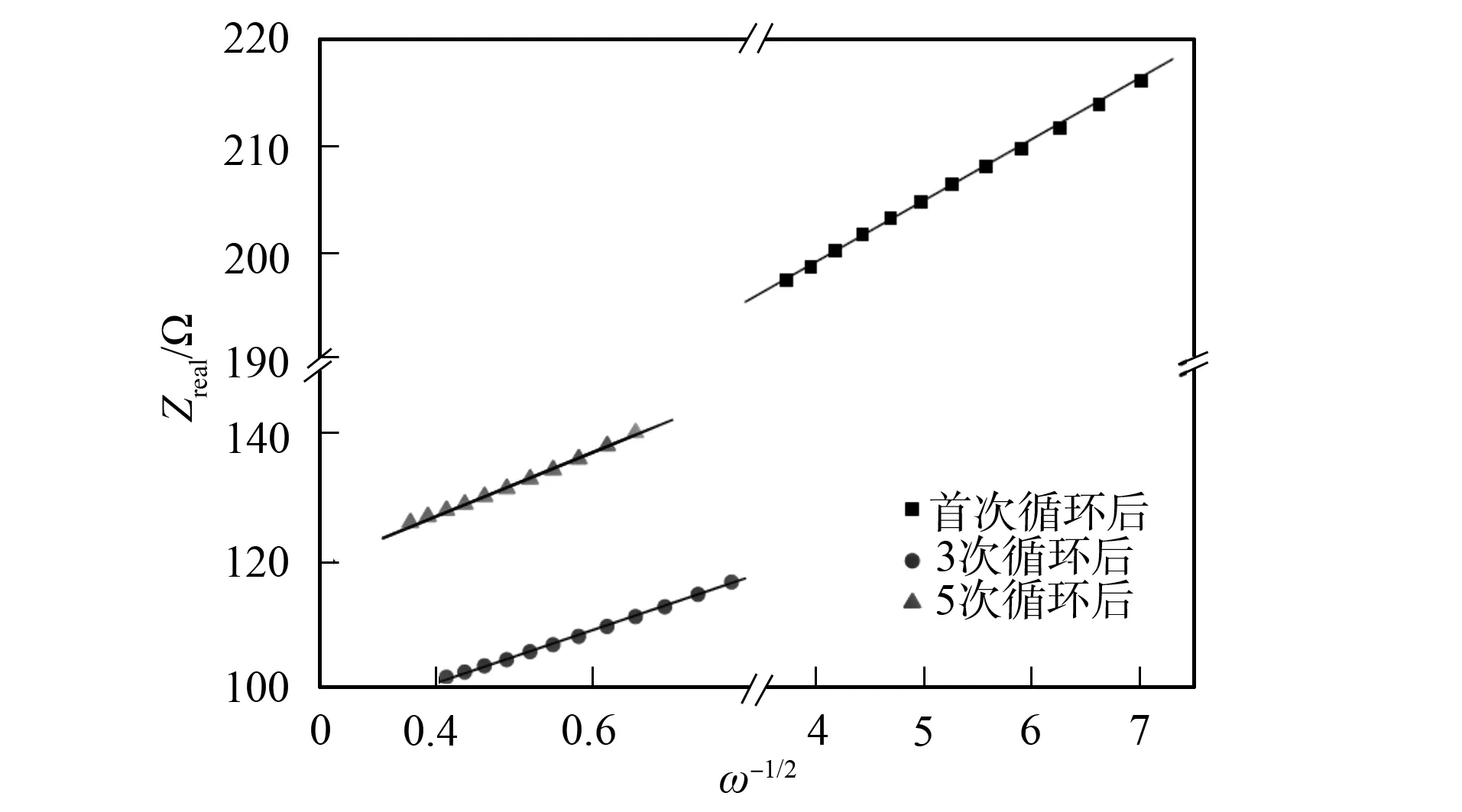
圖5 Li0.29Ni0.71O材料在首次、 第三次和第五次 循環后的Zreal與ω-1/2線性擬合曲線Fig.5 Linear fitting curves of Zreal vs ω-1/2 of Li0.29Ni0.71O after 1,3 and 5 cycles
材料的化學擴散率DLi可在Warburg區間用下式計算[16]:
(3)
其中:R為氣體常數;T為絕對溫度;S為電極活性物質表面積;C為Li+在電極材料中的濃度;n為反應電子轉移數;F為Faraday常數;σ為Warburg系數, 可由下式計算求得:
Zreal=Rs+Rct+σω-1/2.
(4)
Li0.29Ni0.71O材料在首次、 第三次和第五次循環后的Zreal與ω-1/2線性擬合曲線如圖5所示, 斜率σ由Zreal與ω-1/2線性擬合得到. 由σ及式(3)可得Li0.29Ni0.71O在首次、 第三次和第五次循環后的化學擴散率分別為3.83×10-12,7.31×10-14,5.16×10-14cm2·s-1. 由于化學擴散率主要由結構及溫度決定. 因此在環境溫度不變的條件下,DLi從首次到3次循環后降低是由于活性物質從晶態到非晶態的結構轉變所致. Li+在分解后的非晶相中比Li0.29Ni0.71O晶體中更難擴散. 由圖5可見,DLi從第三次到第五次循環后的變化較小, 從而可知結構變化在前三次循環內完成.
綜上, 本文研究了Li+取代對NiO材料結構及電化學性能的影響. 結果表明: 材料在Li+取代后仍為立方結構, 但由于Li+取代Ni2+時生成了離子半徑更小的Ni3+, 從而壓縮了立方NiO結構而使材料晶胞參數變小; 材料在Li+取代后的電化學容量比NiO略低; 首次循環時, 材料中形成的Li2O加速了材料電化學循環容量損失.
[1] Kanno R, Kubo H, Kawamoto Y, et al. Phase Relationship and Lithium Deintercalation in Lithium Nickel Oxides [J]. J Solid State Chem, 1994, 110(2): 216-225.
[2] Nagasaka Y, Ohta H, Kawakami K, et al. Millimeter Wave Spectroscopy of Secondary Battery Substance Li1-xNi1+xO2[J]. J Phys Chem Solid, 2003, 64(9/10): 1949-1951.
[3] Morales J, Pérez-Vicente C, Tirado J L. Cation Distribution and Chemical Deintercalation of Li1-xNi1+xO2[J]. Mater Res Bull, 1990, 25(5): 623-630.
[4] LI Wu, Reimers J N, Dahn J R. Crystal Structure of LixNi2-xO2and a Lattice-Gas Model for the Order-Disorder Transition [J]. Phys Rev B, 1992, 46(6): 3236-3246.
[5] WANG Chi-wei, MA Xiao-ling, LI Zi-cheng, et al. Simple, Rapid and Accurate Determination of Lattice Composition and Evaluation of Electrochemical Properties of LixNi2-xO2Electrode Material for Lithium Ion Battery by a Novel Method [J]. Electrochemistry Communications, 2006, 8(2): 289-292.
[6] Huang X H, Tu J P, Zhang B, et al. Electrochemical Properties of NiO-Ni Nanocomposite as Anode Material for Lithium Ion Batteries [J]. J Power Sources, 2006, 161(1): 541-544.
[7] Huang X H, Tu J P, Zhang C Q, et al. Net-Structured NiO-C Nanocomposite as Li-Intercalation Electrode Material [J]. Electrochem Commun, 2007, 9(5): 1180-1184.
[8] Oh Sung Woo, Bang Hyun Joo, Bae Young Chan, et al. Effect of Calcination Temperature on Morphology, Crystallinity and Electrochemical Properties of Nano-Crystalline Metal Oxides (Co3O4,CuO and NiO) Prepared via Ultrasonic Spray Pyrolysis [J]. J Power Sources, 2007, 173(1): 502-509.
[9] Rahman M M, CHOU Shu-lei, ZHONG Chao, et al. Spray Pyrolyzed NiO-C Nanocomposite as an Anode Material for the Lithium-Ion Battery with Enhanced Capacity Retention [J]. Solid State Ionics, 2010, 180(40): 1646-1651.
[10] Belhomme C, Cassir M, Devynck J, et al. Synthesis by a Soft Chemistry Route and Characterization of LixNi1-xO (0 [11] Bajpai A, Banerjee A. Characterization of the Metastable Magnetic Phase of LixNi1-xO Using Non-linear Susceptibility [J]. J Phys Condens Matter, 2001, 13(4): 637-647. [12] Manna S, De S K. Magnetic Properties of Li and Fe Co-doped NiO [J]. Solid State Communications, 2009, 149(7/8): 297-300. [13] Elp J, Van, Eskes H, Kuiper P, et al. Electronic Structure of Li-Doped NiO [J]. Phys Rev B, 1992, 45(4): 1612-1622. [14] WU Jun-bo, NAN Ce-wen, LIN Yuan-hua, et al. Giant Dielectric Permittivity Observed in Li and Ti Doped NiO [J]. Phys Rev Lett, 2002, 89(21): 217601. [15] YANG Shu-bin, SONG Huai-he, CHEN Xiao-hong. Electrochemical Performance of Expanded Mesocarbon Microbeads as Anode Material for Lithium-Ion Batteries [J]. Electrochem Commun, 2006, 8(1): 137-142. [16] Bard A J, Faulkner L R. Electrochemical Methods: Fundamentals and Applications [M]. 2nd ed. New York: Wiley, 1980: 328.

