真空下1,2-丙二醇-乙二醇二元體系汽液平衡研究
陳衛航,陳軍航,蔣元力,張 婕 ,周 輝 ,張浩勤
(1.鄭州大學化工與能源學院,河南鄭州450001;2.河南煤化集團,河南 鄭 州450046)
0 引言
乙二醇(EG)作為一種重要的有機化工原料,廣泛應用于生產聚酯纖維、防凍劑、潤滑劑等行業[1-2].目前,乙二醇的合成路線主要為石油路線,其主要反應為乙烯氧化生成環氧乙烷,然后環氧乙烷水合得到乙二醇[3-4].隨著石油資源的日漸匱乏,由煤基合成氣制乙二醇工藝路線[5]的開發越來越受到重視,但采用煤制乙二醇的產物中含有1,2-丙二醇等副產物,影響乙二醇產品的品質,在后續提純工藝中需將其分離,特別是1,2-丙二醇沸點與乙二醇相近,分離難度較大.汽液平衡(VLE)數據是分離設計中重要的熱力學基礎數據,且工業上大多采用真空條件對乙二醇體系進行分離提純,因此筆者采用汽相單循環法測定了真空6.67 kPa(絕壓)下1,2-丙二醇-乙二醇二元體系的汽液平衡數據.
1 實驗部分
1.1 實驗試劑
1,2-丙二醇:分析純,質量分數≥99.5%,國藥集團化學試劑有限公司;乙二醇:分析純,質量分數≥99.5%,天津市風船化學試劑科技有限公司.
1.2 實驗裝置
汽相單循環汽液平衡釜;真空泵,淄博鈺馬泵業有限公司;U型管水銀壓差計;DYM-1型動槽式水銀氣壓表;0~50℃和100~150℃精密溫度計各1支,使用過程中均已進行零點校正、刻度校正及露頸校正;汽、液相取液器各1支;GC-9800氣相色譜儀,FID檢測器,Φ50 m×0.32 mm×0.25μm聚乙二醇色譜柱,上海科創色譜儀器有限公司.實驗裝置見圖1.
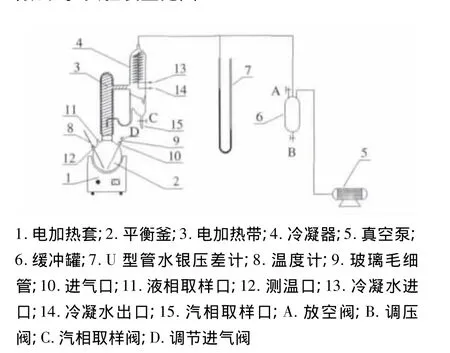
圖1 實驗裝置Fig.1 Experimental apparatus
1.3 實驗方法
將一定量組成不同的1,2-丙二醇-乙二醇混合溶液加入到平衡釜中加熱,調節加熱電壓及伴熱電壓至合適大小,在保證汽相不會冷凝的前提下盡可能的加快回流速度,當溫度穩定2~3 h后,可認為汽液兩相達到平衡,分別取出一定量的汽相和液相樣,待分析.
1.4 分析方法
采用氣相色譜法對樣品進行分析.色譜分析條件如下:載氣為氮氣;柱前壓0.08 MPa;尾吹0.035 MPa;分流流量60 mL/min;柱箱溫度180℃;氣化室溫度260℃;檢測器溫度260℃;進樣量0.2μL;每個樣品至少分析3次.
在全濃度范圍內配置一系列已知濃度的1,2-丙二醇-乙二醇標準溶液,經氣相色譜分析,得到乙二醇質量分數與峰面積分數的關系式.由此式即可確定待測樣中乙二醇的含量.1,2-丙二醇-乙二醇標準曲線如圖2,擬合得到關系式(1),相關系數R2=0.999 9.
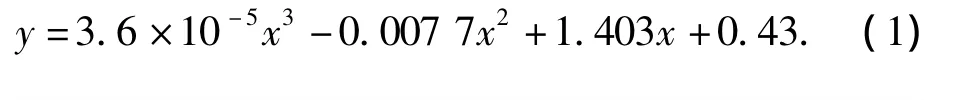
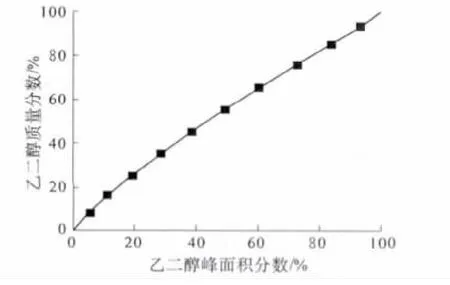
圖2 1,2-丙二醇-乙二醇標準曲線Fig.2 Standard curve of 1,2-propylene glycol-ethylene glycol
2 結果與討論
2.1 汽液平衡數據的測定結果
在真空6.67 kPa(絕壓)下測定了 1,2-丙二醇(1)-乙二醇(2)二元體系的汽液平衡數據,結果見表1.在減壓下汽相可視為理想氣體,汽液平衡關系式可簡化為

式中:p為系統壓力;yi為汽相摩爾分數;psi為純物質的飽和蒸汽壓;γi為活度系數;xi為液相摩爾分數;i為組分;其中,1,2-丙二醇與乙二醇的飽和蒸汽壓由安托因方程[6]計算:
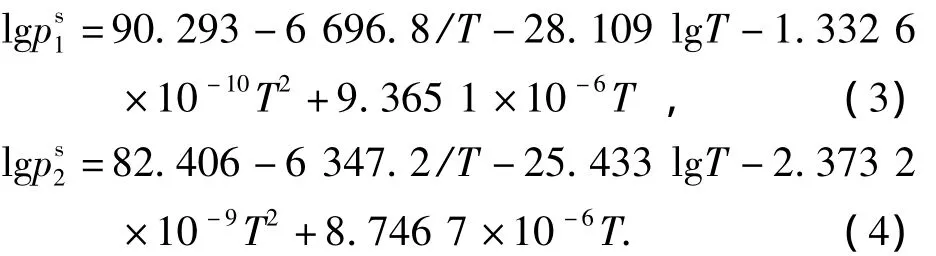
式中:p為壓力,mmHg;T為溫度,K.根據上式可計算出相應的液相活度系數,其結果見表1.
2.2 汽液平衡數據的熱力學一致性檢驗
熱力學一致性檢驗就是要檢驗測得的汽液平衡數據是否滿足Gibbs-Duhem方程.筆者采用Herrington面積檢驗法[7],對測得的數據進行熱力學一致性檢驗.以ln(γ1/γ2)對x1作圖,如圖3所示.
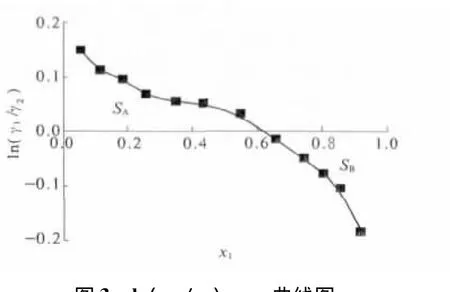
圖3 ln(γ1/γ2)-x1曲線圖Fig.3 Diagram of ln(γ1/γ2)-x1
令
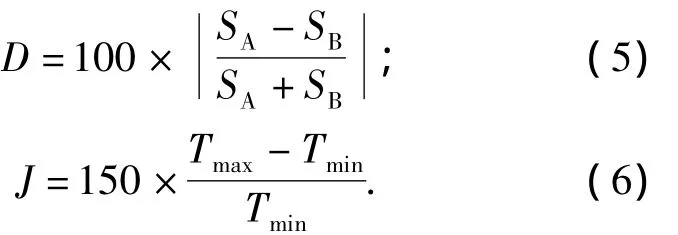
式中:SA和 SB是 ln(γ1/γ2)對 x1作圖后,曲線與坐標軸所圍的面積;Tmax和Tmin分別是體系的最高和最低溫度.
若D-J≤10,則可認為該實驗數據符合熱力學一致性.對于筆者所測物系,求出D=9.13,J=3.20,則 D-J=5.93 <10,表明所測數據符合熱力學一致性.
2.3 實驗數據的關聯
利用Aspen Plus軟件中的數據回歸功能模塊,分別選用適用廣泛的 Wilson[8]、NRTL[9]和UNIQUAC[10]活度系數模型進行數據關聯.選定目標函數為
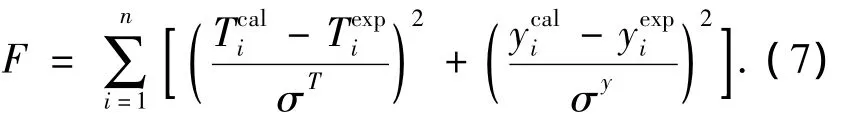
采用非線性最小二乘法對所測的汽液平衡數據進行關聯,分別得到Wilson、NRTL和UNIQUAC模型的二元交互作用參數,結果如表2所示.
分別將求得的相應二元交互作用參數代入到Wilson、NRTL和UNIQUAC活度系數模型中,計算絕壓6.67 kPa條件下1,2-丙二醇(1)-乙二醇(2)二元體系的汽液平衡數據,并與實驗值進行比較,其結果見表1.
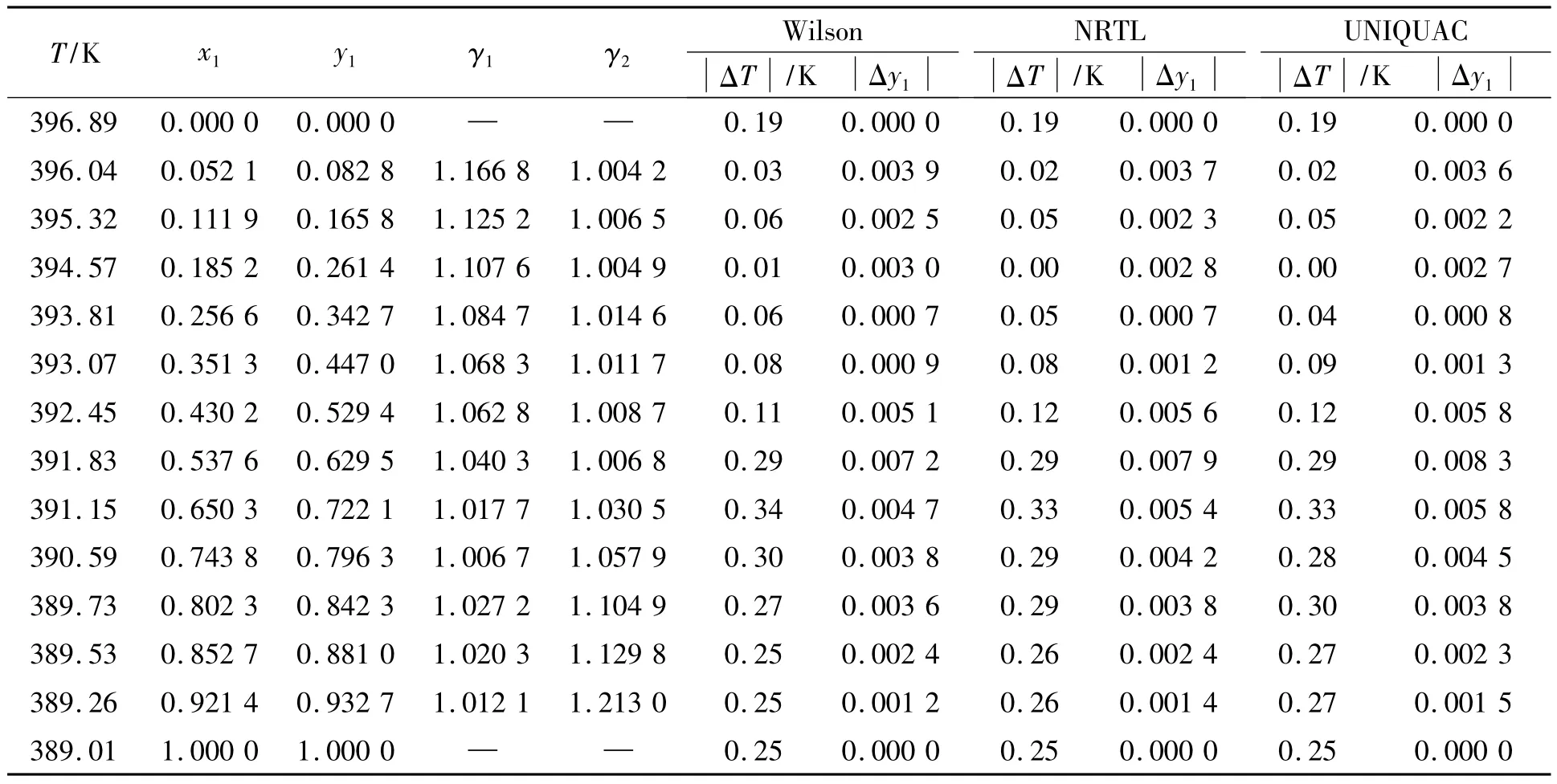
表1 絕壓6.67 kPa下1,2-丙二醇(1)-乙二醇(2)二元體系的汽液平衡數據及其與模型計算值比較結果Tab.1 Experimental VLE data and the results of the value com pared with model calculated for the binary system 1,2-propylene glycol(1)-ethylene glycol(2)at 6.67 kPa
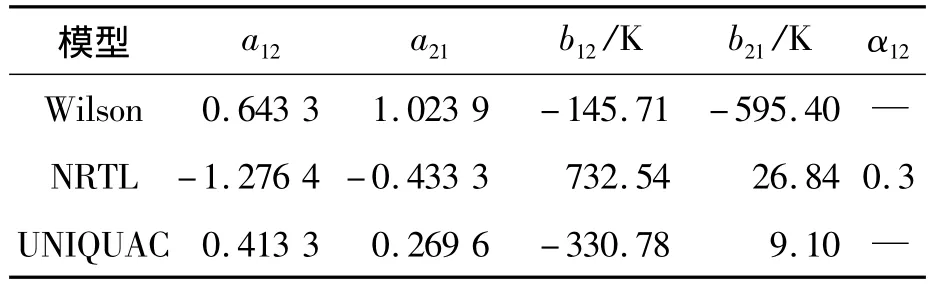
表2 Wilson、NRTL 和 UNIQUAC模型的二元交互作用參數Tab.2 Binary interaction parameters of Wilson,NRTL and UNIQUAC models
由表1可知,用 Wilson、NRTL和 UNIQUAC模型對實驗數據進行關聯得到的值與實驗值比較,平衡溫度的最大絕對偏差分別為0.34,0.33,0.33 K,平均絕對偏差分別為 0.178,0.177,0.177 K;1,2-丙二醇汽相摩爾分率的最大絕對偏差分別為0.007 2,0.007 9,0.008 3,平均絕對偏差分別為 0.003 2,0.003 4,0.003 5.
由關聯結果可知,Wilson、NRTL和UNIQUAC模型的計算值與實驗值相比,偏差都不大,均可用于6.67 kPa條件下1,2-丙二醇-乙二醇二元體系汽液平衡數據的關聯,其結果可以滿足工程上分離設計的要求.
2.4 汽液平衡相圖
絕壓6.67 kPa條件下1,2-丙二醇-乙二醇二元體系的T-x-y關系見圖4,y-x關系見圖5.

3 結論
(1)實驗測定了絕壓6.67 kPa條件下1,2-丙二醇-乙二醇二元體系的汽液平衡數據,并用Herrington面積檢驗法對測得的汽液平衡數據進行熱力學一致性檢驗,結果表明實驗數據滿足熱力學一致性要求.
(2)利用Aspen Plus軟件中的數據回歸模塊,分別用 Wilson、NRTL和UNIQUAC模型對實驗數據進行關聯,得到了各個模型的二元交互作用參數,進而用這些參數計算出了1,2-丙二醇-乙二醇二元體系的汽液平衡數據,結果表明實驗值與各個模型的計算值相比,偏差較小,說明該數據滿足工程領域分離設計的需要.
[1] 江鎮海.國內外合成制乙二醇技術進展[J].合成技術及應用,2010,25(4):27-30.
[2] DREISEITLOVá J,REHáK K,MORáVEK P.Liquidliquid equilibrium in ternary systems containing ethylene glycol,monofunctional benzene derivative,and ethyl acetate[J].Journal of Chemical& Engineering Data,2011,56(5):1899-1902.
[3] 楊志劍,任楠,唐頤.環氧乙烷催化水合制備乙二醇的研究進展[J].石油化工,2010,39(5):562-569.
[4] PANG Ji-feng,ZHENG Ming-yuan,WANG Ai-qin,et al.Catalytic hydrogenation of corn stalk to ethylene glycol and 1,2-propylene glycol[J].Industrial& Engineering Chemistry Research,2011,50(11):6601-6608.
[5] 丁博文,楊帆,周春艷.合成氣制乙二醇技術進展[J]. 化工科技市場,2007,30(3):41-44.
[6] YAWSC L.Chemical properties handbook:physical,thermodynamic,environmental,transport,safety,and health related properties for organic and inorganic chemicals[M].北京:世界圖書出版公司,1999.
[7] 陳新志,蔡振云,胡望明.化工熱力學[M].北京:化學工業出版社,2005.
[8] WILSON G M.Vapor-liquid equilibrium XI:A new expression for the excess free energy ofmixing[J].J Am Chem Soc,1964,86(2):127-130.
[9] RENON H,PRAUSNITZ JM.Local compositions in thermodynamic excess functions for liquid mixtures[J].AIChE J,1968,14(1):135-144.
[10] ABRAMSD S,PRAUSNITZ JM.Statistical thermodynamics of liquid mixtures:a new expression for the excess Gibbs energy of partly or completely miscible systems[J].AIChE J,1975,21(1):116-118.

