蜂王漿對四氯化碳引起小鼠急性肝損傷保護作用的研究
王金勝 龔 雁 羅亞娟 繆曉青 方文富
(福建農林大學蜂學學院,福州 350002)
四氯化碳(CCl4)是一種工業溶劑,廣泛用于誘導化學性肝損傷。CCl4主要是通過肝微粒體細胞色素P450作用形成三氯甲基自由基,它能與巰基(谷胱甘肽和蛋白質硫醇)和抗氧化酶如過氧化氫酶和超氧化物歧化酶結合。三氯甲基自由基產生過量就會引起膜脂質過氧化反應,最終導致了各種肝疾病病理過程,如脂肪肝,纖維化和肝硬化[1]。因此,尋找天然有效、無毒副作用的藥物來治療肝損傷及其并發癥至關重要。
蜂王漿是由工蜂頭部的上顎腺分泌的粘稠的漿狀物,它是蜂王唯一的食物,也是工蜂和雄蜂3日齡以內小幼蟲的食物,在蜜蜂的生長發育上起著重要的影響作用。它對肝臟疾病具有很好的療效[2],它可以增強免疫功能、抗菌抗病毒、促進肝組織再生、抑制貯脂細胞活化、氨基酸等成分的作用、均衡營養和調節代謝作用等,它可以標本兼治,而且無毒副作用[3]。本研究的目的就是來探討蜂王漿對CCl4引起小鼠急性肝損傷保護作用。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物:
健康的雄性小鼠(mus musculus),體重18~22 g,由上海斯萊特林實驗動物中心提供。
1.1.2 實驗材料:
新鮮的蜂王漿,2012年福建省莆田市江口龍眼花期生產,由福州市蜜蜂協會意蜂實驗場提供。
1.1.3 實驗試劑:
聯苯雙酯滴丸,由浙江萬邦藥業有限責任公司生產;四氯化碳為分析純,由開封化學試劑廠生產;AST、ALT酶聯免疫試劑盒、MDA、GSH-Px試劑盒,由南京建成生物研究所提供;
1.1.4 主要儀器:酶標儀;分光光度計;恒溫箱
1.2 實驗方法
1.2.1 肝損傷模型的建立和分組
健康的雄性小鼠,體重18~22 g,在實驗室適應一周,自由進食進水。小鼠隨機分成6組:正常對照組、模型組、陽性對照組、蜂王漿高、中、低劑量組。按照國內常用的方法[4]進行造模:腹腔注射0.1%(v/v)CCl4玉米油溶液10 ml/kg,禁食,不禁水。
1.2.2 給藥及動物處理
造模18 h后開始灌胃給藥,每天灌胃一次,連續28 d。正常對照組和模型組給予生理鹽水,陽性對照組給予聯苯雙酯(150 mg/kg),蜂王漿高、中、低劑量組濃度分別為:0.8 g/kg、1.6 g/kg、3.2 g/kg。均自由進食。
于末次給藥后2 h,除空白對照組外分別進行腹腔注射CCl4玉米油溶液,空白對照組腹腔注射同劑量的玉米油,禁食不禁水,18 h后經摘取眼球取血,并脫頸椎處死。
1.2.3 血清中AST、ALT測定
收集的血樣以4000 rpm離心10 min,取血清,采用雙抗體夾心法按照試劑盒的說明來測定血清中AST、ALT含量。
1.2.4 肝臟中MDA和GSH-Px的測定
剪取0.5 g肝臟置于碾磨器中,加入5 ml生理鹽水進行充分碾磨,4500 rpm離心10 min,取上清液,制成10%的勻漿。按照試劑盒的說明測定肝組織中MDA的含量和GSH含量。組織中蛋白含量的測定采用考馬斯亮藍法測定。
1.3 數據統計與分析
組間比較用one-way ANOVA。方差齊性時,采用LSD方法進行組間多重比較;方差不齊時,采用DunnettT 3方法進行組間多重比較。用統計軟件SPSS17.0進行分析,數據以(±s)表示,P<0.05定為差異有統計學意義。
2 結果與分析
2.1 蜂王漿對CCl4引起的急性肝損傷小鼠血清中AST和ALT含量的影響
蜂王漿對CCl4引起的急性肝損傷小鼠血清中AST和ALT影響的實驗和統計結果顯示:模型組的AST和ALT含量分別極顯著高于正常對照組的(P<0.01),表明本實驗小鼠急性肝損傷造模成功;飼喂高、中、低三個劑量蜂王漿組、正常對照組和陽性對照組血清中的AST、ALT含量之間無顯著性差異(P>0.05),但它們都極顯著低于模型組的(P<0.01),說明說明飼喂一定劑量的蜂王漿對小鼠抗肝細胞受損和抗肝細胞壞死具有極顯著作用(表1和表2)。
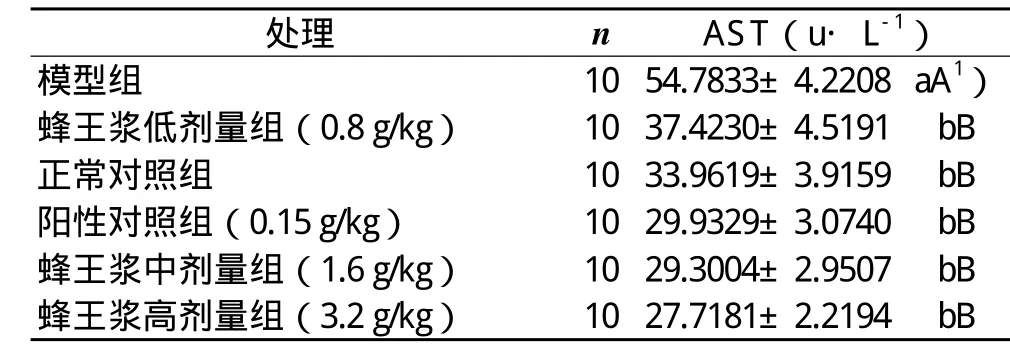
表1 蜂王漿對CCl4肝損傷小鼠血清中AST含量影響的實驗和統計結果(x± s )

表2 蜂王漿對CCl4肝損傷小鼠血清中ALT含量影響的實驗和統計結果(x± s )
2.2 蜂王漿對CCl4引起急性肝損傷小鼠肝勻漿中脂質過氧化產物MDA含量的影響
蜂王漿對CCl4引起急性肝損傷小鼠肝勻漿中MDA含量影響的實驗和統計結果:模型組MDA的含量極顯著高于正常對照組、陽性對照組的(P<0.01),說明模型組小鼠肝臟脂質過氧化程度嚴重;正常對照組、陽性對照組、蜂王漿低劑量組、蜂王漿中劑量組和蜂王漿高劑量組的MDA含量之間無顯著差異(P>0.05),但它們都極顯著低于模型組的(P<0.01),說明飼喂一定劑量的蜂王漿對小鼠抗肝臟脂質過氧化具有極顯著作用(表3)。
表3 蜂王漿對CCl4肝損傷小鼠肝臟中MDA含量影響的實驗和統計結果(±s )
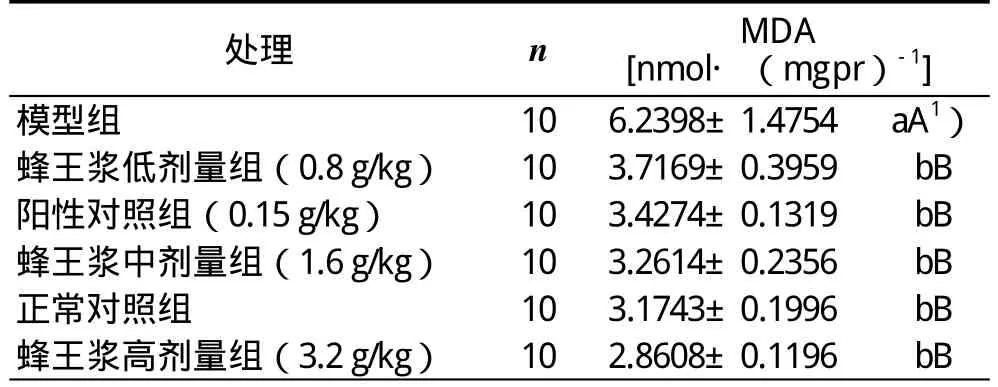
表3 蜂王漿對CCl4肝損傷小鼠肝臟中MDA含量影響的實驗和統計結果(±s )
注:1)小寫字母表示差異達顯著水平(P<0.05)。大寫字母表示差異達極顯著水平(P<0.01)
處理 n MDA[nmol·(mgpr)-1 ]模型組 10 6.2398±1.4754 aA1 )蜂王漿低劑量組(0.8 g/kg) 10 3.7169±0.3959 bB陽性對照組(0.15 g/kg) 10 3.4274±0.1319 bB蜂王漿中劑量組(1.6 g/kg) 10 3.2614±0.2356 bB正常對照組 10 3.1743±0.1996 bB蜂王漿高劑量組(3.2 g/kg) 10 2.8608±0.1196 bB
2.3 蜂王漿對CCl4引起急性肝損傷小鼠肝勻漿中GSH-Px含量的影響
蜂王漿對CCl4引起急性肝損傷小鼠肝勻漿中GSH-Px含量影響的實驗和統計結果:正常對照組、蜂王漿低劑量組、蜂王漿中劑量組和蜂王漿高劑量組的GSH-Px含量之間無顯著差異(P>0.05),但它們極顯著高于模型組的(P<0.01),且極顯著低于陽性對照組的(P<0.01),說明飼喂一定劑量的蜂王漿對小鼠肝臟細胞膜結構與功能完整性能起到極顯著的保護作用,但其保護作用極顯著不如采用聯苯雙酯的(表4)。
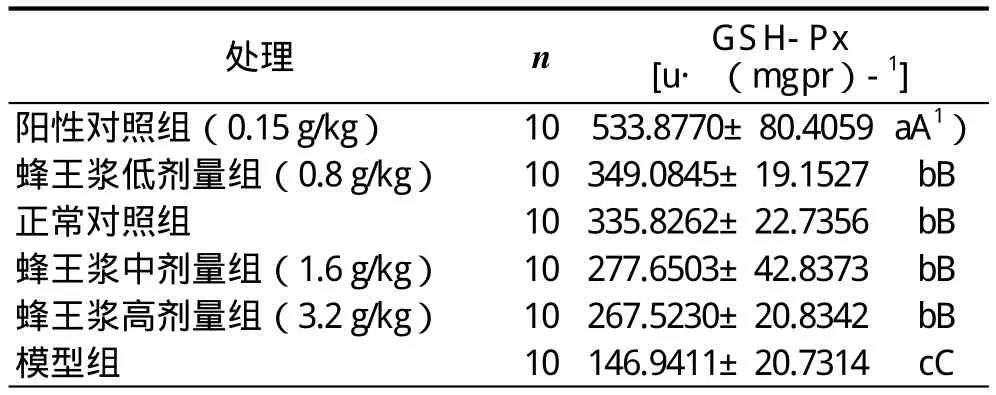
表4 蜂王漿對CCl4肝損傷小鼠肝臟中GSH-Px含量影響的實驗和統計結果(x± s )
3 討論
(1)CCl4引起的肝損傷是篩選保肝藥物而廣泛使用的實驗模型。本研究結果顯示:模型組的AST和ALT含量分別極顯著高于正常對照組的(P<0.01),表明本實驗小鼠急性肝損傷造模成功;飼喂高、中、低三個劑量蜂王漿組和正常對照組血清中的AST和ALT含量之間無顯著性差異(P>0.05),但它們都極顯著低于模型組的(P<0.01)。
模型組中AST和ALT含量高于正常對照組的,主要是由于CCl4作用于肝臟細胞,破壞細胞膜,細胞中的AST和ALT釋放出來造成的。
正常對照組、蜂王漿三個劑量組的AST和ALT含量之間無顯著性差異,這主要是由于飼喂一定劑量的蜂王漿對小鼠的肝細胞具有保護作用,但具有保護作用的適當劑量尚需進一步研究確定。
蜂王漿三個劑量組的AST和ALT含量極顯著低于模型組的,這可能是由于蜂王漿中一些抗氧化成分例如蛋白質[5]、抗氧化酶等減輕了CCl4對肝臟的作用。
上述結果表明蜂王漿對CCl4引起的急性肝損傷起到了一定的修復作用。
(2)有報道四氯化碳是毒性代謝物,經過細胞色素P450的作用,生成具有高活性的三氯甲基自由基(·CCl3),會嚴重的損害肝細胞[6]。·CCl3通過肝細胞內質網膜的NADH-依賴細胞色素P450進行轉換,能夠攻擊多元不飽和脂肪酸,引起脂質過氧化。脂質過氧化反應是產生細胞損傷的一個重要生物氧化過程。MDA是脂質過氧化形成的最終產物,MDA水平的測定也是評價脂質過氧化最常用的方法。
本研究結果顯示:模型組MDA的含量極顯著高于正常對照組(P<0.01),這主要是由于模型組小鼠肝臟脂質過氧化程度嚴重造成的;正常對照組、陽性對照組、蜂王漿各劑量組的MDA含量之間無顯著差異(P>0.05),但它們都極顯著低于模型組的(P<0.01),這可能是由于蜂王漿中含有豐富的抗氧化成分,減輕了自由基對肝臟中不飽和脂肪酸的損害所致。
(3)GSH-Px是一種重要的催化過氧化氫(H2O2)分解的酶,它特異性催化GSH對過氧化氫的還原反應,從而對細胞膜結構與功能完整性起到保護作用。GSH-Px也能催化氧化型谷胱甘肽(GSSH)轉變為還原型谷胱甘肽(GSH),加速體內毒性自由基的清除,從而減輕自由基對生物膜中不飽和脂肪酸的攻擊,有效地減少肝臟脂質過氧化損傷,增強肝細胞對自由基的抵抗力[7]。
本研究結果顯示:模型組GSH-Px的含量極顯著低于正常對照組(P<0.01);正常對照組、蜂王漿各劑量組的GSH-Px含量之間無顯著差異(P>0.05),但極顯著高于模型組的(P<0.01),這可能是由于蜂王漿中豐富抗氧化物質例如Cu/Zn-SOD[8]的作用,同時增強了機體清除自由基的能力,從而減輕自由基對膜上不飽和脂肪酸的損害所致。
蜂王漿各劑量組的GSH-Px含量極顯著低于陽性對照組的(P<0.01),這主要是由于蜂王漿畢竟不是藥物其對肝細胞膜結構與功能完整性的保護作用遠不及采用聯苯雙酯的緣故。
綜上所述,蜂王漿可以顯著改善轉氨酶的水平,減輕肝臟脂質過氧化程度,對肝損傷具有顯著的保護作用。
[1]方士英,姚宏偉,李俊,等.蟲草多糖對小鼠化學性肝損傷的保護作用[J].安徽醫科大學學報,2004,39(3):201-204.
[2]郭芳彬.蜂王漿與肝臟病[J].養蜂科技,2002,27(5):27-31.
[3]蘇曄等.蜂王漿化學成分、生理活性及應用[J].蜜蜂雜志,2000(9):23-24
[4]唐云安,劉玉清,王國欽.肝損傷動物模型研究進展[J].衛生毒理學雜志,2002,16(4):236-238.
[5]Takeshi Nagai,Reiji inoue.preparation and the functional properties of water extract and alkaline extract of royal jelly[J].Food chemistry,2004(84):181-186.
[6]Tomas,A.,Albano,E.,Banni,S.,Botti,B.,Corongiu,F.,Dessi,M.A.,Iannone,A.,Vannini,V.,Dianzani M.U.,1987.Free-radical metabolism of carbon tetrachloride in rat liver mitochondria.A study of the mechanism of activation.Biochem.J.246,313-317.
[7]Galle PR,Hofmann WJ,Walczak H,et al.Involvement of the CD95(APO21/Fas)receptor and ligand in liver damage.J Exp Med,1995;182:1223-1230.
[8]閔麗娥,李佳等,等.意蜂蜂王漿超氧化物歧化酶的分離純化及部分性質[J].昆蟲學報,2004,47(2):171-177.

