絲裂霉素C對瘢痕疙瘩成纖維細胞TGF-β和Smads表達的影響
孫 奎,吳曉明,張鴻霞,許新華,王鶴鵬,楊景哲,李樹松
(承德醫學院附屬醫院燒傷整形外科,河北承德067000)
瘢痕疙瘩是皮膚損傷后傷口愈合過程中出現成纖維細胞過度增殖、膠原大量沉積,也是皮膚損傷后組織異常修復的結果。目前,對瘢痕發生的機制仍知之甚少,因而臨床上亦遠未找到切實有效的防治措施。瘢痕疙瘩多采用局部藥物注射、壓迫治療、手術和激光治療等進行綜合治療,但效果不是很理想,因而瘢痕疙瘩也成了當今整形外科領域的一個研究熱點和難點[1]。現將絲裂霉素C(mitomycin C,MMC)對瘢痕疙瘩成纖維細胞(keloid fibroblast,KFB)轉化生長因子β(transforming growth factor-β,TGF-β)/Smads通路作用及機制報道如下。
1 資料與方法
1.1 一般資料 選擇2009年6月至2010年6月本院收治的瘢痕疙瘩進行整形手術的患者13例,其中,男9例,女4例;年齡12~46歲。取材部位:上肢5例,面部3例,軀干5例。入選標準為病程短且生長活躍的瘢痕疙瘩組織,未接受任何抑制瘢痕增生的治療,均無系統性疾病史,且對所取組織均知情同意。
1.2 標本的制作 將手術切下的瘢痕疙瘩組織采用組織塊貼壁培養法進行體外培養。在無菌條件下切除表皮及皮下脂肪,將標本制成1 mm3左右的組織塊,置于培養瓶中,在95%空氣、5%CO2、37℃、飽和濕度條件下培養8~12 h。然后加入含15%胎牛血清的達氏修正依氏培養基(Dulbecco′s modified eagle′s medium,DMEM)適量,繼續培養,3~4 d換液1次。2~3周后,原代細胞生長成單層,用0.25%胰蛋白酶消化后,按1∶3的比例傳代培養。常規培養KFB 24 h后,吸去培養液和未貼壁細胞,更換含不同藥物濃度的培養液,實驗分為對照組和MMC干預組,正常對照組用DMEM培養液;MMC干預組:MMC的終末濃度分別為2.50、12.50、50.00、100.00、200.00μg/L。
1.3 TGF-β1在mRNA水平的檢測 將成纖維細胞按10 cm2/mL比例加入Trizol,用Trizol總RNA提取試劑盒提取細胞總RNA,經紫外分光光度計(日本導津UV2201型)測定總RNA濃度和純度,重復測定3次,A260和A280之比值應在118~210,計算樣品總RNA濃度。引物序列為TGF-β1cD-NA擴增的上游引物為5′-CTG CTT CAG CTC CAC AGA GAA GA-3′,下游引物為5′-AAG TTG GCG TGG TAG CCC TT-3′,產物片段長度為111 bp。取1μg總RNA,加入Oligo(d T)18 Primer,70℃溫育5 min;迅速放入冰浴中,加入10 mmol/L d NTP,RNA酶抑制劑,5倍緩沖液,42℃溫育5 min;冰浴中加入5 U/μL AMV逆轉錄酶,加入DEPC處理水至總體積20μL,42℃溫育60 min,70℃10 min,立置冰上,-80℃冰箱保存備用。將反應管置于PCR儀上,95℃預變性10 min后,進入95℃變性1 min,50℃退火15 min,72℃延伸10 min的循環,共34次,最后72℃充分延伸10 min。反應完成后取10μL PCR反應液,經1%瓊脂糖凝膠電泳,用PCR Marker作相對分子質量標準。電泳完畢后在紫外熒光數字成像儀下觀察結果。以每例TGF-β1與β-actin擴增產物條帶吸光度的比值作為TGF-β1mRNA的相對表達量。
1.4 Western Blot檢測Smad2/3、Smad4、Smad7蛋白 取對數生長期的KFB,以5×105/mL接種于25 mL培養瓶內,CO2孵箱內,10%胎牛血清的DMEM培養液培養24 h,更換含不同藥物的培養液培養24 h,徹底去除上清液,加入適量細胞裂解液并加入PMSF(使PMSF終濃度為0.174 mg/mL),冰上作用40 min,12 000 r/min,4℃離心20 min,取上清液,以考馬斯亮藍法測定蛋白濃度。按4∶1比例加入5×Loading Buffer,封好EP管口,置水浴箱中變性5 min,進行穩壓電泳,以2 m A/cm2恒流 轉 膜,β-actin 4℃轉 膜2 h,Smad2/3、Smad4、Smad7 4℃轉膜3 h。2.5%封閉液配制抗體稀釋液,Smad2/3、Smad4及Smad7 1∶1 000稀釋,β-actin 1∶1 000稀釋。將聚偏二氟乙烯(PVDF)膜置于雜交袋中,加適量的抗體稀釋液于PVDF膜上有蛋白的一面,壓緊四角。4℃孵育過夜。TBST液洗膜后,加適量的抗體稀釋液于PVDF膜上有蛋白的一面,室溫作用2 h,TBST液洗PVDF膜后,暗室曝光,10 s~3 min,常規方法顯影、定影,直至顯影出電泳帶,拍照的圖像用灰度掃描軟件BandScan 4.5進行掃描,取得目的條帶灰度值,用該灰度值和內參β-actin灰度值相比,用相對灰度值在Excel中作圖分析。
1.5 統計學處理 應用SPSS11.5統計學軟件進行數據分析,計量資料以±s表示,進行方差分析,組間比較采用LSD-t檢驗,以P<0.05為差異有統計學意義。
2 結 果
不同濃度的MMC對TGF-β1mRNA表達,對照組和2.50、12.50、50.00、100.00、200.00μg/L的MMC干預組的TGF-β1mRNA相對表達量分別為0.88±0.07、0.80±0.06、0.51±0.04、0.47±0.05、0.36±0.03和0.22±0.02。MMC干預組TGF-β1mRNA相對表達量明顯低于正常對照組,見圖1~2。兩組Smad2/3、Smad4、Smad7蛋白的表達見表1。
表1 兩組Smad2/3、Smad4、Smad7蛋白的表達(±s,n=13)
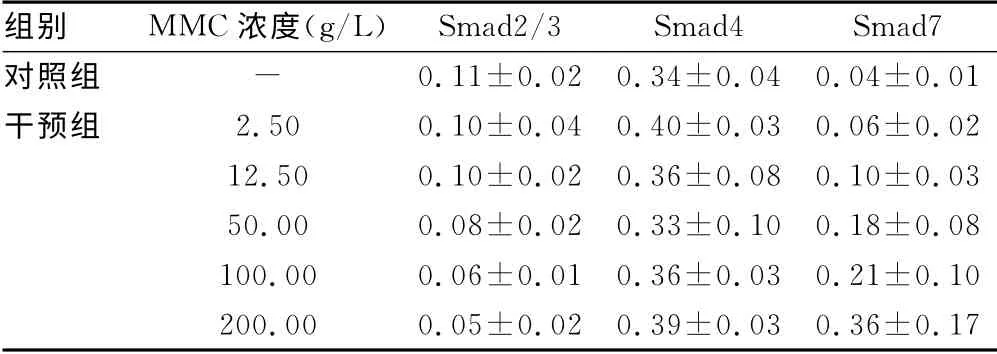
表1 兩組Smad2/3、Smad4、Smad7蛋白的表達(±s,n=13)
-:表示無數據。
組別 MMC濃度(g/L)Smad2/3 Smad4 Smad7對照組-0.11±0.02 0.34±0.04 0.04±0.01干預組 2.50 0.10±0.04 0.40±0.03 0.06±0.02 12.50 0.10±0.02 0.36±0.08 0.10±0.03 50.00 0.08±0.02 0.33±0.10 0.18±0.08 100.00 0.06±0.01 0.36±0.03 0.21±0.10 200.00 0.05±0.02 0.39±0.03 0.36±0.17
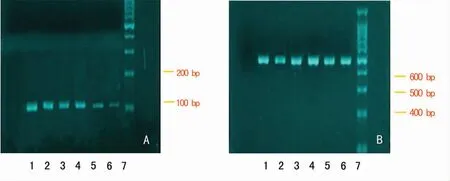
圖1 TGF-β1mRNA對KFB的表達
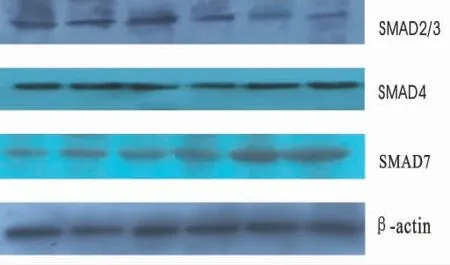
圖2 MMC對Smad2/3、Smad 4、Smad7 β-actin蛋白的表達
3 討 論
MMC是一種抗腫瘤藥物,還是一種強有力的抑制成纖維細胞增殖的藥物。MMC在耳鼻喉科、眼科、神經外科等領域中治療組織粘連比較廣泛,但在治療瘢痕增生的臨床及基礎研究較少。研究表明,MMC對KFB增殖有抑制作用,使細胞周期停滯于G1/S期而實現[2],并有時間依從性,同時與劑量密切相關[3]。有研究表明,手術切除瘢痕疙瘩后,局部使用絲裂霉素取得了滿意的臨床效果[4]。于冬梅等[5]研究表明,MMC對體外培養KFB增殖的抑制作用與藥物濃度、處理時間有關。劉鶯等[6]通過MTT檢測證實100μg/L MMC對KFB的增殖抑制效果為最佳,為該藥物臨床應用提供了有力的實驗依據。
TGF-β1是目前公認的與瘢痕疙瘩形成最為密切的細胞因子[7]。TGF-β家族成員對表皮細胞的生長、分化、凋亡及腫瘤形成具有調控作用[8]。TGF-β細胞表面受體主要分為Ⅰ、Ⅱ、Ⅲ型。其中TGF-β1直接刺激血管生成,刺激FB增殖及細胞中葡萄糖與氨基酸的轉運和糖酵解的進行,同時也抑制基質金屬蛋白酶活性和促進基質金屬蛋白酶組織抑制劑纖溶酶原激活物抑制劑-1基因的表達,進而抑制細胞外基質的降解;還介導血小板源性生長因子、結締組織生長因子的致纖維化作用[9];促進纖維粘連蛋白和膠原基質的黏附,促進瘢痕的形成。陳偉等[10]研究發現,TGF-β1的存在會不斷刺激KFB誘導基質產生,導致細胞基質的過度沉積。曹艷杰等[11]研究發現,丹參涂膜劑可改善增生期瘢痕微循環局部缺氧狀態,進而抑制瘢痕組織內細胞因子TGF-β1的表達。本研究結果顯示,干預組較對照組TGF-β1m RNA降低,隨作用時間增加TGF-β1mRNA表達變化越為明顯,在處理72 h后TGF-β1m RNA表達變化最為明顯,不同濃度MMC作用下TGF-β1m RNA表達量差異有統計學意義。提示MMC可能通過減少TGF-β1表達,從而起到抑制瘢痕增生的作用。
TGF-β信號主要由Smad家族介導,其作為配體形成受體復合物,激活Smad,轉移到細胞核內與TGF-β誘導基因的特定序列直接結合,共同激活或抑制其調節的靶基因轉錄[12]。Smad家族作為細胞質內TGF-β下游的信號轉導因子,在瘢痕疙瘩的發生、發展過程中起關鍵作用。根據結構和功能,Smad蛋白分成R-Smad、Co-Smad和I-Smad 3個亞家族。受體激活型或通路特異性主要包括Smad1、Smad2、Smad3、Smad5、Smad8。共同通路型主要是Smad4,其不能與TGF-β受體相互作用,但它可以與磷酸化的R-Smads相互作用形成穩定的異源三聚體[13-14]。抑制型包括Smad6和Smad7,它們主要通過競爭性地與激活的Ⅰ型體結合抑制R-Smads的磷酸化作用,ISmads作為一種負反饋調節信號調節TGF-β的信號轉導[15]。TGF-β/Smad信號通路是通過正、負反饋的調節通路自我調控的,一方面,Smad2/3發揮正反饋調節作用;另一方面,Smad7與激活的TGF-β1型受體結合,阻止R-Smad磷酸化,阻斷信號的傳導。已有研究表明,5-氟尿嘧啶(5-FU)有可能提高抑制型Smad(Smad6和Smad7)在胞質中的表達,使Smad3免受磷酸化,進而減少Smad3、Smad4雜絡物的生成,最終阻礙信號進一步下傳[16]。積雪草甙對增生性瘢痕內TGF-β1m RNA有明顯的抑制作用,能提高抑制型Smad7蛋白在胞質中的表達[17]。
本研究顯示,加入不同濃度的MMC能明顯增加KFB中Smad7蛋白的表達,減弱KFB中Smad2/3蛋白的表達,并且對KFB中Smad7蛋白的增強效應強于對Smad2/3蛋白的減弱效應,對Smad4蛋白的表達無變化。這可能是由于MMC通過增加Smad7蛋白的表達,通過競爭性占據TGF-β1型受體而抑制受體蛋白激酶對R-Smad(Smad2/3)的磷酸化,抑制TGF-β的病理性作用,從而達到抑制瘢痕增生的作用。
MMC依靠其強大的抑制成纖維細胞的功能廣泛應用于臨床,但目前對于其治療不同類型瘢痕的方法、劑量以及不良反應還沒有大樣本的臨床統計學資料。對于TGF-β/Smad信號通路作用研究獲得了迅猛發展,但仍有大量問題有待于深入研究。
[1]Kelly AP.Medical and surgical therapies for keloids[J].Dermatol Ther,2004,17(2):212-218.
[2]Fujiwara M,Muragaki Y,Ooshima A.Keloid-derived fibroblasts show increased secretion of factors involved in collagen turnover and depend on matrix metalloproteinase for migration[J].Br J Dermatol,2005,153(2):295-300.
[3]陳詩書,湯雪明.醫學細胞與分子生物學[M].北京:科學出版社,2004:717-722.
[4]Stewart CE,Kim JY.Application of mitomycin-C for head and neck keloids[J].Otolaryngol Head Neck Surg,2006,135(6):946-950.
[5]于冬梅,郝立君,李穎,等.絲裂霉素C對瘢痕疙瘩成纖維細胞增殖及凋亡的影響[J].中國臨床藥理學與治療學,2007,12(8):900-905.
[6]劉鶯,于冬梅,郝立君,等.絲裂霉素C對瘢痕疙瘩成纖維細胞Cyclin D1、CD K4及p27基因表達的影響[J].中國組織化學與細胞化學雜志,2008,17(2):126-131.
[7]Liu W,Wang DR,Cao YL.TGF-β:a fibrotic factor in wound scarring and a potential target for anti-scarring gene therapy[J].Curr Gene Ther,2004,4(1):123-136.
[8]Lopez-Casiilas F,Payne HM,Andres JL,et al.Betaglycan can act as a dual modulator of TGF-βaccess to signaling receptors:mapping of ligand binding and GAG attachment site[J].J Cell Biol,1994,124(4):557-568.
[9]Murata H,Zhou L,Ochoa S,et al.TGF-beta3 stimulates and regulates collagen synthesis through TGF-betal-dependent and independent mechanisms[J].J Invest Dermat,1997,8(3):258-262.
[10]陳偉,付小兵,葛世麗,等.增生性瘢痕形成和成熟過程中TGF-β1、TGF-β3及其受體的基因表達變化[J].中華整形外科雜志,2004,7(20):308-309.
[11]曹艷杰,王福波.丹參涂膜劑對肥厚性瘢痕裸鼠模型血液流變學及細胞因子TGF-β1、bFGF的影響[J].細胞與分子免疫學雜志,2010,28(6):135-137.
[12]郭永紅,羅金燕.TGF-β超家族與Smad信號轉導研究進展[J].醫學綜述,2005,11(8):685-688.
[13]Heldin CH,Miyazono K,Dijke P.TGF-beta signalling from cell membrane to nucleus through SMAD proteins[J].Nature,1997,390(6659):465-471.
[14]Shi Y,Hata A,Lo RS,et al.A structural basis for mutational inactivation of the tumour suppressor Smad4[J].Nature,1997,388(6637):87-93.
[15]Attisano L,Wrana JL.Signal transduction by the TGFbeta superfamily[J].Science,2002,296(5573):1646-1664.
[16]Wendling J,Marchand A,Mauviel A,et al.5-fluo-rouracil blocks transforming growth factor-beta-inducedα2 typeⅠcollagen gene(COL1A2)expression in human fibroblasts via c-Jun NH2-terminal kinase/activator protein-1 activation[J].Mol Pharmacol,2003,64(3):707-713.
[17]Tateshita T,Ono I,Kaneko F,et al.Effect of collagen matrix containing transforming growth factor(TGF)-beta(I)on wound contraction[J].Dermatol Sci,2001,27(2):104-113.

