利多卡因?qū)Φ脱酢⑺嶂卸炯澳I上腺素條件下豚鼠左心室流出道心肌組織電活動的影響*
趙蘭平, 王雪芳, 杜會博, 薛淑芳, 陳彥靜
心室流出道一向僅被認為是血液的輸出路徑,因而對它的生理特性一直未予重視。哺乳類的心室流出道在發(fā)生上系由動脈球演化而來,在人胚早期仍有動脈球(心球,bulbus cordis)階段。在魚及兩棲類的心臟上,動脈球是位于心室之后的一個獨立功能單位,它的興奮和收縮發(fā)生在心室之后。在心電圖上,其除極波和復(fù)極波分別出現(xiàn)在心室的 QRS波和T波之后,是一組獨立的波形,分別被稱為QRSb(bulbar QRS)和Tb(bulbar T)波。課題組前期的研究工作中,首先在豚鼠,接著在大鼠和兔的左心室流出道主動脈前庭的特定部位,首次發(fā)現(xiàn)存在慢反應(yīng)自律細胞。在去除大部心室肌、消除心室節(jié)律的影響后,該部位仍能帶領(lǐng)周圍的前庭組織產(chǎn)生自發(fā)的節(jié)律性興奮,其自律細胞0期、4期去極離子流與竇房結(jié)起搏細胞有基本相似的特性[1],而且其電活動可能同樣受自主神經(jīng)的調(diào)控[2]。起源于心室流出道的特發(fā)性室性心動過速可發(fā)生于各個年齡階段,為進一步探討心室流出道的電活動與心律失常的關(guān)系,本實驗采用標準玻璃微電極細胞內(nèi)電位記錄技術(shù),觀測了利多卡因?qū)﹄嗍笞笮氖伊鞒龅佬募〗M織電活動的影響及其對低O2、酸中毒及腎上腺素(epinephrine,EPI)條件下該部位電生理特性改變的影響,以期望為進一步闡明心室流出道的電活動提供直接的實驗依據(jù)。
材料和方法
1 標本制備
健康豚鼠(250~350 g),擊昏后迅速開胸取出心臟,并用O2飽和的改良Locke液(mmol/L:NaCl 157,KCl 5.6,CaCl22.1,NaHCO31.8,葡萄糖 5.6,pH 7.3~7.4)經(jīng)冠脈進行灌注沖洗后,從主動脈瓣的左瓣與后瓣間向下剪開心室,保留各瓣膜完整,并以此為寬度,向下切取約4 mm的前庭組織制成標本。制好的標本用不銹鋼針固定于灌流槽(1.5 cm×2 cm)內(nèi)的硅橡膠上。用O2飽和的改良Locke液進行恒溫(35℃ ±1℃)、恒速(10 mL/min)灌流,標本在灌流液中穩(wěn)定30 min后開始實驗。
2 電位引導(dǎo)
玻璃微電極充以飽和KCl電極液后直流電阻為10~20 ΜΩ。如能直接記錄到自發(fā)電位,則不再進行刺激,若記錄不到,則將刺激電極置于標本遠離瓣膜一端的心肌組織上,給予波寬2 ms、1 Hz、2倍閾強度的方波刺激,刺激時間由數(shù)秒至數(shù)分鐘不等,直至誘發(fā)出穩(wěn)定的自發(fā)節(jié)律,即停止電刺激開始實驗。引導(dǎo)出的自發(fā)慢反應(yīng)電位,經(jīng)SWF-1B高阻抗微電極放大器放大,一路輸入監(jiān)聽器監(jiān)聽,另一路采用RM6280多道生理信號采集處理系統(tǒng),自動顯示電信號,并分析自發(fā)慢反應(yīng)電位的各項參數(shù)指標。
3 觀測指標
4相自動除極速度(velocity of diastolic depolarization,VDD)、自發(fā)放電頻率(rate of pacemaker firing,RPF)、最大舒張電位(maximal diastolic potential,MDP)、0相最大除極速度(maximal rate of depolarization,Vmax)、動作電位幅度(amplitude of action potential,APA)、復(fù)極50%和80%時間(50%and 80%of duration of action potential,APD50and APD80)。
4 實驗過程和分組
待自發(fā)節(jié)律穩(wěn)定10 min后,開始采集一組正常的自發(fā)慢反應(yīng)電位做對照,然后改用含有一定濃度的藥液灌流(為保證藥效,各種藥液均在實驗前1 h內(nèi)配制。)。實時記錄并分析自發(fā)慢反應(yīng)電位的變化。實驗分組如下:(1)0.1 μmol/L、1 μmol/L 和 10 μmol/L利多卡因?qū)﹄嗍笞笮氖伊鞒龅雷园l(fā)慢反應(yīng)電位的影響(n=9);(2)1 μmol/L利多卡因?qū)Φ蚈2電生理效應(yīng)的影響(n=9);(3)1 μmol/L利多卡因?qū)λ嶂卸倦娚硇?yīng)的影響(n=9);(4)1 μmol/L利多卡因?qū)?0 μmol/L EPI電生理效應(yīng)的影響(n=9)。
5 統(tǒng)計學(xué)處理
數(shù)據(jù)以均數(shù)±標準差(mean±SD)表示,給藥前后各項指標采用配對樣本t檢驗,多組間比較用單因素方差分析(One-way ANOVA),應(yīng)用 SPSS 15.0統(tǒng)計軟件對數(shù)據(jù)進行處理。
結(jié) 果
1 利多卡因?qū)﹄嗍笞笮氖伊鞒龅雷园l(fā)慢反應(yīng)電位的影響
0.1 μmol/L利多卡因灌流豚鼠左心室流出道標本10 min,APD50顯著縮短,VDD和RPF明顯減慢,和正常對照組相比有顯著差異(P<0.05),其它指標無明顯改變,見圖1和表1。
1 μmol/L利多卡因灌流10 min,和正常對照組相比,MDP絕對值明顯減小(P<0.05),APD50和APD803 min時開始縮短,5 min時明顯縮短(APD50,P<0.01;APD80,P<0.05),VDD 和 RPF在給藥 1 min時開始減慢,3 min時明顯減慢(P<0.05),并在整個灌流過程中維持相對穩(wěn)定;與0.1 μmol/L利多卡因灌流組相比,各項指標之間無顯著性差異,見圖1和表1。
10 μmol/L利多卡因灌流10 min,和正常對照組相比,MDP絕對值和APA明顯減小(P<0.05),Vmax明顯減慢(P<0.05),APD50(P<0.01)和 APD80(P<0.05)明顯縮短,VDD(P<0.05)和 RPF(P<0.01)進一步減慢;與0.1 μmol/L利多卡因灌流組相比,RPF、MDP絕對值和Vmax顯著減小(P<0.05);與1 μmol/L利多卡因灌流組相比,Vmax顯著減慢(P<0.05)。10 μmol/L利多卡因灌流過程中,節(jié)律較規(guī)整。沖洗10 min,自發(fā)節(jié)律恢復(fù)至給藥前水平,見圖1和表1。

Figure 1.Effects of lidocaine on the spontaneous action potentials of guinea-pig left ventricular outflow tract.圖1 利多卡因?qū)﹄嗍笞笮氖伊鞒龅雷园l(fā)慢反應(yīng)電位的影響
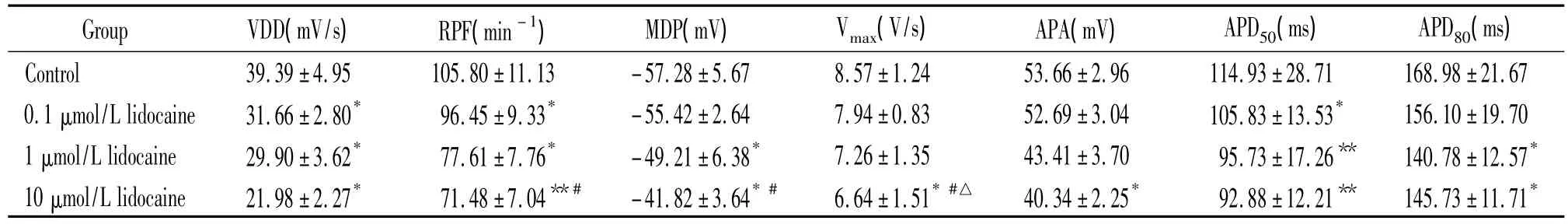
表1 利多卡因?qū)﹄嗍笞笮氖伊鞒龅雷园l(fā)慢反應(yīng)電位的影響Table 1.Effects of lidocaine on the spontaneous action potentials of guinea-pig left ventricular outflow tract(mean±SD.n=9)
2 1 μmol/L利多卡因?qū)Φ蚈2電生理效應(yīng)的影響
用無糖低O2液灌流15 min,MDP絕對值和APA明顯減小(P<0.05),Vmax顯著減慢(P<0.05),APD50顯著縮短(P<0.05),APD80有縮短趨勢,但無顯著差異,VDD和RPF在無糖低O2液灌流1 min時開始有所加快,出現(xiàn)一過性節(jié)律增快現(xiàn)象,但隨著灌流時間延長,VDD和RPF逐漸減慢,15 min時明顯減慢,和正常對照組相比,顯著差異(P<0.05)。在此基礎(chǔ)上改用1 μmol/L利多卡因+無糖低O2液灌流10 min,和無糖低O2組相比,MDP絕對值增大(P<0.01),APA 進一步降低(P <0.05),Vmax進一步減慢(P<0.05),APD50和 APD80無明顯改變,VDD 和RPF進一步減慢,和無糖低O2液灌流組相比,顯著差異(P<0.05)。而且在1 μmol/L利多卡因+無糖低O2液灌流過程中,自發(fā)節(jié)律較穩(wěn)定,見圖2和表2。
3 1 μmol/L利多卡因?qū)λ嶂卸倦娚硇?yīng)的影響
配制O2飽和的改良Locke液,調(diào)節(jié)pH為6.8,造成酸中毒的灌流液,此值是在心肌缺血、梗死的局部內(nèi)環(huán)境中常見的。在10 min的灌流過程中,和對照組相比,MDP絕對值增大(P<0.05),APA明顯減小(P <0.05),Vmax減慢(P <0.05),APD50和 APD80在灌流3 min時開始縮短,5 min時明顯縮短(P<0.05),VDD和RPF在灌流10 min時明顯減慢,和正常對照組相比,顯著差異(P<0.05)。在此基礎(chǔ)上,改用pH 6.8 1 μmol/L 利多卡因灌流10 min,MDP 絕對值進一步增大,Vmax進一步減慢,和pH 6.8灌流組相比,顯著差異(P<0.05),APD50和APD80明顯延長(P<0.05),VDD和RPF在灌流3 min時進一步減慢,10 min時明顯減慢,和pH 6.8灌流組相比,顯著差異(P<0.05),見圖2和表2。
4 1 μmol/L 利多卡因?qū)?0 μmol/L EPI電生理效應(yīng)的影響
用 10 μmol/L EPI灌流 10 min,MDP 絕對值(P<0.01)和APA(P<0.05)明顯增大,Vmax加快(P <0.01),APD50和 APD80明顯縮短(P <0.05),VDD 和RPF在給藥30 s即開始增快,3 min時明顯增快(VDD,P<0.01;RPF,P <0.05),并維持在此水平。用10 μmol/L EPI灌流 10 min,改用 1 μmol/L 利多卡因+10 μmol/L EPI灌流 10 min,MDP 絕對值和APA在灌流5 min時開始降低,10 min時明顯降低,和10 μmol/L EPI灌流組相比,顯著差異(P<0.05),APD50和 APD80明顯延長(P <0.05),VDD 和RPF 3 min時開始減慢,10 min時明顯減慢,和10 μmol/L EPI灌流組相比,顯著差異(VDD,P<0.05;RPF,P <0.01),見圖2和表2。

Figure 2.Effects of lidocaine on the spontaneous action potentials of guinea-pig left ventricular outflow tract induced by hypoxia,acidosis and EPI.圖2 利多卡因?qū)Φ脱酢⑺嶂卸炯癊PI所致豚鼠左心室流出道自發(fā)慢反應(yīng)電位改變的影響

表2 利多卡因?qū)Φ脱酢⑺嶂卸炯癊PI所致豚鼠左心室流出道自發(fā)慢反應(yīng)電位改變的影響Table 2.Effects of lidocaine on the spontaneous action potentials of guinea-pig left ventricular outflow tract induced by hypoxia,acidosis and EPI(mean±SD.n=9)
討 論
特發(fā)性室性心律失常(idiopathic ventricular tachycardia,IVT)臨床上較為常見,其中起源于右心室流出道的IVT約占所有IVT的80%,其產(chǎn)生機制折返、異常自律性增高和觸發(fā)激動均有可能。本室以前的工作在國內(nèi)外首次證明[1-2],在豚鼠、家兔、大鼠等左心室流出道部位仍存在慢反應(yīng)自律細胞,且具有與竇房結(jié)起搏細胞相似的特征和離子流基礎(chǔ),即0期主要離子流為ICa-L,3期主要離子流為IK,4期自動去極中,除IK的進行性衰減外,還有ICa-L、ICa-T和If的參與。而且其電活動可能受自主神經(jīng)的調(diào)控,其中主要受心交感神經(jīng)及體液中兒茶酚胺(catecholamine,CA)的調(diào)節(jié)。說明心室流出道部位可能作為心臟的另一潛在起搏點,在自主神經(jīng)功能紊亂或CA分泌異常時自律性改變而參與IVT的發(fā)生和發(fā)展。
利多卡因?qū)佗馼類抗心律失常藥,輕度阻滯Na+通道,屬膜穩(wěn)定劑,是目前防治急性心肌梗死及各種心臟病并發(fā)室速的常用藥物。研究表明利多卡因溫心停搏液可明顯抑制ICa-L峰值的幅值[3],大劑量時可抑制海馬神經(jīng)元L-型鈣通道[4],但利多卡因?qū)π募Ca-L的直接影響未見相關(guān)報道,本實驗中利多卡因?qū)е碌腁PA減小和Vmax減慢可能與ICa-L的抑制有關(guān)。心室流出道自律細胞4期自動除極可能有If參與,利多卡因可輕度抑制If,并可促進3相K+外流,故可使自律性降低。利多卡因可抑制K+通道抑制劑所導(dǎo)致的APD延長[5],故可通過增強延遲整流鉀電流(IKr)而導(dǎo)致APD縮短,本實驗中以APD50縮短較明顯。利多卡因?qū)π氖伊鞒龅雷月杉毎碾娚硇?yīng)是劑量依賴性的、可逆的,正常灌流液沖洗10 min RPF可恢復(fù)正常,而胺碘酮的作用較持久,正常灌流液沖洗很難恢復(fù)到正常水平[6],提示短期治療室性心律失常可優(yōu)先選擇利多卡因,長期用藥維持則可選用胺碘酮。
心肌缺氧時,ATP敏感性鉀通道(KATP)激活,使復(fù)極化K+外流增加[7],實驗表明模擬缺血缺氧狀態(tài)可導(dǎo)致APD縮短[8],同時抑制電壓依賴性鈣通道,Ca2+內(nèi)流減少。全細胞膜片鉗技術(shù)的研究證實缺氧預(yù)適應(yīng)(HP)時If密度值明顯減小[9]。近年來的研究表明,缺氧可使快速起搏的心室肌細胞更容易發(fā)生鈣瞬變交替,即降低了快速起搏的刺激閾值,是惡性心律失常的重要預(yù)測指標[10]。乳酸酸中毒可抑制慢鈣電流,故可減慢竇房結(jié)優(yōu)勢起搏細胞的4相自動去極速度,正常生理狀態(tài)下起作用的IK受抑制,而導(dǎo)致 KATP開放[11],自發(fā)慢反應(yīng)電位復(fù)極化時間縮短。EPI可作用于心肌細胞的β1-AR,通過激活G蛋白-AC-cAMP途徑增加ICa-L和If而導(dǎo)致自發(fā)節(jié)律加快。采用EPI復(fù)制家兔快速性心律失常模型也可以引起KATP激活[12]。利多卡因可明顯降低EPI導(dǎo)致的自律性升高,無糖低O2和pH 6.8的灌流液灌流時,利多卡因可使其自律性進一步降低,說明利多卡因?qū)υ从谛氖伊鞒龅赖目焖傩允倚孕穆墒СS幸欢ǖ母深A(yù)作用。
[1] 張曉云,陳彥靜,葛賦貴,等.兔主動脈前庭自律細胞與竇房結(jié)電生理特性的比較[J].生理學(xué)報,2003,55(4):405-410.
[2] 趙蘭平,張曉云,陳彥靜,等.神經(jīng)遞質(zhì)對豚鼠左心室流出道自律細胞電活動的影響[J].生理學(xué)報,2005,57(5):593-598.
[3] 王 濤,蘭鴻鈞,王忠民,等.利多卡因溫血心停搏液對豚鼠心室肌細胞L-型鈣通道的作用[J].中華實驗外科雜志,1999,16(2):108-109.
[4] 張慶國,徐世元,雷洪伊.利多卡因?qū)Υ笫蠛qR神經(jīng)元L-型Ca2+通道電流的影響[J].臨床麻醉學(xué)雜志,2007,23(7):599-600.
[5] Abrahamsson C,Carisson L,Duker G.Lidocaine and nisoldipine attenuate almokalant-induced dispersion of repolarization and early afterdepolarizations in vitro[J].J Cardiovasc Electrophysiol,1996,7(11):1074-1081.
[6] 趙蘭平,王雪芳,陳彥靜,等.胺碘酮對低O2、酸中毒及腎上腺素條件下豚鼠左心室流出道自律細胞電活動的影響[J].中國病理生理雜志,2010,26(7):1295-1300.
[7] 祝 芬,馬季驊,張培華.牛磺酸對低氧條件下豚鼠心室肌細胞動作電位和ATP敏感性鉀電流的影響[J].中國病理生理雜志,2005,21(1):92-95.
[8] 張春芳,孟 濤,趙志誠,等.養(yǎng)心顆粒對缺血缺氧心室肌細胞延遲整流鉀電流的影響[J].中醫(yī)藥信息,2012,29(3):33-36.
[9] 張 倩,宋治遠,仝識非,等.線粒體KATP通道開放劑與缺氧預(yù)適應(yīng)對乳鼠竇房結(jié)細胞起搏離子流作用的比較[J].中國病理生理雜志,2006,22(10):1909-1912.
[10]趙 斌,王禮春,莊曉東,等.缺氧易化快速起搏引起的心室肌細胞鈣瞬變交替[J].中國病理生理雜志,2012,28(8):1405-1409.
[11]趙向東,王佩顯,陳元祿.乳酸酸中毒對兔竇房結(jié)優(yōu)勢起搏細胞動作電位的影響[J].天津醫(yī)藥,2001,29(12):736-738.
[12]客 蕊,周亞濱,孫 靜.養(yǎng)心顆粒對藥物誘發(fā)的快速型心律失常模型心肌ATP敏感性鉀通道影響的研究[J].中醫(yī)藥信息,2012,29(3):102-105.

