A→O血型轉變制備通用型紅細胞過程中殘留α-N-乙酰半乳糖胺酶檢測方法的建立
高紅偉 ,李素波 ,鮑國強 ,張雪 ,徐麗娟 ,檀英霞 ,王穎麗 ,季守平 ,宮鋒
軍事醫學科學院 a.野戰輸血研究所,北京 100850;b.附屬醫院輸血科,北京 100071
紅細胞血型轉變技術是解決血型錯配和血液浪費的重要技術之一。本研究室于1999年開始血型轉變工作,已成功地將B型紅細胞轉變為O型,并獲得國家食品藥品監督管理局的臨床研究批文[1-2]。由于A型紅細胞的抗原結構比較復雜,A型紅細胞血型改造工作在國內外都進展不大,直到2007年,ZymeQuest公司的Liu等從原核生物中克隆并表達了新型的α-N-乙酰半乳糖胺酶(α-N-acetylgalactos?aminidase,NAGA),開始了A型紅細胞血型轉變的新紀元[3]。本研究室也同期開展了A→O血型轉變的研究工作,并從國內臨床的腦膜膿毒性金黃桿菌(Elizabethkingia meningosepticum)標本中克隆出新型NAGA基因,用于A→O血型轉變研究。重組表達的NAGA底物專一性強、比活力高,在接近紅細胞的生理條件下,能成功地將A型紅細胞轉變為O型紅細胞[4]。
酶解轉變的O型紅細胞用于臨床的關鍵問題之一就是不能攜帶任何外源蛋白進入人體,因此檢測酶解改造O型紅細胞中是否殘留NAGA及確定其殘留量是必須解決的問題。酶聯免疫吸附測定技術(ELISA)是檢測微量蛋白的常規方法之一,可以檢測到納克(ng)級的微量蛋白。由于市場上沒有針對腦膜膿毒性金黃桿菌NAGA的商品化抗體出售,因此我們自制了NAGA的兔多抗,并進行了特異性驗證[5]。另外,本研究室克隆的NAGA的C端帶有6×His標簽,因此我們擬利用NAGA的兔多抗和抗His的單抗,采用間接ELISA法檢測A→O血型轉變終產品中及洗滌過程中NAGA的殘留量,為酶解法制備的通用型紅細胞的安全性評價提供簡單實用的檢測方法。
1 材料與方法
1.1 材料
健康人A型血由軍事醫學科學院附屬醫院輸血科提供;重組NAGA(純度>95%)為本研究室制備[4];NAGA的兔多抗(rProtein A純化,純度>95%,效價1∶1×105)為本研究室制備[5];鼠抗 His單抗、辣根過氧化物酶(HRP)標記的羊抗鼠IgG為中杉公司產品;TMB為Sigma公司產品;紅細胞裂解液購自碧云天生物技術研究所;其他試劑為國產分析純產品。紅細胞專用水平離心機為KUBOTA 2100;紅細胞酶解反應箱由本研究室和軍事醫學科學院儀器中心聯合研制。
1.2 微量NAGA檢測方法的建立
采用間接ELISA方法進行檢測。以10 μg/mL NAGA兔多抗包被酶聯板(100 μL/孔),4℃濕盒中孵育過夜,次日洗板封閉后加入不同濃度的NAGA(從微克級依次梯度稀釋至皮克級),37℃孵育1 h,洗板后加入100 μL抗His單抗(1∶3000稀釋),37℃孵育0.5 h,洗板后加入100 μL HRP標記的羊抗鼠IgG(1∶10 000稀釋),37℃孵育0.5 h,洗板,TMB顯色,檢測D450nm值,并制作標準曲線。
1.3 紅細胞的酶解
將健康人A型血于2000 r/min離心5 min,去上清,取1 mL壓積紅細胞(packed red blood cells,pRBC),用酶解緩沖液(250 mmol/L甘氨酸,3 mmol/L NaCl,pH6.8)按1∶4的體積比洗2次,按0.015 mg/mL pRBC加入NAGA,放入紅細胞酶解反應箱中于26℃緩慢上下振蕩孵育1 h,待血型轉變為O型后停止孵育,用PBS按1∶4的體積比洗滌紅細胞4次,2000 r/min離心5 min后棄上清,保留每次洗滌上清和每次洗滌后的紅細胞以備檢測。
1.4 殘留酶的檢測
對4次洗滌上清用上述建立的間接ELISA方法直接進行檢測,每次洗滌后獲得的紅細胞用紅細胞裂解液按1∶9的體積比裂解后檢測。
2 結果
2.1 微量NAGA檢測方法的建立
采用間接ELISA法,經過3次獨立重復,繪制的標準曲線基本一致,在1~15 ng/mL區間的標準曲線如圖1所示。本法的檢測下限為1 ng/mL。
2.2 殘留酶的檢測結果
將4次洗滌上清和每次洗滌后的紅細胞裂解液用上述建立的間接ELISA方法直接進行檢測,檢測結果見表1。通過對洗滌后的紅細胞和洗滌液中殘留酶量的檢測,確定經過4次洗滌后,殘留酶量達到檢測水平以下。
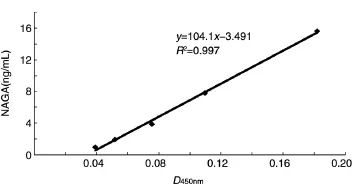
圖1 微量NAGA檢測的標準曲線

表1 通用型紅細胞制備過程中殘留NAGA的檢測
3 討論
在A→O血型轉變過程中,NAGA是惟一引入的外源蛋白,因此在A→O酶解轉變反應完成后,將NAGA清洗到安全微量,是通用型紅細胞臨床前研究中必須解決的問題。在B→O血型轉變的研究中,美國紐約血液研究中心在洛克菲勒醫院臨床研究中心進行的臨床試驗結果證明,當一個單位(200 mL)的通用型紅細胞(由B型紅細胞酶解制備的O型紅細胞)中殘留的α-半乳糖苷酶總量為2.6±1.9 μg(相當于22.5 ng/mL)時,受試的4名健康成年人均未產生抗α-半乳糖苷酶抗體[6]。參考美國FDA的標準,我們在B→O研究中最后確定制備的酶解轉變的人O型紅細胞(ECHORBC)中殘留α-半乳糖苷酶的安全劑量為10 ng/mL[7]。關于A→O血型轉變中通用型紅細胞中殘留NAGA的安全劑量,至少也應達到納克級,因此,我們需要建立能夠檢測納克級NAGA的方法。
我們曾報道用SDS-PAGE銀染法結合酶活性測定來檢測由B型血制備的通用型血中α-半乳糖苷酶的殘留量[7],但這種方法的最低檢測限為10 ng/孔,因此檢測下限只能到1 μg/mL,為了檢測洗滌上清中的殘留酶量,必須將洗滌上清超濾濃縮后再檢測,步驟較繁瑣且不能準確定量。ELISA是檢測微量蛋白的常規方法之一,可檢測到納克級的微量蛋白。因此我們自制了NAGA的特異性兔多抗,利用此兔多抗和抗His的單抗,建立了間接ELISA法檢測A→O血型轉變終產品中及洗滌過程中NAGA殘留量的方法,結果顯示該方法的檢測下限為1 ng/mL,在我們需要的檢測范圍(1~15 ng/mL)具有良好的線性關系(R2=0.997)。該方法不僅比SDS-PAGE銀染法、酶活性測定法靈敏,還具備操作簡單、重復性好等優點,為酶解法制備的通用型紅細胞的安全性評價提供了簡單實用的檢測方法。
[1]Zhang Yang-pei,Gong Feng,Bao Guo-qiang,et al.B to O erythrocyte conversion by the recombinant α-galactosidase[J].Chinese Med J,2007,120(13):1145-1150.
[2]鮑國強,章揚培.ABO血型改造制備通用型紅細胞[J].中國輸血雜志,2008,21(12):909-911.
[3]Liu Q Y,Sulzenbacher G,Yuan H,et al.Bacterial glycosidas?es for the production of universal red blood cells[J].Nat Bio?technol,2007,25(4):454-464.
[4]郁成雨,徐華,王立生,等.新型高比活力α-N-乙酰半乳糖胺酶應用于人紅細胞A→O血型改造[J].科學通報,2008,53(11):1288-1295.
[5]李素波,張雪,鮑國強,等.α-N-乙酰半乳糖胺酶多克隆抗體的制備及特異性鑒定[J].中國輸血雜志,2012,25(7):652-654.
[6]Lenny L L, Hurst R, Goldstein J,et al. Transfusions to group O subjects of 2 units of red cells enzymatically convert?ed from group B to group O[J].Transfusion,1994,34(3):209-214.
[7]王穎麗,由英,高紅偉,等.B→O血型改造制備通用型血過程中殘留工具酶的檢測[J].軍事醫學科學院院刊,2004,28(6):546-548.

