北京市昌平區保健食品企業標準制訂與執行情況調研報告(上)
北京市藥品監督管理局昌平分局
□文 武貴勉
保健食品企業標準既是保健食品生產企業控制產品質量、依法組織生產的主要標準,也是藥監部門依法開展保健食品質量監管的重要依據。企業標準技術性高、法規性強,而且必須依據生產場所、生產設備、出廠檢驗設備等的特點和有關標準規定進行制訂,以使產品能按照企業標準組織生產和檢驗,確保產品質量穩定。本文以基層監管的角度,結合歷年監督檢查情況,對昌平區保健食品生產企業制訂的56份企業標準進行了分析,發現企業標準在制訂和執行過程中存在諸多問題。
1 企業標準制訂中的問題
1.1個別原料標準制訂脫離實際。目前,昌平區共有4種保健食品使用了絞股藍原料,其企業標準都規定絞股藍原料應符合《中華人民共和國藥典》的規定,但實際上《中華人民共和國藥典》中并沒有對絞股藍原料的相關標準進行規定。
1.2出廠檢測項目標準高低不一。產品的出廠檢測是質量控制的關鍵環節,從對出廠檢測項目的匯總結果看,企業制訂的出廠檢測項目標準高低差異很大。有的標準制定過高,例如:規定出廠檢測項目包括致病菌、總黃酮、人參皂甙和重金屬等,而有的出廠檢驗項目標準制定過低,個別企業產品出廠檢驗甚至對基本的衛生學檢測項目都未做要求。經統計,昌平區共有4個品種的企業標準在出廠前沒有微生物檢測項目,3個品種出廠前只做感官、包裝外觀和凈含量檢測。
1.3某些標準表達不明確。監督檢查中發現,個別企業標準表達不明確,致使實際生產過程中根本無法操作。如原料要求,只規定原料應符合國家相關規定及標準的要求,并沒有具體指明哪種原料應符合國家哪個規定或標準的要求。有的企業標準,在出廠檢驗項目中只籠統注明理化指標、微生物,卻沒有明確應具體檢測哪幾項理化或微生物指標。
1.4對留樣量和批次的確定標準不一。《保健食品良好生產規范》規定:“每批產品均應有留樣,留樣應存放于專設的留樣庫(或區)內,按品種、批號分類存放,并有明顯標志。”但在具體留樣量上卻沒有規定標準,一般由企業根據產品的實際檢測用量來確定。藥品生產企業一般能做到3次全項檢驗用量,而保健食品生產企業很難做到。通過查閱56份企業標準,發現只有21個企業標準對留樣量有規定,規定的留樣量標準也不同,一般為3~7盒/瓶/袋,只有兩個產品的企業標準規定留樣量為全檢的1倍量。統計結果反映了保健食品生產企業與藥品生產企業相比,對留樣的重視程度遠遠不夠。
嚴格生產批號管理在質量保證上也具有重要意義。批號可以追溯和審查該批產品的生產歷史,監管部門也可依據該批產品的抽檢情況及生產、使用中出現的情況進行產品質量監督,一旦抽檢不合格,整批產品就會召回、銷毀。《保健食品良好生產規范》要求,生產批次的劃分應當能確保同一批次產品質量和特性的均一性,應當建立編制生產批號和確定生產日期的規程。通過查閱56份企業標準,筆者發現企業制訂的組批規則卻不盡相同(見表1)。
1.5同類產品企業標準存在差異。筆者將不同廠家、相同原料、相同保健功能、相同劑型的同類產品的企業標準進行了對比分析(見表2、表3)。
1.6功效成分含量的規定與批準證書不一致。監督檢查中發現,企業標準與保健食品批準證書中對功效成分含量規定不一致(見表4)。
另外,企業標準的編寫格式應符合GB/T1.1-2000《標準化工作導則》的規定。監督檢查中發現企業標準在編寫結構和格式上仍然存在許多問題,由于此類問題已有諸多文獻進行了說明,這里不再贅述。

表1 企業標準中不同的組批規則
2 企業標準執行中的問題
制訂完成的企業標準只有通過全面貫徹實施,才能真正發揮控制產品質量的作用。因此,企業標準的執行尤為重要。企業應該按照企業標準中有關原料、成品、包材等要求組織生產,執行過程中不能打折扣或與企業標準相偏離。
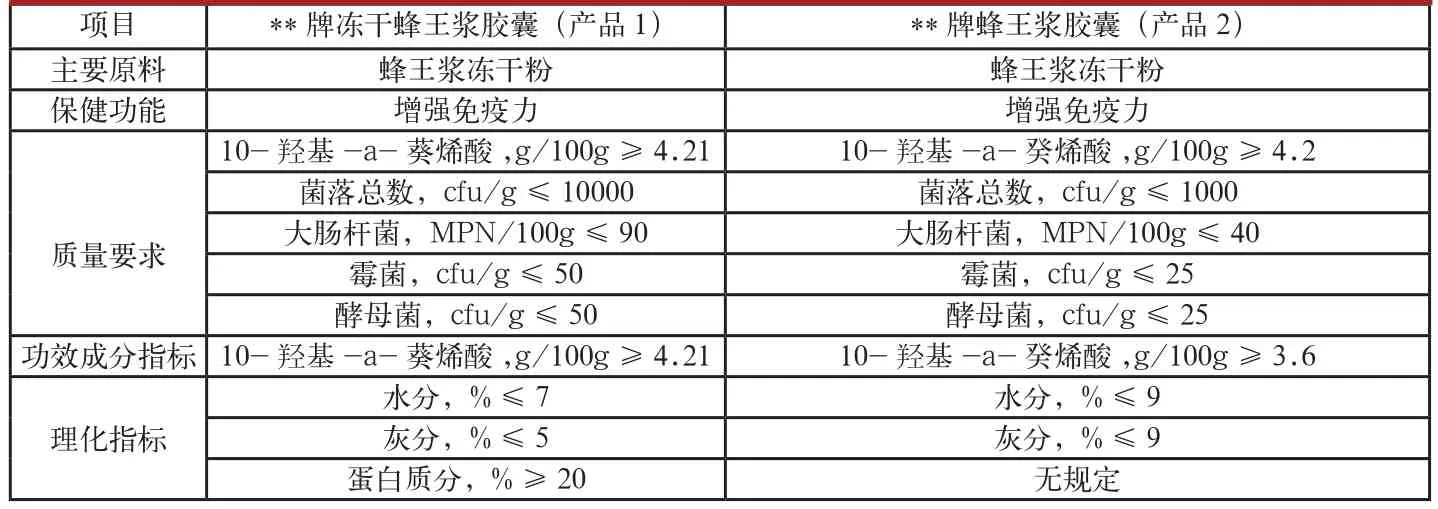
表2 不同廠家的凍干蜂王漿膠囊產品企業標準對比
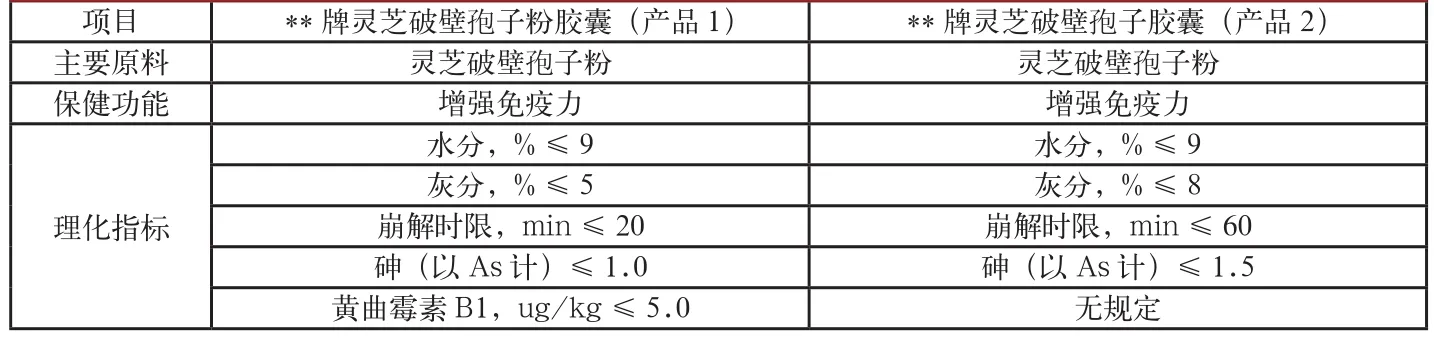
表3 不同廠家的靈芝破壁孢子膠囊產品企業標準對比
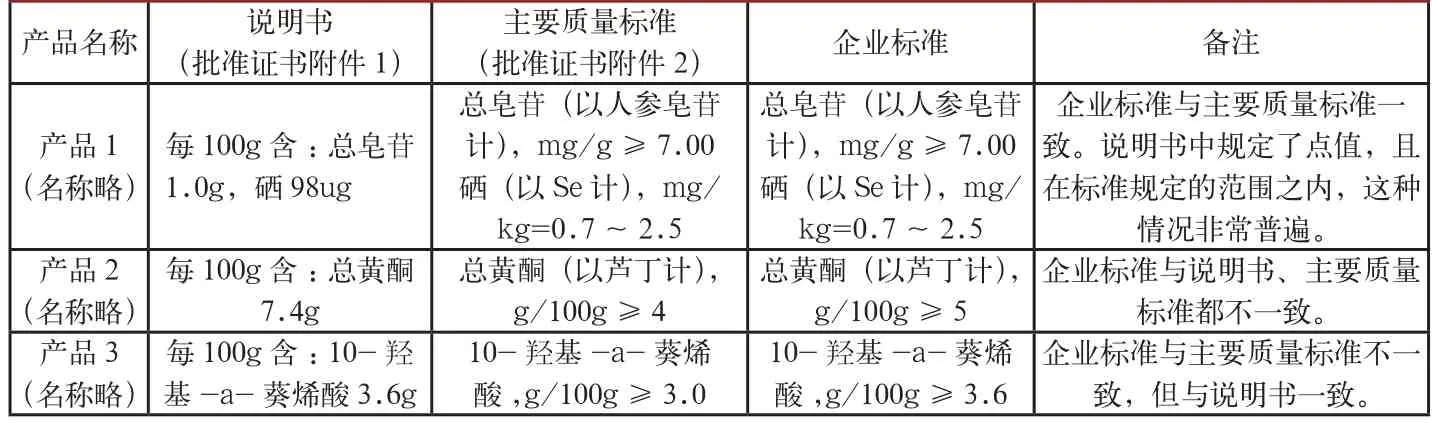
表4 企業標準與批準證書中對功效成分含量規定對比
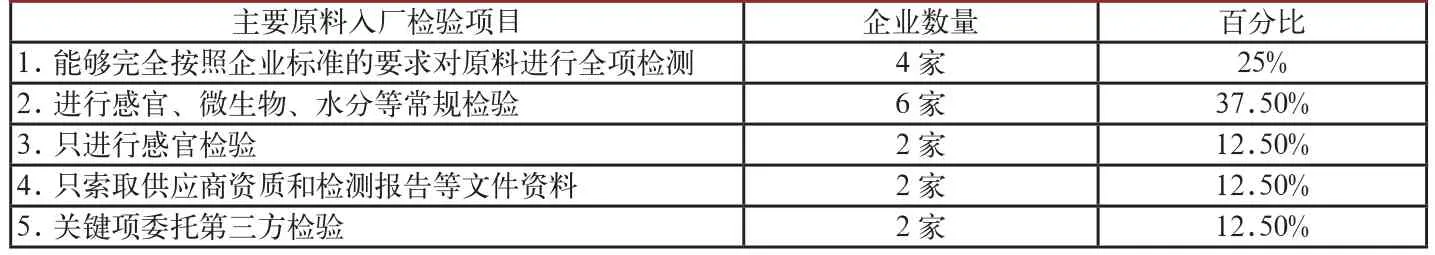
表5 在產企業保健食品主要原料入廠檢驗情況
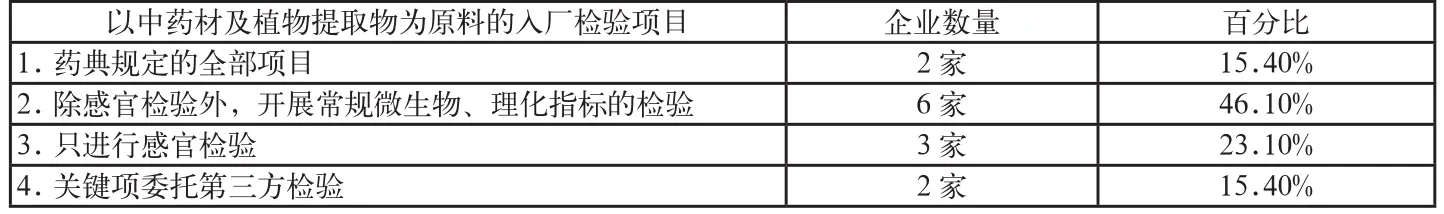
表6 以中藥材及植物提取物為原料的入廠檢驗情況

表7 保健食品生產企業實驗室檢測設備統計
2.1未嚴格執行原輔料入庫檢驗標準。關于原輔料入庫檢驗,企業標準中一般都規定“入庫前應由質量監督檢驗部門按原輔料要求進行檢驗,合格后方可入庫使用。”原輔料要求在企業標準中通常有專門的一節進行規定,以便企業在采購原料時對照企業標準進行檢驗,企業采購的所有輔料都應該保證符合企業標準規定,但實際上,每家企業都不完全能夠做到這一點。
通過調研,發現企業在采購原料時對供貨方資質的審核都比較嚴謹,基本都會留存供貨方資質,向供貨方索取原料檢測報告等文件,但在原料入廠檢測方面,鑒于企業檢測能力不同,入廠檢測項目的差別就很大。筆者對轄區16家在產企業主要原料入廠檢驗情況進行了調查(見表5)。
此外,筆者還對13家以中藥材及植物提取物為原料的保健食品生產企業的原料入廠檢驗情況進行調研(見表6)。
通過上表可以看出,在原料入廠檢測上,除個別企業比較重視外,大部分企業均不能嚴格按照企業標準規定的原輔料要求進行全項檢驗。
2.2出廠檢測項目執行不力。鑒于產品出廠檢測項目標準高低不一,標準制定過高而企業實際檢測能力較低的問題比較突出,企業無法對出廠產品進行全項目檢測,而委托檢驗的費用又較高,有的企業為節約成本,就未按標準要求完成成品的全部檢驗項目即出廠,造成隱患產品流入市場。比如,有50%的產品規定出廠進行致病菌檢驗,但實際上昌平區只有3家企業具有致病菌檢驗能力。再比如,企業標準規定,出廠需要檢測功效成分的產品有7個,但實際只有4個產品出廠時進行了功效成分檢測,此類問題在委托加工產品中尤為嚴重。
委托加工企業本身限于沒有檢測設備無法進行出廠檢測,在尋找受托加工企業過程中也不將實驗室檢測能力作為考察重點,而更多考慮的是加工費用等因素。受托加工企業則依據委托加工協議約定的檢測項目進行檢測,導致出廠檢測項目不能被完全執行。
2.3企業標準內容的變動具有隨意性。在監督抽檢中筆者發現,某一產品因功效成分總黃酮含量不符合企業標準,被判定為不合格,檢測機構依據的檢測方法是企業標準中的檢測方法。該企業標準引用了衛生部2003年《保健食品檢驗與評價技術規范》中總黃酮的含量測定方法。為此,該企業將企業標準中總黃酮的含量測定方法修改成了自行制訂的方法。經比較,該方法與衛生部2003年《保健食品檢驗與評價技術規范》中總黃酮含量測定方法不同,修改后的測定方法中,總黃酮的含量是以葛根素計,而衛生部《保健食品檢驗與評價技術規范》中則是以蘆丁計。由于該產品的保健食品批準證書沒有附帶主要質量標準,因此,尚無法查閱該產品注冊申報時經國家食品藥品監督管理局審評的檢測方法。一般來說,保健食品功效成分檢測方法的選擇和確定在保健食品注冊階段需要經過國家食藥監局保健食品審評中心的論證,審批通過后才能辦理企業標準備案,以此杜絕保健食品注冊批件中的質量標準與企業標準不一致的問題。這種一旦產品檢測不合格,企業就自行修改企業標準的行為隨意性太強,不利于控制產品質量。
在監督抽檢中,還發現某一產品配方使用的輔料為白砂糖,但在企業標準備案時將輔料改為了低聚異麥芽糖和阿斯巴甜,由于該產品與申報時的配方不一致,現場已要求企業恢復已修改的企業標準,并嚴格按申報的配方組織生產。
上述現象反映出企業標準的修改流程相對比較簡單,只要標準審定組長簽字,企業法定代表人同意然后到質量技術監督局備案即可。質量技術監督局無法對變更內容進行審核,也無須食品藥品監管部門的許可的現狀,給不少生產企業鉆了空子。
3 原因分析
3.1對企業標準的重視力度不夠。企業標準是產品質量的檢測依據,貫穿于生產全過程。因此,制訂企業標準是保健食品生產企業標準化的一項十分重要的工作,直接影響到保健食品生產和質量控制以及消費者的身體健康。檢查中發現的諸多問題,體現出企業本身對企業標準的重視力度還遠遠不夠。
3.1.1保健食品企業標準的制訂技術性強,涉及的技術標準和法律法規較多,企業不具備足夠的技術力量和經濟力量,企業標準編制人員專業知識不夠,導致企業標準存在漏洞。
3.1.2企業高層管理者主觀上對企業標準的編制不夠重視,常以其他企業標準為模板,進行簡單復制套用,使企業標準的制訂流于形式,敷衍了事。
3.1.3由于保健食品技術轉讓或委托加工等原因,導致生產廠家的變更,使企業標準很難與實際生產場所的設備、檢測能力相適應,加大了企業標準的執行難度。
3.1.4企業標準的制訂與執行相脫節。執行者對企業標準理解不透徹,沒有意識到企業標準的重要性。比如,含中藥材的原輔料以及水分、灰分、裝量等的檢測方法,企業標準一般都是引用《中華人民共和國藥典》,但檢查中發現,為檢測人員配備國家藥典的企業并不多。
3.2實驗室建設能力不足致企業標準不能完全執行。當前,一系列保健食品安全問題的發生,折射出企業自我檢驗檢測環節在產品質量中的公正性、科學性、權威性和有效性沒有得到有效發揮。通過檢查發現,受生產規模、經濟實力、企業性質、產品特性和檢驗人員素質等因素的制約,企業實驗室建設能力有待提高。昌平區除少數企業配備了高效液相色譜儀、原子吸收分光光度計等檢測有效成分、重金屬、致病菌的設備外,大部分企業的實驗室還局限于檢測崩解、水分、菌落總數、大腸菌群、酵母計數、霉菌等基礎設備。實驗室建設能力的不足阻礙了企業標準的執行,直接影響了產品質量安全,制約了企業自身的發展。為此,筆者也對昌平區25家保健食品生產企業的實驗室檢測設備進行了統計(見表 7)。
3.3原料標準缺失導致影響產品質量。目前,我國保健食品原料標準體系不健全,許多原料既無國家或地方的統一標準,也無行業的統一標準,企業在實際生產環節處于自定標準的狀態。如氨基酸、紅景天提取物、擬黑多蟻、蜂膠、蜂王漿凍干粉、葡萄籽提取物等原料。這種狀況既不利于對消費者健康和安全權益的保護,也制約著保健食品產業的標準化、規范化。經統計,昌平區65%的保健食品原料中含有中藥或中藥提取物。但資料顯示,中草藥的有效成分復雜,在被調查的150種中草藥中,能檢出有效成分的保健食品占61.3%,相當一部分未能檢出有效成分。原料質量的不確定性直接影響了產品質量。
3.4企業標準處于多頭管理狀態。保健食品注冊時的產品質量標準由國家食品藥品監督管理局審批,但由于保健食品注冊批件的附件2,即質量標準自2005年起才開始作為注冊批件的一部分,所以對之前審批的保健食品,基層藥品監督管理部門在日常監督過程中只有依據備案的企業標準進行檢查,而企業標準的備案卻在質量技術監督管理部門。雖然企業備案時也提交經國家食品藥品監督管理局審批的保健食品注冊批件、產品配方、工藝、質量標準等技術資料,但由于兩個行政系統的執法依據不同,標準要求也不盡相同,導致可能出現企業標準與注冊審批的標準不一致的現象。這種管理上的混亂對保健食品的統一管理極為不利,直接影響到了產品質量,也不利于基層監管部門的工作開展。

