Beclinl基因沉默對胰腺癌MiaPaCa-2細胞生長的影響
李曉姝 郭曉鐘 王華 肖鳳君 李宏宇 任麗楠
·短篇論著·
Beclinl基因沉默對胰腺癌MiaPaCa-2細胞生長的影響
李曉姝 郭曉鐘 王華 肖鳳君 李宏宇 任麗楠
Beclin1基因與酵母自噬基因Atg 6同源,是參與哺乳動物自噬體形成,調控細胞自噬過程的重要基因。Beclin1自噬基因的缺陷可能導致腫瘤細胞逃避自噬性死亡[1],而穩定轉染Beclin1后可促進細胞的自噬活性,并降低了其成瘤能力[2]。本研究觀察沉默胰腺癌MiaPaCa-2細胞的Beclin1基因表達后對其增殖、凋亡及細胞周期分布的影響,為胰腺癌的基因治療提供新的思路。
一、材料與方法
1.靶向Beclin1的siRNA表達載體構建:根據siRNA設計原理,由上海吉瑪制藥技術有限公司構建3個插入靶向Beclin1基因的siRNA(Beclin1-siRNA)質粒以及陰性對照siRNA(NC-siRNA)質粒和熒光標記的siRNA(FAM-siRNA)質粒。經篩選后選擇沉默效果最好的Beclin1-siRNA序列插入表達載體U6/Neo,構建表達載體U6/Neo-shBeclin1,同時構建陰性對照載體pGPU6/Neo-shNC及熒光對照載體pGPU6/GFP/Neo-shNC。
2.細胞轉染及穩轉細胞株篩選:人胰腺癌細胞系MiaPaCa-2由軍事醫學科學院提供,常規培養、傳代。取對數生長期細胞,接種于24孔培養板,采用Lipofectamin 2000轉染試劑盒(Invitrogen 公司)將上述3種表達載體分別轉染MiaPaCa-2細胞,按說明書操作。轉染后6、24 h在熒光顯微鏡下觀察轉染效率。取轉染效率高的細胞的1/10進行傳代,48 h后在培養液中加入G418(400 μg/ml)篩選穩轉細胞株。18 d后收集細胞。
3.Beclin1蛋白表達檢測:取對數生長期細胞,提取蛋白,采用常規蛋白質印跡法檢測Beclin1蛋白,以β-actin為內參。兔抗人Beclin1單抗為Reagents 公司產品,兔抗人β-actin抗體及羊抗兔IgG多抗為Santa Cruz公司產品。
4.細胞增殖活性檢測:采用CCK法檢測。試劑盒為日本Dojindo Laboratories產品,按照試劑盒說明書操作。最后在酶聯免疫檢測儀于450 nm處測定細胞培養0、24、48、72、96 h的吸光值(A450值),以對照組為1,繪制增殖曲線。實驗重復3次。
5.細胞凋亡及周期分析:取培養48 h的細胞,離心棄上清,應用1 ml預冷PBS洗滌3次,采用PI染色法檢測細胞凋亡,采用ANNEXIN V-FITC N+PI法檢測細胞周期。檢測試劑盒購自北京眾康志恒生物公司,按照試劑盒說明書操作,最后上流式細胞儀檢測。
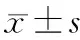
二、 結果
1.轉染細胞Beclin1蛋白表達的變化:轉染NC-siRNA的MiaPaCa-2細胞的Beclin1蛋白表達量為0.7046,轉染3條靶向Beclin1-siRNA的MiaPaCa-2細胞Beclin1蛋白表達量分別為0.4077、0.2831、0.1073(圖1),Beclin1蛋白的表達均下調,其中Beclin1-siRNA-3具有最佳的抑制效果,該靶序列為GCTGCCGTTATACTGTTCT。故應用該序列進行后續實驗。

1:NC-siRNA;2:Beclin1-siRNA1;3:Beclin1-siRNA2;4:Beclin1-siRNA3
2.Beclin1-siRNA穩轉MiaPaCa-2細胞增殖、凋亡及周期的變化:穩轉的MiaPaCa-2細胞與陰性對照組相比較,其細胞增殖、凋亡無明顯變化(圖2、3),但對MiaPaCa-2細胞的周期分布產生明顯影響(圖4), S期細胞比例從對照組的(10.93±0.19)%減少到(9.20±0.22) %,G2期細胞比例從對照組的(7.92±2.56) %減少到(7.00±2.82)%,而G1期細胞從對照組(81.15±2.75)%增加到(83.80±2.60)%,差異均具有統計學意義(t值分別為7.308、6.129、30.6,P值均<0.01)。
討論RNA干擾(RNA interference,RNAi) 是近些年發展起來的一種新技術,它主要是通過21~25 nt的小RNA反義鏈的介導,識別并靶向切割同源mRNA,從而發生轉錄后沉默。目前人工合成的siRNA已成為研究基因沉默后功能改變的一種重要工具,被廣泛應用于腫瘤發生、發展相關的研究中。本研究采用該技術成功地獲得Beclin1低表達的穩轉MiaPaCa-2細胞株。

圖2 轉染Beclin1-siRNA及NC-siRNA的MiaPaCa-2細胞的增殖曲線

圖3 轉染Beclin1-siRNA及NC-siRNA的MiaPaCa-2細胞的凋亡

圖4 轉染Beclin1-siRNA及NC-siRNA的MiaPaCa-2細胞的周期分布
自噬是真核細胞特有的生命現象。通過自噬,細胞內受損變性或衰老的蛋白質、細胞器被消化降解,同時也可以再利用被分解的氨基酸、核苷酸、游離脂肪酸等以滿足機體代謝需要或某些細胞器的更新,因此對于維持細胞內環境穩定起著非常重要的作用。目前在哺乳動物中發現有近30種自噬相關基因,它們通過多種信號通路調控細胞自噬的水平。其中Beclin1基因是一種重要的自噬調控基因,它所編碼的Beclin1蛋白能夠引導其他自噬相關蛋白定位于自噬體膜上,在自噬體的形成過程中起到關鍵的作用。
目前研究提示Beclin1可能參與細胞凋亡,但其作用機
制非常復雜,自噬啟動或是抑制凋亡仍無一致結論。有研究結果顯示,Beclin1可以通過BH3結構域與細胞凋亡的重要調節因子Bcl-2相互作用[3-4],這可能是Beclin1參與細胞凋亡的機制之一。推測磷酸化及非磷酸化的Bcl-2與Beclin1結合,可能對自噬或凋亡產生相反的作用,這與細胞的不同狀態有關[5]。另一方面,有研究顯示,人乳腺癌、卵巢癌和前列腺癌等腫瘤細胞中存在高頻率的Beclin1單等位基因缺失[1]。人乳腺癌細胞系MCF-7穩定轉染Beclin1后其自噬活性增強,同時降低其成瘤能力,提示自噬活性與抑制細胞增殖有關[2]。
本研究結果顯示,沉默Belin1基因表達后,細胞的凋亡及增殖均未受到影響,是否存在其他重要的信號通路調控自噬過程需要進一步通過對自噬小體數量變化等檢測去驗證。
本研究結果還顯示,Beclin1表達沉默后,MiaPaCa-2細胞的周期發生改變,S期細胞明顯減少,G1期細胞明顯增多,提示Beclin1低表達促使胰腺癌MiaPaCa-2從S期進入G1期,推測Beclin1在促進腫瘤形成過程中可能起作用。有研究認為,在腫瘤的不同發展階段,自噬對細胞的影響不同。在腫瘤發生早期,抑制自噬可以引起癌前細胞持續生長,此時自噬抑制腫瘤形成[6-7]。當腫瘤處于進展階段時,惡變的細胞持續分裂增殖,并利用自噬機制對抗營養缺乏和缺氧,尤其在實體腫瘤內部血供不良的癌細胞中表現更明顯,此時自噬發揮的是促進腫瘤細胞生長的作用[8]。本研究與有些研究結論[1-2]不一致,其原因也可能與Beclin1異常表達在不同腫瘤組織及腫瘤發生、發展的不同階段產生的自噬作用不同有關。
[1] Mizushima N, Levine B, Cuervo AM, et al. Autophagy fights disease through cellular self-digestion. Nature, 2008, 451:1069-1075.
[2] Liang XH, Jackson S, Seaman M, et al. Induction of autophagy and inhibition of tumorigenesis by beclin 1. Nature, 1999, 402: 672-676.
[3] Strasser A. The role of BH3-only proteins in the immune system.Nat Rev Immunol, 2005, 5: 189-200.
[4] Sinha S, Levine B. The autophagy effector Beclin 1: a novel BH3-only protein. Oncogene, 2008, 27: S137-S148.
[5] Wei Y, Pattingre S, Sinha S, et al. JNK1-mediated phosphorylation of Bcl-2 regulates starvation-induced autophagy. Mol Cell, 2008, 30:678-688.
[6] Ogier-Denis E, Codogno P. Autophagy: a barrier or an adaptive response to cancer. Biochim Biophys Acta, 2003, 1603: 113-128.
[7] Gozuacik D, Kimchi A. Autophagy as a cell death and tumor suppressor mechanism. Oncogene, 2004, 23: 2891-2906.
[8] Cuervo AM. Autophagy: in sickness and in health. Trends Cell Biol, 2004, 14: 70-77.
2013-03-20)
(本文編輯:屠振興)
10.3760/cma.j.issn.1674-1935.2013.06.019
國家自然科學基金(81071982);遼寧省自然科學基金(201102238)
110083 沈陽,沈陽軍區總醫院消化科(郭曉鐘、李宏宇、任麗楠);沈陽市第四人民醫院消化科(李曉姝);軍事醫學科學院放射與輻射研究所(王華、肖鳳君)
郭曉鐘,Email: guoxiaozhong1962@163.com

