KAI1基因轉染對乏氧培養下胰腺癌MiaPaCa-2細胞增殖、遷移及VEGF表達的影響
劉旭 郭曉鐘 李宏宇 陳江 許文達
·論著·
KAI1基因轉染對乏氧培養下胰腺癌MiaPaCa-2細胞增殖、遷移及VEGF表達的影響
劉旭 郭曉鐘 李宏宇 陳江 許文達
目的觀察轉染KAI1基因的人胰腺癌MiaPaCa-2細胞在乏氧條件下培養后細胞增殖、遷移、侵襲能力的變化,探討其可能機制。方法應用KAl1基因過表達質粒轉染乏氧條件培養后的人胰腺癌MiaPaCa-2細胞,采用蛋白質印跡法檢測轉染細胞KAI1、VEGF-C、VEGF-A蛋白的表達,四甲基偶氮唑藍(MTT)法檢測轉染細胞的增殖,細胞劃痕及Transwell小室實驗觀察轉染細胞的遷移及侵襲能力,酶聯免疫吸附測定法檢測培養上清液中人VEGF-C、VEGF-A含量。結果轉染KAI1基因后的MiaPaCa-2-K細胞的KAI1蛋白表達量較未轉染細胞顯著增加[(0.549±0.021)比0]。乏氧條件培養后轉染細胞的增殖無明顯變化,但它的遷移距離明顯縮短,穿膜細胞數顯著減少[(14.0±5.8)比(43.0±14.4)個,P<0.05];細胞的VEGF-C表達顯著降低[(0.218±0.043)比(0.745±0.069)。P<0.05],但VEGF-A表達變化不顯著;細胞培養上清液中VEGF-C含量顯著減少[(1236±247)比(2045±221)pg/ml,P<0.01]。結論轉染KAl1基因的MiaPaCa-2細胞在乏氧條件下培養后的細胞遷移、侵襲能力減弱,其機制可能是通過下調VEGF-C的表達來抑制胰腺癌淋巴轉移的。
胰腺腫瘤; 缺氧; 細胞增殖; 細胞運動; 血管內皮生長因子類; KAI1基因
【Keywrods】 Pancreatic neoplasms; Anoxia; Cell proliferation; Cell movement; Vascular endothelial growth factors; KAI1 gene
早期即發生淋巴轉移是胰腺癌重要特征和預后極差的重要因素[1]。早期胰腺癌組織常處于乏氧狀態,乏氧狀態下胰腺癌細胞的增殖和轉移明顯活躍[2],因此,乏氧狀態可能促進了胰腺癌的淋巴轉移。KAI1基因是一種腫瘤轉移抑制基因,其對胰腺癌的遷移、侵襲、自噬均具有調節作用。近期研究結果顯示,在乏氧狀態下KAI1是一種重要的乏氧靶基因[3]。本研究將插入KAI1基因的真核質粒轉染人胰腺癌MiaPaCa-2細胞,觀察乏氧條件培養后細胞增殖、遷移、侵襲能力及VEGF蛋白表達的變化,探討KAI1基因調控胰腺癌淋巴轉移的可能作用及機制。
材料和方法
一、KAl1基因轉染
MiaPaCa-2細胞株為沈陽軍區總醫院消化內科保存。攜帶人KAI1全長cDNA的真核表達質粒(pCMV-KAI1) 由本研究組前期構建[4-5]。在完全密閉的方盒中持續通入由乏氧設備產生的乏氧氣體(1% O2、5% CO2和94% N2),將處于對數生長期的MiaPaCa-2細胞在乏氧環境中培養1周后接種到6孔板。采用Lipofectamine 2000(美國Invotrogen公司)將pCMV-KAI1轉染MiaPaCa-2細胞,經G418篩選后擴增培養。以轉染pCMV空質粒及未轉染細胞作為對照。
二、蛋白質印跡法
收集各組對數生長期的2×106個細胞,裂解并收集細胞總蛋白,采用BCATM蛋白定量試劑盒對蛋白進行定量。采用常規蛋白質印跡法檢測KAI1蛋白及VEGF-C、VEGF-A蛋白的表達。各種抗體均購自美國Santa Cruz公司,以β-actin作為內參,采用Quantity One軟件(BioRad)測定蛋白條帶的灰度值,以目的條帶與內參條帶灰度比值表示蛋白表達量。
三、四甲基偶氮唑藍(MTT)法
將各組對數生長期細胞調整密度至1×104個/ml,取200 μl細胞懸液接種入96孔細胞培養板。分別培養24、48、72、96 h,每組每個時間點設3個復孔。培養到時間點時,每孔加入20 μl MTT溶液(5 mg/ml)繼續培養4 h,加入150 μl DMSO振蕩10 min。在酶標儀上檢測各孔490 nm波長處的吸光值(A490值),以只含培養液并加入150 μl DMSO的空白對照孔調零,繪制細胞生長曲線。
四、Transwell小室侵襲實驗
將對數生長期的各組細胞用無血清DMEM調整到密度為1×105個/ml。在Transwell小室(美國Costar公司)的上室加入細胞懸液100 μl,下室加入600 μl含有10%胎牛血清的DMEM培養液。每組設3個小室。在乏氧條件下培養12 h。取出小室,用PBS淋洗,用棉簽輕輕刮除上室中未遷移的細胞,固定、染色、計算穿膜細胞數并拍照。實驗重復3次。
五、細胞劃痕實驗
收獲對數生長期的各組細胞,調整細胞密度至1×105個/ml,接種于6孔板中,每組設3個復孔。乏氧條件下培養至細胞呈單層,以移液器槍頭在培養孔底部呈“1”型劃過。以無血清DMEM培養液洗滌以棄去漂浮細胞,更換為含10%胎牛血清的培養液繼續培養,在培養24、48、72 h后鏡下觀察細胞爬過劃痕的情況并拍照。實驗重復3次。
六、酶聯免疫吸附測定(ELISA)法
取對數生長期細胞,以每孔1×105個細胞接種于12孔板中。乏氧條件培養下細胞貼壁生長24 h,收集細胞培養上清液,離心取上清液。在VEGF-C酶聯免疫試劑盒(美國Ray Bio公司)提供的已標記的ELISA酶標板的各孔先加入樣品稀釋液40 μl,然后再將待測樣品10 μl加于酶標板底部(最終稀釋度為5倍)。按試劑盒說明書操作。以空白孔調零,測定各孔450 nm波長的吸光值(A450值)。
七、統計學處理
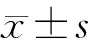
結 果
一、轉染細胞的鑒定
未轉染的MiaPaCa-2細胞和空載體轉染細胞(MiaPaCa-2-p)均無KAI1蛋白表達,轉染pCMV-KAI1的MiaPaCa-2細胞(MiaPaCa-2-K)的KAI1蛋白表達量為0.549±0.021(圖1),提示成功構建了KAI1基因高表達的MiaPaCa-2細胞株。
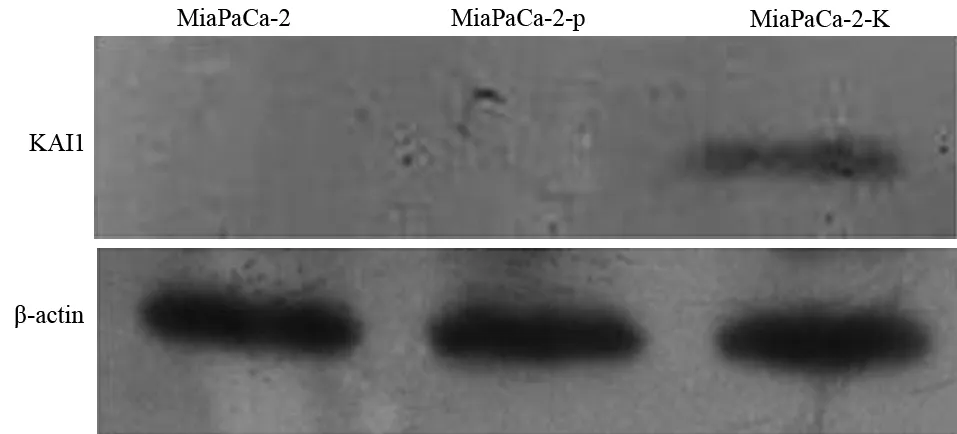
圖1 各組MiaPaCa-2細胞的KAI1蛋白表達
二、乏氧條件培養下各組細胞的增殖狀況
在乏氧環境中培養24、48、72、96 h后,MiaPaCa-2細胞的A490值分別為0.18、0.20、0.39、0.44;MiaPaCa-2-p細胞為0.17、0.19、0.36、0.46,MiaPaCa-2-K細胞為0.16、0.17、0.33、0.41。3組細胞的增殖速度無明顯差異(圖2)。
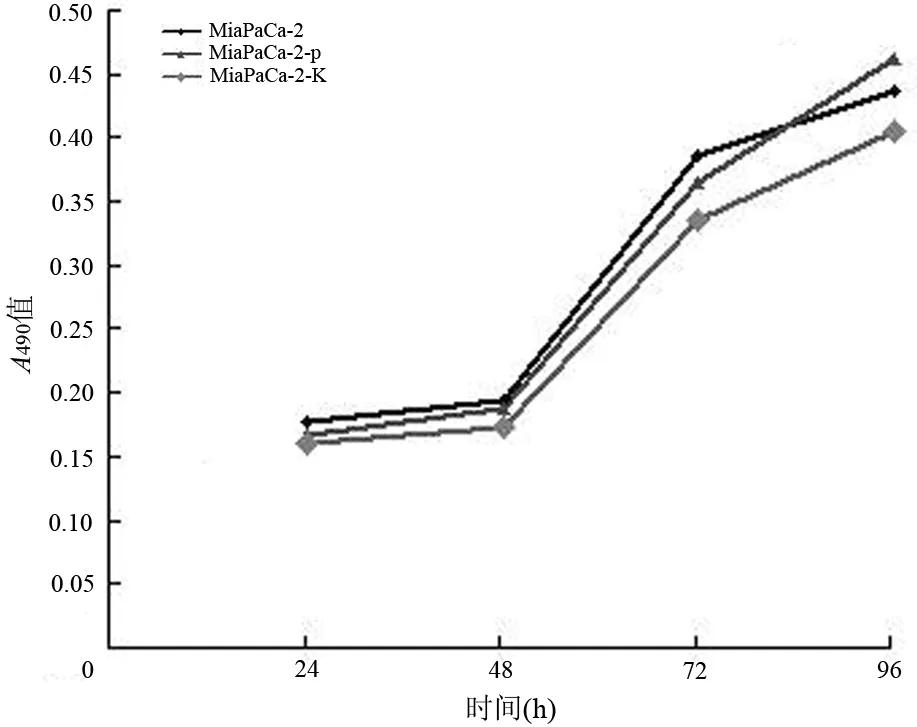
圖2 各組MiaPaCa-2細胞的生長曲線
三、乏氧條件培養下各組細胞的遷移能力
MiaPaCa-2-K 組細胞的遷移距離較MiaPaCa-2及MiaPaCa-2-p細胞均短(圖3)。
四、乏氧條件培養下各組細胞的侵襲能力
MiaPaCa-2、MiaPaCa-2-p、MiaPaCa-2-K組的穿膜細胞數分別為(43.0±14.4)、(48.0±12.6)、(14.0±5.8)個(圖4),MiaPaCa-2-K組的穿膜細胞數較MiaPaCa-2-p組及MiaPaCa-2組均顯著減少,差異具有統計學意義(t值分別為10.67、12.85,P值均<0.05)。
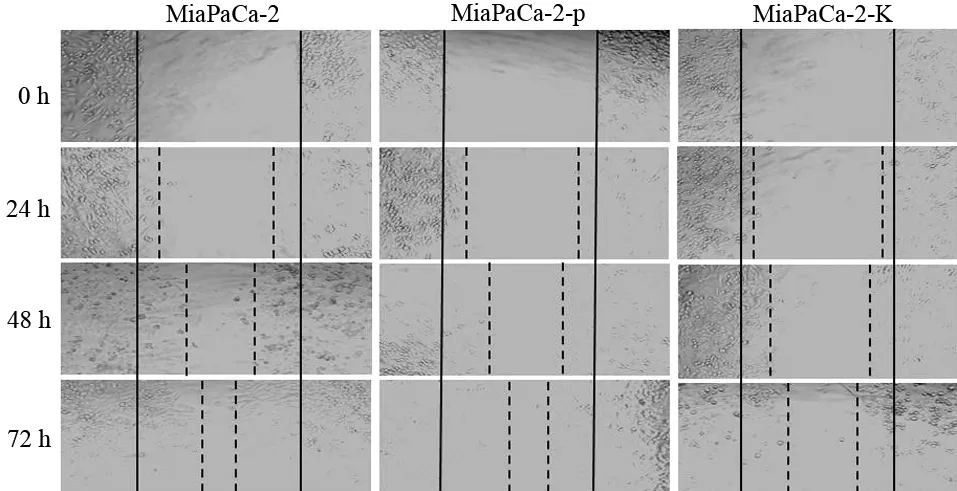
圖3 各組MiaPaCa-2細胞的遷移情況(×100)
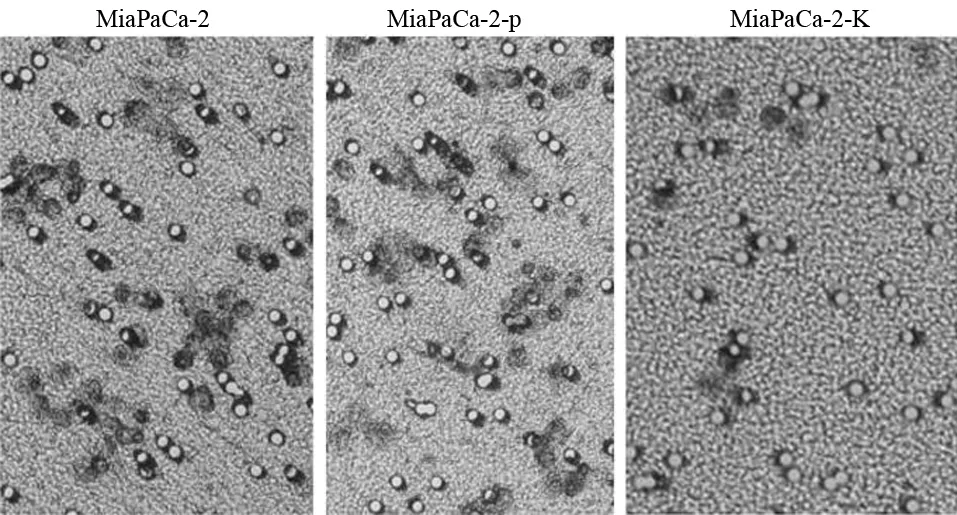
圖4 各組MiaPaCa-2細胞的穿膜細胞(×200)
五、乏氧條件培養下各組細胞VEGF-C、VEGF-A蛋白表達
MiaPaCa-2、MiaPaCa-2-p、MiaPaCa-2-K細胞VEGF-C表達量分別為0.745±0.069、0.687±0.087、0.218±0.043,VEGF-A表達量分別為0.389±0.073、0.385±0.067、0.365±0.058(圖5)。MiaPaCa-2-K組細胞的VEGF-C表達較其他兩組細胞顯著下降,差異具有統計學意義(t值分別為13.12、11.65,P值均<0.05),但各組間VEGF-A的表達差異無統計學意義。
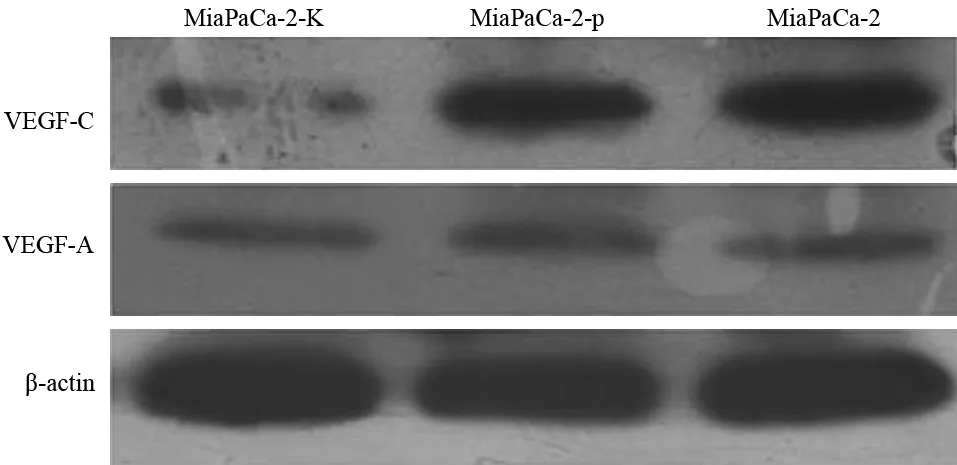
圖5 各組MiaPaCa-2細胞的VEGF-A、VEGF-C蛋白表達
MiaPaCa-2、MiaPaCa-2-p、MiaPaCa-2-K細胞培養上清液中VEGF-C含量分別為(2045±221)、(2163±239)、(1236±247)pg/ml,MiaPaCa-2-K組細胞顯著低于其他兩組(t值分別為11.36、10.93,P值均<0.01)。
討 論
轉移是惡性腫瘤的顯著特點,淋巴轉移是重要的腫瘤轉移途徑之一。由于毛細淋巴管的管腔大而不規則(直徑10~60 μm),管壁僅由一層淋巴內皮細胞和極薄的結締組織構成,且其主要功能是可根據組織內壓調節細胞間的連接以容許液體及大分子物質通過[6],因此,毛細淋巴管具有比毛細血管更大的通透性,癌細胞也更容易進入毛細淋巴管發生淋巴轉移。
KAI1基因編碼的蛋白質CD82屬Ⅲ型膜蛋白的4次跨膜超家族(transmembrane 4 su perfamily,TM4SF)[6],具有4個高度保守的疏水跨膜結構(TM1-4)、一個近N端小的細胞外環(extracellular loops1,EC1)和一個近C端大的細胞外親水環狀結構(EC2)。該結構平行于細胞膜,也決定了該蛋白功能的特異性。它可介導包括細胞與細胞、細胞與細胞外基質等在內的信號轉導,并在細胞的聚集、粘附、遷移、增殖過程中具有一定的調節作用。本研究組以往的研究發現,早期胰腺癌(Ⅰ、Ⅱ期) KAI1 mRNA表達顯著高于伴有淋巴結或遠處轉移的晚期胰腺癌(Ⅲ、Ⅳ期),KAI1基因高表達顯著抑制細胞的侵襲能力[7]。細胞內1-磷酸鞘氨醇(S1P)的產生是由鞘氨醇激酶(SPK)催化生成的,而SPK信號通路與細胞遷移密切相關。高表達KAI1基因的胰腺癌細胞S1P的合成降低,因此推測KAI1基因具有抑制胰腺癌細胞SPK活性的作用,并抑制胰腺癌細胞遷移[5]。本研究在乏氧條件下培養人胰腺癌細胞MiaPaCa-2,結果顯示 KAI1基因的高表達對細胞增殖作用不明顯,但可顯著抑制癌細胞的遷移,可能是其抑制淋巴轉移的重要機制之一。
相關研究顯示,部分VEGF家族成員和受體信號通路在淋巴管新生和淋巴轉移過程中起著關鍵性作用。并已證實胰腺癌細胞可以合成并釋放VEGF-C、VEGF-A等因子[8-9],刺激淋巴管內皮細胞增殖,趨化其向病變部位遷移[10],最終促進腫瘤淋巴轉移的發生。本研究結果顯示,在乏氧條件培養下KAI1高表達對胰腺癌MiaPaCa-2細胞VEGF-A的表達無明顯作用,但顯著抑制了VEGF-C的表達及其在培養上清中的含量,提示KAI1基因抑制淋巴轉移的作用可能是通過下調VEGF-C表達來實現的。
[1] Pawlik TM, Gleisner AL, Cameron JL, et al. Prognostic relevance of lymph node ratio following pancreatic oduodenectomy for pancreatic cancer. Surgery, 2007, 141:610- 618.
[2] Hill RP,Marie-Eqyptienne DT,Hedley DW.Cancer stem cells,hypoxia and metastasis.Semin Radiat Oncol,2009,19:106-111.
[3] Kim B, Boo K, Lee JS, et al. Identification of the KAI1 metastasis suppressor gene as a hypoxia target gene. Biochem Biophys Res Commun, 2010, 393:179-184.
[4] 郭曉鐘, 徐建華,劉民培,等.KAI1基因抑制胰腺癌細胞轉移機制的探討.中華內科雜志,2004,43:360-362.
[5] 郭曉鐘,張巍巍,王立生,等.KAI1基因抑制胰腺癌細胞鞘氨醇激酶活性及其遷移.中華內科雜志, 2006,45:752-754.
[6] Butler MG, Isogai S, Weinstein BM. Lymphatic development. Birth Defects Res C Embryo Today, 2009, 87:222-231.
[7] Miranti CK. Controlling cell surface dynamics and signaling: How CD82/KAI1 suppresses metastasis. Cell Signal, 2009,21:196-211.
[8] Su JL, Yang PC, Shih JY, et al. The VEGF-C/Flt-4 axis promotes invasion and metastasis of cancer cells. Cancer Cell, 2006, 9:209-223.
[9] Hirakawa S, Brown LF, Kodama S, et al. VEGF-C-induced lymphangiogenesis in sentinel lymph nodes promotes tumor metastasis to distant sites. Blood, 2007,109:1010-1017.
[10] Saintigny P, Kambouchner M, Ly M, et al. Vascular endothelial growth factor-C and its receptor VEGFR-3 in non-small-cell lung cancer: concurrent expression in cancer cells from primary tumour and metastatic lymph node. Lung Cancer, 2007,58:205-213.
EffectsofKAl1genetransfectiononproliferation,migration,invasionandVEGFexpressionofpancreaticcancerMiaPaCa-2cellsunderhypoxiccondition
LIUXu,GUOXiao-zhong,LIHong-yu,CHENJiang,XUWen-da.
DepartmentofGastroenterology,GeneralHospitalofShenyangMilitaryAreaCommand,Shenyang110016,China
GUOXiao-zhong,Email:guoxiaozhong1962@163.com
ObjectiveTo investigate the effects of KAll gene transfection on proliferation, migration, invasion and VEGF expression of pancreatic cancer MiaPaCa-2 cells under hypoxic condition, and explore possible mechanism.MethodsThe pcMV-KAI1 vector which contained the full length of KAI1 cDNA was transfected into pancreatic cancer cells MiaPaCa-2, and KAI1, VEGF C, VEGF A protein expressions were determined by Western blot. The proliferation of pancreatic cancer cells was evaluated by MTT method. Wound-healing assay and cell invasion assay were used to detect the migration and invasion of pancreatic cancer cells. The expression of VEGF C, VEGF A in supernatant of culture was measured by ELISA method.ResultsThe expression of KAI1 protein in MiaPaCa-2 K transfected with KAI1 was significantly higher than that in non-transfected cells [(0.549±0.021)vs0,P<0.05]. The proliferation under hypoxic condition was not significantly different, but the migration distance was significantly shorter and the number of transmembrane cell was significantly decreased [(14.0±5.8)vs(43.0±14.4),P<0.05]. The expression of VEGF-C in cell was significantly decreased [(0.218±0.043)vs(0.745±0.069),P<0.05], but the expression of VEGF-A was not significantly different; the expression of VEGF-C in cell culture supernatants was significantly decreased [(1236±247)vs(2045±221)pg/ml,P<0.01].ConclusionsThe migration, invasion ability of pancreatic cancer MiaPaCa-2 cells with KAll transfection under hypoxic condition is decreased, and the possible mechanism of inhibiting lymphatic metastasis is down-regulation of VEGF-C expression.
2013-06-24)
(本文編輯:屠振興)
10.3760/cma.j.issn.1674-1935.2013.06.003
國家自然科學基金(81071982)
110016 遼寧沈陽,沈陽軍區總醫院消化內科
郭曉鐘,Email: guoxiaozhong1962@163.com

