艾塞那肽誘發大鼠胰腺組織病變的實驗研究
楊永超 余梟 黃利華 余燦
·論著·
艾塞那肽誘發大鼠胰腺組織病變的實驗研究
楊永超 余梟 黃利華 余燦
目的探討艾塞那肽誘發大鼠胰腺組織病變的可能機制。方法SD雄性大鼠30只按完全隨機法分為艾塞那肽組、糖尿病組和對照組,每組10只。高糖、高脂喂養及腹腔注射鏈脲佐菌素(35 mg/kg體質量)方法誘導大鼠糖尿病模型,艾塞那肽組和糖尿病組每天2次皮下注射艾塞那肽5 μg/kg體質量,對照組皮下注射等容積生理鹽水,實驗周期為10周。大鼠處死后取胰腺組織,常規病理檢查。免疫組化法檢測胰腺組織α-平滑肌肌動蛋白(α-SMA)和Ⅲ型膠原蛋白表達,ELISA 法檢測胰腺組織基質金屬蛋白酶2(MMP-2)和MMP-9含量。結果對照組大鼠胰腺組織未見病理變化,艾塞那肽組大鼠胰腺組織出現慢性炎性改變,糖尿病組大鼠胰腺病變程度較艾塞那肽組嚴重,3組胰腺病理評分依次增高(P<0.05)。對照組、艾塞那肽組和糖尿病組胰腺組織的MMP-2含量分別為(186.98±23.24)、(306.07±59.82)、(365.08±89.55)μg/L;MMP-9含量分別為(49.37±7.08)、(67.24±14.73)、(87.37±13.39)μg/L。艾塞那肽組和糖尿病組均顯著高于對照組(P值均<0.05),但艾塞那肽組和糖尿病組間的差異無統計學意義。對照組、艾塞那肽組和糖尿病組大鼠高倍視野內胰腺組織的α-SMA陽性表達細胞數分別為(13.4±6.0)、(29.5±8.8)、(79.3±27.2)個,Ⅲ型膠原蛋白陽性表達細胞數分別為(10.6±4.9)、(29.3±13.0)、(56.0±27.2)個。艾塞那肽組陽性細胞數均顯著多于對照組,糖尿病組陽性細胞數又顯著多于艾塞那肽組(P值均<0.05)。結論長期皮下注射艾塞那肽可能激活胰腺星狀細胞,表達α-SMA和Ⅲ型膠原蛋白,分泌MMP-2、MMP-9,誘發胰腺組織慢性炎性改變。
胰腺; 星形細胞; 艾塞那肽; 病理學; 大鼠
艾塞那肽是第一個應用于臨床治療糖尿病的腸促胰島素激動劑。2008年Ahmad等[1]發表了艾塞那肽致急性胰腺炎(AP)的報道后,關于使用艾塞那肽后出現胰腺炎的報告不斷增加[2-5],表明艾塞那肽有誘發胰腺炎的可能。但也有文獻報道艾塞那肽并不誘發胰腺炎,反而可減輕化學誘導的胰腺炎癥損害[6]。本研究組前期的動物實驗結果表明,長期應用艾塞那肽可導致部分SD大鼠胰腺組織出現慢性炎性改變[6]。本研究進一步探討艾塞那肽誘發大鼠胰腺組織病變的可能機制。
材料與方法
一、實驗動物分組
SD(Sprague-Dawley)雄性大鼠30只,體質量280~310 g,由湖南斯萊克景達實驗動物有限公司提供,同時提供飼料。按照完全隨機設計的原則將大鼠分為艾塞那肽組、糖尿病組和對照組。高脂、高糖喂養2個月后采用腹腔注射鏈脲佐菌素(STZ,Sigma公司)35 mg/kg體質量的方法制備糖尿病大鼠模型,72 h后連測3 d空腹血糖,空腹血糖均值>17.1 mmol/L為造模成功標準。艾塞那肽組和糖尿病組大鼠每天于早上7點及晚上5點皮下注射艾塞那肽(上海肽仕生物科技有限公司)5 μg/kg體質量,注射后1 h進食。每周稱重一次,根據體質量調整艾塞那肽的用量。對照組大鼠僅皮下注射等容積生理鹽水。實驗周期為10周。第10周末,采用腹腔注射10%水合氯醛麻醉大鼠,開胸,暴露心臟,經左心室依次灌注0.01 mol/L PBS緩沖液250~300 ml,4%多聚甲醛溶液300~450 ml,直到大鼠肝臟顏色變成深黃色。取部分胰腺組織,立即置4%多聚甲醛溶液中并于4℃冰箱固定24 h。
二、胰腺組織病理學檢測
取固定的胰腺組織,常規行病理學檢查。根據Zhang等[7]的胰腺病理評分標準并參照改良的Schmidt等[8]方法對胰腺損傷進行評分。
三、胰腺組織基質金屬蛋白酶-2(MMP-2)、MMP-9蛋白檢測
取部分新鮮的胰腺組織,在冰生理鹽水中漂洗后稱重,剪碎,加9倍量的勻漿介質(pH7.4,0.01 mol/L Tris-HCL,0.0001 mol/L EDTA-2Na,0.01 mol/L蔗糖,0.8%的氯化鈉溶液)制成組織勻漿,離心,取上清液,采用酶聯免疫試劑盒(R&D公司)檢測MMP-2、MMP-9含量。
四、胰腺組織α-平滑肌肌動蛋白(α-SMA)、Ⅲ型膠原蛋白檢測
采用免疫組化法檢測組織α-SMA、Ⅲ型膠原蛋白表達,免疫組化試劑盒均由美國Santa公司提供,按試劑盒說明操作。在400倍鏡下隨機選取5個視野,以胞質內有棕黃色顆粒狀染色為陽性,計算陽性細胞數,取均值。
五、統計學處理
結 果
一、大鼠胰腺組織的病理改變
對照組大鼠胰腺組織未見病理改變。艾塞那肽組大鼠胰腺組織局部腺泡細胞水腫,腺泡間隔擴張,出現慢性炎性改變。糖尿病組大鼠胰腺腺泡細胞水腫,腺泡間隔擴張程度較艾塞那肽組嚴重(圖1)。艾塞那肽組大鼠胰腺組織在水腫、纖維化、病變面積、炎癥等方面的病理評分較對照組顯著增加,糖尿病組大鼠胰腺組織的病理評分又較艾塞那肽組顯著增加,差異均具有統計學意義(P值均<0.05)。但各組間胰腺腺體萎縮的病理評分差異無統計學意義(表 1)。

表1 各組大鼠胰腺組織的病理評分
注:與對照組比較,t值均為71,aP<0.05;與艾塞那肽組比較,t值均為82,bP<0.05
二、大鼠胰腺組織MMP-2、MMP-9蛋白含量
對照組、艾塞那肽組和糖尿病組胰腺組織的MMP-2含量分別為(186.98±23.24)、(306.07±59.82)、(365.08±89.55)μg/L;MMP-9含量分別為(49.37±7.08)、(67.24±14.73)、(87.37±13.39)μg/L。艾塞那肽組和糖尿病組均顯著高于對照組,差異具有統計學意義(t值分別為-6.872、-5.111、-3.821、-4.787,P值均<0.05),但艾塞那肽組和糖尿病組間的差異無統計學意義。
三、大鼠胰腺組織α-SMA的表達
對照組大鼠胰腺內α-SMA表達僅見于血管壁;艾塞那肽組和糖尿病組大鼠胰腺α-SMA表達除見于血管壁外,還見于胰腺腺泡細胞的周圍及間質,陽性染色細胞多,染色沉著,且糖尿病組的陽性染色區域較艾塞那肽組的范圍更大(圖1)。
對照組、艾塞那肽組和糖尿病組大鼠胰腺高倍視野下α-SMA陽性細胞數分別為(13.4±6.0)、(29.5±8.8)、(79.3±27.2)個,艾塞那肽組顯著多于對照組,糖尿病組又顯著多于艾塞那肽組,差異均具有統計學意義(t值分別為-2.003、-2.599,P值均<0.05)。
四、大鼠胰腺組織Ⅲ型膠原蛋白的表達
Ⅲ型膠原蛋白表達于胰腺組織的間質內(圖2)。對照組、艾塞那肽組和糖尿病組大鼠胰腺高倍視野下Ⅲ型膠原蛋白陽性細胞數分別為(10.6±4.9)、(29.3±13.0)、(56.0±27.2)個,艾塞那肽組顯著多于對照組,糖尿病組又顯著多于艾塞那肽組,差異均具有統計學意義(t值分別為-2.784、-2.883,P值均<0.05)。
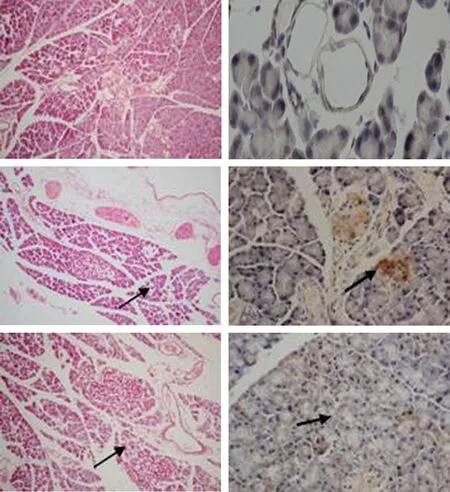
圖1對照組(上)、艾塞那肽組(中)、糖尿病組(下)胰腺組織(左)的病理改變(HE ×100) 及α-SMA表達(右,免疫組化 ×200)
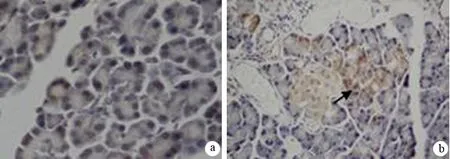
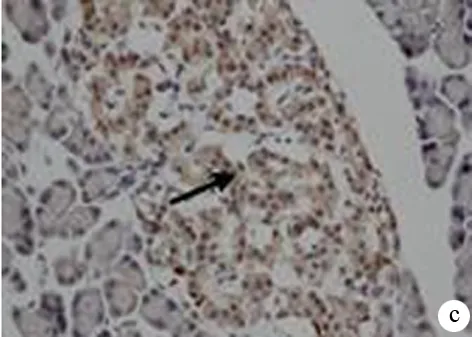
圖2對照組(a)、艾塞那肽組(b)、糖尿病組(c)胰腺組織Ⅲ型膠原蛋白的表達(免疫組化 ×200)
討 論
艾塞那肽誘發大鼠胰腺組織損傷的機制可能有:(1)通過局部及中心迷走神經刺激胰腺的內外分泌功能,進而對胰腺產生廣泛的損害,誘發胰腺炎[9];(2)艾塞那肽為來自美洲巨蜥唾液中毒液的生物制品,與人體的免疫系統存在某種排斥反應,從而導致胰腺炎的發生[10];(3)脂蛋白及胰腺內分泌功能改變所引起的體重減輕可能是其誘發胰腺炎的原因[11];(4)應用艾塞那肽后導致GLP-1受體大量活化,引起胰腺體積增大,同時選擇性調節胰腺炎相關性基因的表達,誘發胰腺炎[12]。但Tatarkiewicz等[6]研究卻表明,艾塞那肽不誘發胰腺炎,反而可減輕化學誘導的胰腺炎,這可能與其實驗動物種類、用藥劑量及實驗周期不同有關。
本研究結果顯示,艾塞那肽組出現典型的慢性胰腺炎改變,其中2只大鼠的改變最為明顯;糖尿病組也出現慢性胰腺炎表現,且病變程度較艾塞那肽組更重,其中4只病變最為明顯。糖尿病組病變程度更重的原因可能有:(1)糖尿病的胰島中存在胰腺星狀細胞(PSC),艾塞那肽可激活PSC引起更廣泛、更嚴重的損害[13];(2)在糖尿病長期的病理生理狀態下,胰腺組織中的PSC可能對艾塞那肽敏感性增加,更容易被激活引起慢性炎性病變。
王興鵬等[14]報道,α-SMA為PSC活化的標志物。PSC活化后可分泌細胞外基質(ECM)。Apte等[15]報道,活化的PSC能分泌大量MMP,參與細胞外基質的降解。本研究結果顯示,艾塞那肽組和糖尿病組大鼠胰腺組織中α-SMA及Ⅲ型膠原蛋白陽性細胞數量均較對照組增多,細胞染色程度深,且糖尿病組的陽性細胞數又較艾塞那肽組顯著增加,同時胰腺組織中MMP-2、MMP-9含量顯著增加,提示兩實驗組胰腺組織中PSC被大量激活,糖尿病組胰腺組織有更多的PSC被激活。
慢性胰腺炎是胰腺癌發病最常見的危險因素。Vakkila等[16]研究表明,慢性胰腺炎患者患胰腺癌風險較普通人群明顯增加15~16倍,并且慢性胰腺炎發生癌變的風險隨時間的推移而逐漸增加。由此推斷,長期使用艾塞那肽可誘發慢性胰腺炎,將會增加胰腺癌風險。盡管艾塞那肽治療2型糖尿病有諸多優點,但其增加胰腺癌風險的可能更不應該忽視。
[1] Ahmad SR, Swann J. Exenatide and rare adverse events. N Engl J Med, 2008,358:1970-1971.
[2] FDA. Drug information for healthcare professionals exenatide (marketed as Byetta) [EB/OL].2008. http://www.fda.gov/ cder/drug/ InfoSheets/HCP/exenatide2008HCP.htm.
[3] Denker PS, Dimarco PE. Exenatide (exendin-4)-induced pancreatitis: a case report. Diabetes Care, 2006,29:471-483.
[4] Tripathy NR, Basha S, Jain R, et al. Exenatide and acute pancreatitis. J Assoc Physicians India, 2008,56:987-988.
[5] Ayoub WA, Kumar AA, Naguib HS, et al. Exenatide induced acute pancreatitis. Endocr Pract,2010,16:80-83.
[6] Tatarkiewicz K, Smith PA, Sablan EJ, et al. Exenatide does not evoke pancreatitis and attenuates chemically induced pancreatitis in normal and diabetic rodents.Am J Physiol Endocrinol Metab,2010, 299: E1076-E1086.
[7] Zhang W, Gao J, Zhao T, et al. High-Dose Naproxen Aggravates Pancreatic Fibrosis in Rat Model of Chronic Pancreatitis. Pancreas, 2010,39: 293-300.
[8] Schmidt J, Rattner DW, Lewandrowski K, et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg,1992,215:44-56.
[9] Whitcomb DC. Mechanisms of disease: advances in understanding the mechanisms leading to chronic pancreatitis. Nat Clin Pract Gastroenterol Hepatol,2004,1:46-52.
[10] Ahmad SR, Swann J. Exenatide and rare adverse events. N Engl J Med, 2008,358: 1970-1971.
[11] Triplitt C, Chiquette E. Exenatide: from the Gila monster to the pharmacy. J Am Pharm Assoc,2006,46:44-52.
[12] Koehler JA, Baggio LL, Lamont BJ, et al. Glucagon-like peptide-1 receptor activation modulates pancreatitis-associated gene expression but does not modify the susceptibility to experimental pancreatitis in mice. Diabetes, 2009,58:2148-2161.
[13] Homo-Delarche F, Calderari S, Irminger JC, et al. Islet inflammation and fibrosis in a spontaneous model of type 2 diabetes, the GK rat. Diabetes, 2006, 55:1625-1633.
[14] 王興鵬, 張汝玲, 龔自華,等. 胰腺星狀細胞在大鼠胰腺纖維化形成中作用. 中華消化雜志,2003, 23: 466-469.
[15] Apte MV, Park S, Phillips PA, et al. Desmop lastic reaction in pancreatic cancer: role of pancreatic stellate cells. Pancreas, 2004, 29: 179-187.
[16] Vakkila J, Lotze MT. Inflammation and necrosis promote tumour growth. Nat Rev Immunol,2004,4:641-648.
TheexperimentalstudyofpancreatictissuelesioninducedbyExenatide
YANGYong-chao,YUXiao,HUANGLi-hua,YUCan.
DepartmentofAbdominalSurgery,ThirdXiangyaHospital,Central-SouthUniversity,Changsha410013,China
ObjectiveTo explore the mechanism of Exenatide-induced rat pancreatic tissue lesion.MethodsThirty SD male rats were divided into three groups according to complete random design, and each group had 10 rats, namely Exenatide group, diabetes-model group and control group. Diabetes-model rats were induced by streptozotocin (STZ, 35mg/kg) and high-sugar and high-fat diet. The Exenatide group and diabetes group were subcutaneously administered with Exenatide at a dose of 5 μg/kg twice a day. The control group was treated with same amount of saline. Ten weeks later, all the rats were sacrificed and the pancreatic tissues were harvested for routine pathological examination. Immunohistochemical method was used to detect the expression of α-smooth muscle actin (α-SMA) and type III collagen protein in pancreatic tissue, and ELISA was applied to measure the expression of matrix metalloprotei-nase-2 (MMP-2) and MMP-9 in pancreatic tissue.ResultsIn control group, there was no pathological change in pancreatic tissue. In Exenatide group, chronic inflammatory changes were observed; and the degree of inflammatory changes were much severe in diabetes group, and the pathological scores were gradually increased in the 3 groups (P<0.05). The expressions of MMP 2 in pancreatic tissue in control group, Exenatide group, diabetes group were (186.98±23.24), (306.07±59.82), (365.08±89.55)μg/L, and the expressions of MMP-9 were (49.37±7.08), (67.24±14.73), (87.37±13.39)μg/L. The values were significantly higher in Exenatide group and diabetes group than those in control group (P<0.05), but the difference between the two groups was not statistically significant. The numbers of α-SMA positive cells per high power field were (13.4±5.97), (29.5±8.80), (79.3±27.23) in control group, Exenatide group, diabetes group, and the numbers of type III collagen positive cells were (10.6±4.93), (29.3±12.95), (56.0±27.21). The values were significantly higher in Exenatide group than those in control group, and the values were significantly higher in diabetes group than those in Exenatide group (P<0.05).ConclusionsLong-term subcutaneous injection of Exenatide may activate pancreatic stellate cells and cause expression of α-SMA, III collagen protein, and MMP-2, MMP-9, then induce chronic inflammatory changes.
Pancreas; Astrocytes; Exenatide; Pathology; Rats
2013-06-03)
(本文編輯:呂芳萍)
10.3760/cma.j.issn.1674-1935.2013.06.007
湖南省自然科學基金(12JJ5052)
410013 湖南長沙,中南大學湘雅三醫院普外科
余梟,Email: yuxiaoyx4@126.com

