缺氮條件對柵藻油脂積累與光合作用的影響
劉金麗 , 王俊峰, 劉天中, 高莉麗
(1. 中國海洋大學 食品科學與工程學院, 山東 青島 266003; 2. 中國科學院 青島生物能源與過程研究所,中國科學院 生物燃料重點實驗室, 山東 青島 266101)
近年來, 可再生能源的研發在全球范圍形成持續熱潮。利用微藻生產生物柴油具有不與人爭糧、不與糧爭地、不與糧爭水、副產物價值高等優勢, 是重要的液體燃料替代形式[1-2]。在適宜條件下, 產油微藻通常處于營養生長狀態, 細胞內脂質含量較低,且多為極性脂(polar lipid), 如磷脂(phospholipid); 而在脅迫條件下, 細胞內很快積累大量中性脂(neutral lipid), 如甘油三脂(triacylglycerol, TAG)。這期間細胞所經歷的生理生化變化是近年來研究的熱點。如Li等[3-4]發現抑制萊茵衣藻(Chlamydomonas reinhardtii)的淀粉合成途徑會提高油脂含量, 表明在衣藻中脂肪代謝與糖代謝密切相關。Chen等[5]發現微擬球藻(Nannochloropsis)的脂肪酸組成與初始細胞接種量密切相關, 接種細胞濃度較低時中性脂含量高, 而接種濃度較高時極性脂含量較高, 表明微藻脂肪酸組分可能與細胞所處光環境有關。Cakmak等[6]發現缺氮或缺硫都可以提高衣藻的TAG含量。Recht等[7]發現缺氮條件下雨生紅球藻(Haematococcus pluvialis)和微擬球藻均會大量積累油脂, 但它們的糖-脂比例存在不同的變化模式。
柵藻(Scenedesmus dimorphus)屬綠藻門(Chlorophyta)、綠球藻目(Chlorococcales), 是一種常見的淡水微藻, 廣泛分布于湖泊、池塘、沼澤等靜水生境。柵藻是研究水體環境、水體污染、光合作用的常用材料。同時, 由于其生長快速、能大量合成油脂, 是典型的產油微藻[8]。柵藻對環境的適應性強,耐污染能力強[9], 甚至能在污水、城市生活廢水中生長[10], 這一特性使其在規模化培養方面較其他微藻更具優勢。有學者研究了柵藻合成蝦青素過程的色素組成和光合作用的變化[11-13], 但關于其油脂積累過程的報道還較少。深入了解柵藻的產油過程將有助于推進利用柵藻生產微藻柴油的研究和應用。本研究利用柵藻(Scenedesmusdimorphus)為實驗材料,考察了缺氮條件下柵藻的油脂含量和組分變化以及光合作用的改變。
1 材料與方法
1.1 藻種與培養基
本實驗所用柵藻(Scenedesmus dimorphus)來自中國科學院青島生物能源與過程研究所, 所用培養基為 BG11[14]。柵藻油脂誘導過程采用不含硝酸鈉(NaNO3)的缺氮 BG11培養基, 其他組分及含量均不變, 對照組為完全BG11培養基培養。
1.2 反應器與培養方法
本實驗所用反應器為玻璃柱式反應器, 內直徑0.05 m, 柱高0.55 m, 工作體積0.9 L。柱式反應器內部有一直徑 5 mm的玻璃通氣管。混合有 1.5%CO2(V/V)的壓縮空氣(0.1 MPa)以0.1 vvm的速率通過通氣管從反應器底部鼓泡, 從而將藻液攪動并補充碳源。培養過程中連續照光, 培養柱表面光強100 μmol/(m2·s)。培養溫度25°C, 培養過程中pH維持在7.0~8.0。對照組(完全BG11)和實驗組(缺氮BG11)各培養5支柱子, 測定其中的3支, 記為3個重復。
1.3 生長測定
用質量分析方法測定藻液生物量濃度。將孔徑0.45 μm, 直徑 50 mm的混合纖維素濾膜(上海興亞凈化材料廠, 上海)煮沸3次, 并于105℃熱風干燥24 h后稱重。將一定體積的藻液過濾于濾膜上, 并用3倍體積的去離子水沖洗 3次, 以去掉附著在細胞表面的鹽分, 105 °C熱風干燥24 h后再次稱重。根據兩次質量之差計算出藻液生物量濃度。
葉綠素及類胡蘿卜素含量參照甲醇提取葉綠素[15]的方法。測定甲醇提取液在666 nm, 653 nm, 470 nm下的OD值。根據以下公式分別計算葉綠素a(Chla), 葉綠素b(Chlb), 類胡蘿卜素(Car)的含量:

1.4 電鏡觀察
1.4.1 掃描電鏡(Scanning electron microscopy,SEM)
取少量藻液于1.5 mLEP管中離心(5 000 g, 30 s),去上清, 雙蒸水清洗藻渣3次。加入1 mL的2.5%戊二醛固定2 h, 然后加1.5 mL磷酸緩沖液(pH 7.0)清洗3次, 每次10 min。加1%鋨酸固定1 h。固定完后,依次用10%, 30%, 50%, 70%, 80%, 90%(V/V)乙醇脫水, 每個梯度15 min。再浸入100%乙醇脫水2次, 每次 10 min, 然后浸入 1:1(V/V)的乙醇-叔丁醇混合液中15 min, 再浸入100%叔丁醇中2次, 每次15 min,最后冷凍干燥。用導電膠帶粘于樣品臺, 噴金后觀察SEM圖像。
1.4.2 透射電鏡(Transmission electron microscopy,TEM)
取樣固定步驟同 1.4.1。固定后樣品用磷酸緩沖液(pH 7.0)清洗 2 h, 然后依次用 10%, 30%, 50%,70%, 80%, 90%丙酮脫水, 每個梯度15 min。之后浸入100%丙酮中3次, 每次10 min。然后浸入丙酮與Epon812樹脂混合液(V∶V= 7:3)中5 h, 再浸入丙酮與Epon812樹脂混合液(V∶V= 3:7)中過夜。最后純Epon812樹脂中浸沒5 h并聚合硬化成包埋塊, 超薄切片機切片, 2%醋酸雙氧鈾染色20 min后觀察TEM圖像。
1.5 油脂含量及組分分析
將藻液離心收集后(5 000g, 30 s), 藻細胞真空冷凍干燥后研磨成干粉, 依據有機溶劑氯仿-甲醇提取方法[16]提取藻細胞中的總脂并稱重定量。
分析油脂組分及含量用棒狀薄層色譜法(TLC/FID)來測定。將提取的油脂用氯仿溶解, 取1 μL分4~5次點樣在棒狀薄層色譜柱上, 先后在兩種展開劑中展開。展開劑Ⅰ:苯:氯仿:乙酸 = 50:20:0.75 (V/V),展開劑Ⅱ:苯:己烷 = 1:1 (V/V)。將分離開來的脂質成分出峰時間與標準樣品相對比, 確定其組成及相對含量。分析過程中的條件控制: 空氣流 2 L/min , 氫氣流0.16 L/min。
1.6 光合放氧速率的測定
使用 Chlorolab-2液相氧電極(Hansatech, 英國)測定柵藻細胞在不同光強(PFD)下的放氧速率。將藻液離心后(5 000g, 30 s)沉淀用含有50 mmol/L NaHCO3的含氮或無氮BG11重新懸浮, 調整懸浮液葉綠素濃度至10 mg/L。將1 mL懸浮液加入反應杯中, 通入純氮氣1 min趕走溶解氧, 打開光源記錄放氧速率。通過加減遮光片數量改變入射光強, 設置的光強梯度為: 400, 200, 100, 80, 60, 40, 20, 0 μmol/(m2·s)。每個光強測定3次, 每次測定前更換新藻液。根據葉子飄和李進省[17]和 Ye[18]的方法擬合 PFD-放氧速率曲線, 并計算暗呼吸速率(Rd)、最大放氧速率 (Pmax)、光補償點 (LCP)和光飽和點 (LSP)。
1.7 葉綠素熒光的測定
使用Imaging-PAM (Walz, 德國)測定柵藻的最大光化學效率 (Fv/Fm)和非光化淬滅系數(Non-photochemical quenching co-efficiency, NPQ)。將藻液過濾與孔徑0.45 μm的混合纖維素濾膜上, 然后置于用含50 mmol/L NaHCO3的含氮或無氮BG11培養基潤濕的濾紙上。將濾紙連同濾膜一起置于熒光儀CCD攝像頭下暗適應15 min。打開測量光, 測定初始熒光 (F0), 然后加飽和脈沖光 (10 000 μmol/(m2·s)),測定最大熒光 (Fm), 之后打開活化光 (100 μmol/(m2·s))。待熒光值穩定后再加一次飽和閃光, 測定實際最大熒光 (Fm’)。按照如下公式計算相關參數[19]:
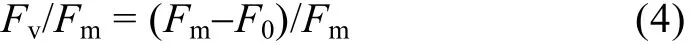
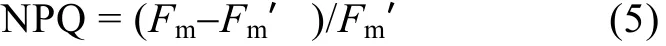
1.8 統計分析
使用 spss10.0對實驗組與對照組做t檢驗, 當P<0.05時認為兩者存在顯著差異。圖中數據為3次重復的平均值±標準差。
2 結果
2.1 缺氮處理對柵藻生長的影響
電鏡結果如圖1所示, 其中(a)~(c)是掃描電鏡結果, 標尺=3 μm; (d)~(f)是透射電鏡結果, 標尺=1 μm;(a)和(d)是接種初始時結果; (b)和(e)是對照組(高氮)培養10 d的結果; (c)和(f)是缺氮培養10 d的結果; (g)是(d)圖框定區域的放大, 標尺=0.5 μm。SG表示淀粉粒; TL表示類囊體; LB表示脂肪體。實驗開始時柵藻細胞呈梭形, 并以四連體形式存在(圖1a), 細胞內可見淀粉粒被類囊體膜包裹, 無脂肪體(圖1d, g)。缺氮處理 10 d后, 柵藻細胞四連體解體, 直徑明顯增大(圖1c), 細胞壁明顯加厚, 細胞內部大量空間被脂肪滴和淀粉粒填充(圖1f)。高氮條件下(對照組)生長10 d后細胞形態與初始時變化不大(圖1b), 但細胞壁明顯加厚, 淀粉粒明顯增多(圖1e)。
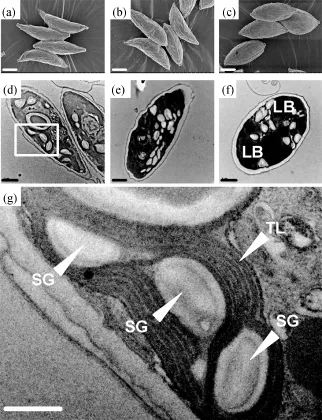
圖1 缺氮處理對柵藻(Scenedesmus dimorphus)細胞形態和結構的影響Fig.1 The effect of nitrogen starvation on the morphology and structure of the Scenedesmus dimorphus
缺氮處理的生物量積累與對照組在前 4 d差別不大(P>0.05), 4 d后缺氮處理生物量積累速率減慢并顯著低于對照組(P<0.05)。對照組10 d內生物量增加到(5.8 ± 0.03)g/L, 而缺氮處理組為(4.1 ± 0.04)g/L(圖 2)。
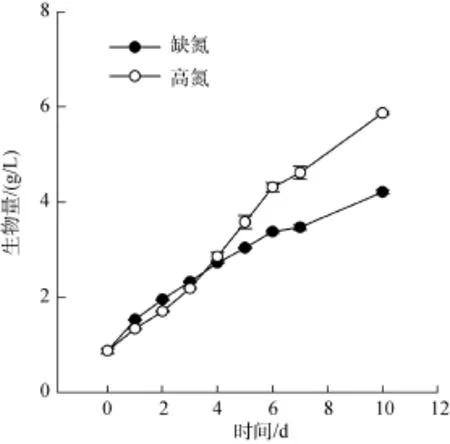
圖2 缺氮處理對柵藻(Scenedesmus dimorphus)生長的影響Fig.2 The effect of nitrogen starvation on the biomass accumulation of the Scenedesmus dimorphus
隨著培養時間延長, 對照組和處理組的單位干重葉綠素和類胡蘿卜素含量都降低, 但缺氮處理降低的更快(圖3a, 圖3b)。與對照組相比, 缺氮處理組的類胡蘿卜素/葉綠素含量比值在培養過程中逐漸升高并一直顯著高于對照組(P<0.05; 圖3c)。對照組與處理組的葉綠素 a/葉綠素 b含量比值差別不大并一直維持在2.2~3.1之間(圖3d)。
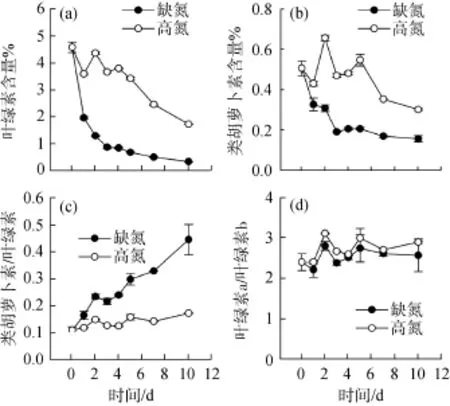
圖3 缺氮處理對柵藻(Scenedesmus dimorphus)葉綠素和類胡蘿卜素積累的影響Fig.3 The effect of nitrogen starvation on the accumulation of chlorophyll and carotenoid in the Scenedesmus dimorphus
2.2 缺氮處理對柵藻油脂積累和油脂組分的影響
未經缺氮處理的柵藻細胞總脂含量占干重的(22.4 ± 0.6)%, 其中總脂的(92.8 ± 1.6)%為磷脂(PL),中性脂(TAG)只占(4.6 ± 1.2)%(圖4)。缺氮處理后柵藻總脂含量逐漸升高, 13 d后總脂含量升高到(36.3 ± 0.7)%(圖 4), 顯著高于(P<0.05)對照組的(30.1 ± 0.7)%; 其中 TAG 含量升高到(68.3 ± 2.5)%(圖4), 顯著高于(P<0.05)對照組的(37.0 ± 0.1)%; PL 含量降低到(26.8 ± 2.0)%(圖 4), 顯著低于(P<0.05)對照組的(55.7 ± 2.4)%。
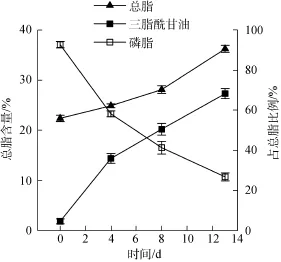
圖4 缺氮處理對柵藻(Scenedesmus dimorphus)總脂含量和總脂組分的影響Fig.4 The effect of nitrogen starvation on the total lipid content and lipid components of the Scenedesmus dimorphus
2.3 缺氮處理對柵藻光合作用的影響
缺氮處理使柵藻的暗呼吸速率(Rd)和光補償點(LCP)迅速升高, 而對照組在實驗過程中維持穩定(圖5a, d)。隨著培養時間的延長, 缺氮處理組和對照組的最大放氧速率(Pmax)都逐漸降低, 至實驗結束時分別為(37.6 ± 3.6)μmol O2/ mgchl·h 和(75.4 ± 6.4)μmolO2/ (mgchl·h)(圖 5b)。實驗開始時, 柵藻的光飽和點(LSP)為(198.2 ± 6.8)μmol/(m2·s), 之后實驗組和對照組均降低, 到第 13 天時, 缺氮處理組降低到(94.4 ± 2.1)μmol/(m2·s), 而對照組降低到 (119.7 ±1.6)μmol/(m2·s)(圖 5c)。
培養過程中, 對照組的最大光化學效率(Fv/Fm)和非光化學猝滅系數(NPQ)基本維持穩定。缺氮處理1 d后柵藻Fv/Fm即明顯低于對照組, 但前 4 d內Fv/Fm一直維持在較高水平(>0.6), 之后開始逐漸下降, 到第10 天時已降至0.4 ± 0.01; 而NPQ在前3 d內較低且維持穩定, 從第 4 天開始逐步升高, 到第10 天時以升高到1.5 ± 0.01, 是初始時的1.8倍(圖6)。
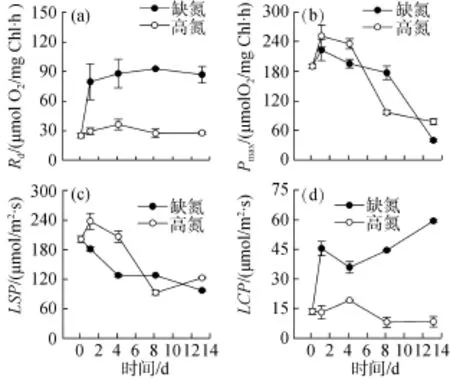
圖5 缺氮處理對柵藻(Scenedesmus dimorphus)光合放氧參數的影響Fig.5 The effect of nitrogen starvation on the photosynthetic oxygen evolution of the Scenedesmus dimorphus
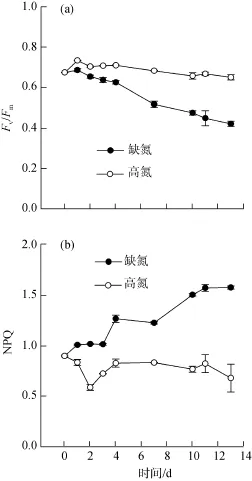
圖6 缺氮處理對柵藻(Scenedesmus dimorphus)最大光化學效率(Fv/Fm)和非光化學猝滅系數(NPQ)的影響Fig.6 The effect of nitrogen starvation on the maximum photo-chemical efficiency (Fv/Fm)and non-photochemical quenching co-efficiency (NPQ)of Scenedesmus dimorphus
3 討論
三脂酰甘油(TAG)是優質的生物能源原料。經過酯化反應, TAG中的脂肪酸鏈可以轉化成能完全替代普通柴油的高熱值、低污染的生物柴油, 而剩余的甘油骨架既是重要的工業原料, 也可以通過進一步加氫轉化成生物乙醇[20]。本研究發現培養13 d后, 柵藻的總脂含量達到干重的 36%, 顯著高于油料作物大豆的平均水平[21]。這一值與雨生紅球藻(Haematococcus)的含油量接近[7]而低于微擬球藻(Nannochloropsis)[5]。高含油量, 特別是高中性脂含量是微藻作為生物柴油原料來源的重要優勢。目前,關于微藻脂肪代謝, 特別是脅迫條件下 TAG的積累過程的研究尚不充分[21]。本研究發現缺氮條件下, 隨著TAG含量的升高, 磷脂含量出現相應的下降(圖4),同時細胞內部的膜結構也逐漸減少(圖1f)。據此推測柵藻細胞內部可能存在將磷脂轉化成TAG的機制。例如, 通過磷脂二脂酰甘油酰基轉移酶(Phospholipid diacylglycerol acyltransferase, PDAT)的磷脂代謝途徑。在高等植物中PDAT途徑廣泛存在, 而在微藻中只存在于少數種類[22-23], 而柵藻中尚未見報道。此外,脅迫條件下微藻細胞碳源的分配問題一直不太清楚。Li等[3-4]發現抑制衣藻的淀粉代謝會導致油脂積累的增加, 說明淀粉合成和油脂合成會競爭碳源。Recht等[7]發現對于雨生紅球藻來說在氮缺乏條件下存在由淀粉向 TAG轉化的代謝途徑, 而在Nannochloropsis中則不存在這樣的途徑。在本實驗中, 缺氮培養 13 d后的柵藻細胞中, 除了大量的脂肪體外, 還存在較多的淀粉粒和較厚的細胞壁(圖1f),這說明柵藻的大量合成TAG的過程對糖代謝的影響較小, 胞外碳源直接流向了能量密度較高的脂肪酸合成途徑。
營養缺乏(特別是氮源缺乏)結合高光強是誘導微藻合成次生代謝物的常用方法[6-7,24-25]。本研究中,培養用光強為 100 μmol/(m2·s)左右, 這一光強在實驗初期遠低于 200 μmol/(m2·s)的光飽和點(LSP), 即使在培養后期也僅達到與LSP接近的水平(圖 5c),所以柵藻細胞所處的環境只有缺氮脅迫而沒有強光脅迫。與對照組相比, 缺氮處理的柵藻細胞最明顯的改變是葉綠素含量降低而呼吸速率升高, 而且這些變化十分迅速, 在處理第 1 天即表現出來(圖3a, 圖5a)。脅迫條件下葉綠素含量快速降低、呼吸速率升高的現象已經被廣泛報道[7,11,26], 但多是在強光下(>300 μmol/(m2·s))或室外(光強>2 000 μmol/(m2·s)的研究結果。另外, 許多研究表明在脅迫條件下微藻細胞內的類胡蘿卜素含量升高[6,11-13], 但是本研究中,缺氮脅迫下柵藻細胞內類胡蘿卜素含量實在培養過程中一直在降低(圖3b)。這表明類胡蘿卜素(蝦青素)的合成可能需要強光環境。葉綠素熒光參數Fv/Fm是反映光系統II完整性的重要指標[27]。通常情況下, 經充分暗適應的未受脅迫的綠藻Fv/Fm值在 0.7左右,受到脅迫后該值降低。Parkhill等[28]發現營養鹽的缺乏對微藻的Fv/Fm值的影響不明顯, 這與本文的結果不同, 我們發現缺氮處理 1d后柵藻Fv/Fm即明顯低于對照組。但同時我們也注意到, 在缺氮處理前期柵藻光系統Ⅱ并沒有受到嚴重損傷, 4 d之后光系統Ⅱ的損傷逐步加劇, 類似的情況也表現在最大光合放氧速率(圖5b)和NPQ上(圖6b)。如果說強光條件下減少葉綠素含量、增大呼吸速率、提高光系統Ⅱ失活反應中心的比例、提高NPQ等改變有助于光合系統減少光能吸收、加快能量耗散, 從而減少過剩激發能產生的傷害[18], 那么非飽和光下的類似變化如何解釋?我們給出兩種假設: 1)碳同化和氮同化過程是光合作用產生的能量通匯(ATP)和還原力(NADPH)的主要流向[29]。氮源缺乏的時候, ATP和NADPH會相對過剩, 進而導致光合電子傳遞鏈激發能的過度積累, 可能會進一步造成光合作用的損傷, 從而需要啟動上述機制以保護細胞。2)上述生理學變化與光破壞的防御機制無關, 而是柵藻細胞為了適應缺氮環境, 將自身代謝模式由先前的營養生長主動轉換到次生代謝物積累的結果, 可能反映了細胞將暫時無用物質(如氮代謝酶系統)轉化為能量儲存物質(如TAG)的過程。
[1]Wijffels R, Barbosa M. An Outlook on Microalgal Biofuels [J]. Science, 2010, 329: 796-799.
[2]Chisti Y. Biodiesel from microalgae [J]. Biotechnol Adv,2007, 25: 294-306.
[3]Li Y, Han D, Hu G, et al.Chlamydomonasstarchless mutant defective in ADP-glucose pyrophosphorylase hyper-accumulates triacylglycerol [J]. Metab Eng, 2010,12(4): 387-391.
[4]Li Y, Han D, Hu G, et al. Inhibition of starch synthesis results in overproduction of lipids inChlamydomonasreinhardtii[J]. Biotechnol Bioeng, 2010, 107(2): 258-268.
[5]Chen Y, Wang J, Liu T, et al. Effects of initial population density (IPD)on growth and lipid composition ofNannochloropsissp. [J]. J Appl Phycol, 2012, 24(6):1623-1627.
[6]Cakmak T, Angun P, Demiray Y, et al. Differential effects of nitrogen and sulfur deprivation on growth and biodiesel feedstock production ofChlamydomonas reinhardtii[J]. Biotechnol Bioeng, 2012, 109(8):1947-1957.
[7]Recht L, Zarka A, Boussiba S. Patterns of carbohydrate and fatty acid changes under nitrogen starvation in the microalgaeHaematococcus pluvialisandNannochloropsissp [J]. Appl Microbiol Biotechnol, 2012, 94: 1495-1503.
[8]Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production:perspectives and advances [J]. Plant J, 2008, 54:621-639.
[9]Lee Y K. Microalgal mass culture systems and methods:their limitation and potential [J]. J Appl Phycol, 2001,13: 307-315.
[10]呂素娟, 張維, 彭小偉, 等. 城市生活廢水培養產油微藻的可行性 [J]. 生物工程學報,2011, 27(3):445-452.
[11]秦山, 劉國祥, 胡征宇. 斜生柵藻中蝦青素的積累過程及其光合活性的變化 [J]. 水生生物學報,2009,33(3): 509-515.
[12]Qin S, Liu G, Hu Z. The accumulation and metabolism of astaxanthin inScenedesmus obiquus(Chlorophyceae)[J]. Process Biochem, 2008, 43: 795-802.
[13]Pirastru L, Darwish M, Chu F, et al. Carotenoid production and change of photosynthetic functions inScenedesmussp. exposed to nitrogen limitation and acetate treatment [J]. J Appl Phycol, 2012, 24: 117-124.
[14]Boussiba S, Vonshak A. Astaxanthin accumulation in the green algaHaematococcuspluvialis[J]. Plant Cell Physiol, 1991, 32:1077-1082.
[15]Wellburn A R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution [J]. J Plant Physiol, 1994, 144: 307-313.
[16]Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification [J]. Can J Biochem Physiol,1959, 37:911-917.
[17]葉子飄, 李進省. 光合作用對光響應的直角雙曲線修正模型和非直角雙曲線模型的對比研究 [J]. 井岡山大學學報 (自然科學版), 2010, 31(3):38-44.
[18]Ye Z P. A newmodel for relationship between light intensity and the rate of photosynthesis inOryza sativa[J]. Photosynthetica, 2007, 45(4): 637-640.
[19]王俊峰, 馮玉龍, 李志. 飛機草和蘭花菊三七光合作用對生長光強的適應 [J]. 植物生理與分子生物學學報, 2003, 29(6): 542-548.
[20]Dellomonaco C, Fava F, Gonzalez R. The path to next generation biofuels: successes and challenges in the era of synthetic biology [J]. Microb Cell Fact, 2010, 9: 3.
[21]王連錚, 王嵐, 趙榮娟, 等. 高油大豆新品種中黃20(中作 983)的選育和提高大豆含油量的育種研究[J]. 中國油料作物學報, 2003, 25(4): 35-43.
[22]Merchant S, Kropat J, Liu B, et al. TAG, you’re it!Chlamydomonasas a reference organism for understanding algal triacylglycerol accumulation [J].Curr Opin Biotech, 2012, 23: 352-363.
[23]Boyle R, Page M, Liu B, et al. Three acyltransferases and bitrogen-responsive regulator are implicated in nitrogen starvation-induced triacylglycerol accumulation inChlamydomonas[J]. J Biol Chem, 2012, 287:15811-15825.
[24]Illman A M, Scragg A H, Shales S W. Increase in Chlorella strains calorific values when grown in low nitrogen medium [J]. Enzyme Microb Tech, 2000, 27:631-635.
[25]Lv J M, Cheng L H, Xu X H, et al. Enhanced lipid production ofChlorellavulgaris by adjustment of cultivation conditions [J]. Bioresource Technol,2010,101(17): 6797-6804.
[26]Wang J, Han D, Sommerfeld M, et al. Effect of initial biomass density on growth and astaxanthin production ofHaematococus pluvialisin an outdoor photobioreactor [J]. J Appl Phycol, 2013, 25: 253-260.
[27]Govindjee S A. On the relation between the Kautsky effect(Chlorophyll a fluorescence induction)and photosystem II:Basic and applications of the OJIP fluorescence transient[J]. J Photoch Photobio B, 2011, 104: 236-257.
[28]Parkhill J, Maillet G, Cullen J J. Fluorescence-based maximum quantum yield for PSII as a diagnostic of nutrient stress [J]. J phycol, 2001, 37(4): 517-529.
[29]Huppe H C, Turpin D H. Integration of carbon and nitrogen metabolism in plant and algal cells [J]. Annu Rev Plant Physiol Plant Mol Biol, 1994, 45: 577-607.

