錦鯉皰疹病毒-CJ株ORF124基因的克隆及生物信息學分析
周井祥,王 好,呂文亮,李新偉
(吉林農業大學動物科技學院,長春 130118)
錦鯉皰疹病毒病(Kio herpesvirus disease,KHVD)是由錦鯉皰疹病毒(Kio herpesvirus,KHV)引起錦鯉、鯉魚及其普通變種如框鏡鯉發病的一種具有高度傳染性和致死性的疾病。該病于1998年首次在以色列的 Magan Michael地區和美國爆發[1],2000年該病在中國廣東省錦鯉疑似發生本病[2]。該病在我國的鯉魚養殖中發病較多,造成鯉魚的大量死亡,給鯉魚養殖業帶來了巨大經濟損失。KHV是線形雙股DNA病毒,是魚類皰疹病毒屬中基因組最大的病毒[3]。目前,Genbank已經公布了三株分別來自日本、美國和以色列錦鯉皰疹病毒的基因序列[4],基因組大小為295 kbp,并含有22 kbp的末端同向重復序列;有156個開放性閱讀框(ORF),8個末端重復序列。KHV的156個ORF的功能只有少數已經確定其功能。研究較多的ORF25、ORF81和ORF83基因主要在細胞質中表達[5],可以誘導產生中和抗體。研究還對ORF25、ORF81和ORF83基因進行了生物信息學分析[6-8];Agus Sunarto 等[9]克隆了編碼白細胞介素-10(ORF134基因)并對其功能進行了分析;Takashi Aoki等[10]制備了針對 KHV ORF68 基因的單克隆抗體;Murwantoko等克隆了KHV膜糖蛋白基因ORF124并對其進行了表達,同時對其進行了部分生物學信息分析,ORF124基因預測分析表明:主要表達膜糖蛋白,可具有良好的免疫原性,產生中和性抗體,可作為制備疫苗的候選基因[11]。
研究以實驗室在國內首次分離到的錦鯉皰疹病毒吉林株(KHV-CJ株)基因組為模板,克隆KHV膜蛋白ORF124基因,并分析其生物學信息,旨在為我國錦鯉皰疹病毒的基因背景信息,發病機理,分子流行病學及基因工程疫苗的研究奠定基礎。
1 材料與方法
1.1 細胞與病毒 錦鯉皰疹病毒中國吉林株(KHV-CJ株)由吉林農業大學動物生產及產品質量安全教育部重點實驗室分離保存[12];錦鯉皰疹病毒尾鰭原代細胞由吉林農業大學動物生產及產品質量安全教育部重點實驗室繁殖保存。
1.2 菌株與載體 pMD18-T載體購自大連寶生物工程有限公司,E.coli DH5α,北京全式金生物技術有限公司。
1.3 主要試劑 新生牛血清(批號1076962)、M199培養基(批號 1098911),GBICO公司;Ex Taq DNA聚合酶、限制性內切酶Bam HⅠ和Eco RⅠ、10×ExBuffer(批號 AA7701A)、dNTP Mix(批號BG8601A)、DNA Marker,大連寶生物工程有限公司;DNA膠回收試劑盒(批號I8110),天跟生化有限公司;質粒小提試劑盒(批號20100916),北京索來寶科技有限公司。
1.4 引物的設計及合成 根據GenBank上登錄的錦鯉皰疹病毒 ORF124基因序列,利用 Primer Premier 5.0軟件設計1對引物,P1:5'-GAATTCATGGGACCTTTGACCATCTA -3',P2:5'-GGATCCTCACTTGAGCTCGCC -3',分別引入 Eco RⅠ和Bam HⅠ限制性酶切位點(劃線部位),由上海生工生物工程技術服務有限公司合成。
1.5 KHV-CJ株ORF124基因的 PCR擴增 按照 Hasegawa[13]和 Neukirch[14]的方法培養細胞。將實驗室保存的KHV-CJ株病毒液反復凍融三次后,取1 mL與MFC細胞單層在22℃的條件下共培養。逐日觀察細胞病變情況,收集細胞病變達70%80%的細胞及上清液,用堿裂解法提取病毒DNA,用于PCR特異性擴增。采用25μL反應體系進行PCR,反應條件如下:95℃5 min;94℃40 s,59 ℃30 s,72 ℃1 min,35 個循環,72 ℃10 min,反應結束后4℃保存。
1.6 KHV-CJ株ORF124基因的克隆及鑒定 用凝膠回收試劑盒將目的片段純化回收后,與pMD18-T載體連接,轉化至DH5α感受態細胞,在含有氨芐青霉素的LB瓊脂平板上篩選單菌落,接種于含0.1 mg/mL氨芐青霉素的LB培養基中,200 r/min振蕩培養過夜,提取重組質粒,以Eco RⅠ和Bam HⅠ進行雙酶切鑒定陽性重組質粒。篩選出的陽性質粒送至上海生工生物工程技術服務有限公司測序。
1.7 KHV-CJ株ORF124基因編碼蛋白的生物信息學分析 利用DNAStar軟件翻譯出ORF25基因的核苷酸序列;利用 SingalPv 3.0(http://www.cbs.dtu.dk/services/SignalP/)軟件進行氨基酸序列的信號肽分析;利用 TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)軟件進行跨膜區分析;利用 ProtScale(http://www.expasy.ch/tools/protscale.html)軟件分析蛋白的疏水性;利用BepiPred 1.0 Server(http://www.cbs.dtu.dk/services/BepiPred/)軟件和 DNAStar 6.0(Protean)對ORF124序列編碼的蛋白進行抗原表位分析;分別利用 NetNGlyc 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)和 YinOYang 1.2(http://www.cbs.dtu.dk/services/YinOYang/)在線分析軟件進行N-糖基化位點和O-糖基化位點預測,利用NetPhos 2.0(http://www.cbs.dtu.dk/services/Net-Phos/)進行磷酸化位點預測。
2 結果
2.1 ORF124基因的PCR擴增和鑒定 從細胞毒中提取KHV-CJ株總DNA后,經PCR擴增出一條與目的片段大小相符的DNA片段(見圖1)。將目的片段純化回收后,與pMD18-T載體連接,經氨芐青霉素抗性篩選后,將陽性重組質粒用限制性內切酶Eco RⅠ和,Bam HⅠ進行雙酶切,獲得一段約846 bp的片段(見圖2),說明ORF124基因片段已成功克隆至載體中。測序結果表明:KHV-CJ株與日本株、美國株、以色列株同源性均為99%,證明克隆出KHV-CJ株ORF124基因。

圖1 錦鯉皰疹病毒KHV-CJ株ORF124基因的PCR擴增
2.2 HV-CJ株ORF124基因的生物信息學分析
2.2.1 錦鯉皰疹病毒 KHV-CJ株 ORF124基因的序列結果和編碼蛋白質分子特征 測序結果表明,ORF124基因長846 bp,為一完整的開放閱讀框,編碼281個氨基酸,預測ORF124基因的理論分子質量為31221.96 Da,等電點為8.158,含有27 個強堿性氨基酸(K、R)、25個強酸性氨基酸(D、E)、93 個疏水氨基酸(A、I、L、F、W、V)、80 個極性氨基酸(N、C、Q、S、T、Y)。

圖2 KHV-CJ株ORF124基因的雙酶切鑒定
2.2.2 KHV-CJ株ORF124基因的信號肽分析
將測得的ORF124氨基酸序列在丹麥技術大學生物序列分析中心(CBS)的網站 http://www.cbs.dtu.dk/services/SignalP進行在線分析,通過Singal-Pv3.0進行信號肽切割位點的預測。結果顯示(圖3),信號肽切割部位最可能位于24位的T(蘇氨酸)和25位的V(纈氨酸)氨基酸之間。
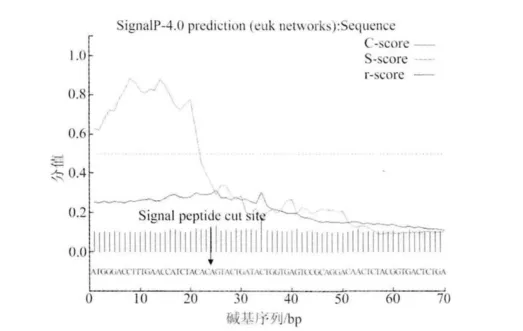
圖3 KHV-CJ株ORF124基因的信號肽預測
2.2.3 KHV-CJ株ORF124基因的跨膜區分析
TMHMM預測ORF124沒有跨膜區(圖4)。
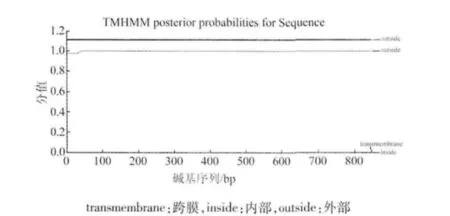
圖4 KHV-CJ株ORF124基因的跨膜區分析
2.2.4 KHV-CJ株ORF124基因的疏水性分析
通過ProtScale在線分析,ORF124基因的最大疏水指數為2.189,最小疏水指數為 -0.567,其疏水性分析結果(圖5)。

圖5 KHV-CJ株ORF124基因的疏水性分析
2.2.5 KHV-CJ株ORF124基因的抗原表位分析
用 http://www.cbs.dtu.dk/services/BepiPred/在線軟件及 DNAStar6.0(Protean)對錦鯉皰疹病毒ORF124基因編碼的蛋白進行抗原表位分析,得出其抗原表位主要集中在第9~26、43~58、67~73、98 ~112、130 ~165、237 ~253、260 ~294、303 ~361、494~514、571~599、804~833位氨基酸(見圖6)。表明該蛋白的表面抗原決定簇位點區域廣泛,峰值高。預示KHV-CJ株ORF124基因可作為基因工程疫苗的重要候選基因。

圖6 KHV-CJ株ORF124基因的抗原表位分析
2.2.6 KHV-CJ株ORF124糖基化及磷酸化位點的預測 分別通過NetNGlyc 1.0在線分析軟件和YinOYang 1.2在線分析軟件對 KHV-CJ株ORF124進行N-糖基化位點和O-糖基化位點預測。結果表明,其氨基酸序列不存在潛在的N-糖基化位點,11個潛在的O-糖基化位點。用NetPhos 2.0在線分析軟件對 KHV-CJ株ORF124基因進行磷酸化位點進行預測,結果顯示,當閾值取0.5時,其氨基酸存在7個潛在的磷酸化位點。
3 討論
錦鯉皰疹病毒病是由錦鯉皰疹病毒(Kio herpesvirus,KHV)引起的一種傳染性疾病,主要病癥是引起各生長階段鯉魚、框鏡鯉、錦鯉因爛鰓而窒息死亡,死亡率高80100%,疫情難以控制,已引起各國的高度關注。2002年開始在我國傳播[3],至今已遍布全國各地[5],需要進一步研究有效的疫苗,避免病毒的散播并消除病毒變異的可能,并填補目前國內沒有有效疫苗的空白,控制KHV在我國暴發流行。而本研究選用KHV-CJ株ORF124基因進行克隆和生物信息學分析,為進一步研制基因工程疫苗奠定基礎。
試驗成功獲得了長846 bp的ORF124基因,并使用Hidden Markov(HMM)模型對其信號肽進行預測。信號肽是引導翻譯出的前體蛋白通過細胞膜分泌到胞外的一段序列,只有切除信號肽序列后前體蛋白才能進入到分泌信號區,變成具有正常功能的成熟蛋白[15],因此預測信號肽切割位點,可以對進行表達研究的引物設計和真核及原核表達載體的構建提供有價值的信息。另外,信號肽負責不同類蛋白質的新生肽鏈的定位,信號肽的功能已不僅決定一個蛋白質是否是分泌蛋白,而且和蛋白質或其新生肽鏈在細胞內的全方位定位有關[16],對蛋白質信號肽的分析具有潛在的應用價值。用Net-Phos 2.0在線分析軟件對KHV-CJ株ORF124基因進行磷酸化位點進行預測顯示,當閾值取0.5時,其氨基酸存在7個潛在的磷酸化位點。蛋白質糖基化是一種重要的翻譯后修飾,約有一半以上的蛋白質發生了糖基化,越來越多的數據表明:糖基化作為一種主要的翻譯后修飾對蛋白質功能有著重要影響[17],并可提高蛋白基因組的多樣性[18],其中N-糖基化作用位點與抗原性和免疫原性有關[19]。
對錦鯉皰疹病毒ORF124基因編碼的蛋白進行抗原表位分析,表明該蛋白的表面抗原決定簇位于區域廣泛而集中,峰值高。免疫細胞通常難以借助其表面受體識別整個蛋白質抗原分子,而僅識別抗原肽分子上的一個特定部分即表位,又稱為抗原決定簇。因而表位代表了抗原分子上的一個免疫活性區,負責與抗體分子或免疫細胞表面的抗原受體結合,也是蛋白質抗原性的基礎,正確而詳細地繪制蛋白質表位圖譜,對定點改造蛋白質分子,設計疫苗分子結構及免疫干預治療等具有重要意義[20]。抗原表位分析表明:KHV-CJ株 ORF124基因優于 KHV - CJ 株 ORF81、ORF83[9,11],預示KHV-CJ株ORF124基因可作為基因工程疫苗的重要候選基因。
測序結果分析表明:KHV-CJ株ORF124基因與美國株、以色列株、日本株同源性均為99%,僅差一個堿基,但與美國株、以色列株表達氨基酸相同,與日本株不同。分別比對 KHV-CJ株 ORF81、ORF25、ORF83、ORF124 四個基因[9-11],進化樹同源性上分析結果一致,進一步說明KHV-CJ株與歐美國家傳播的KHV具有同源性。
試驗選用KHV的膜糖蛋白基因-ORF124基因作為目的基因,以在我國分離到的錦鯉皰疹病毒中國吉林株的DNA作為模板,成功將其克隆,并采用生物信息學方法對其結構和功能進行了分析,為我國錦鯉皰疹病毒的基因背景信息、發病機理、分子流行病學及基因工程疫苗的研究奠定了基礎。
[1] Hedrick R P,Gilad O,Yun S,et al.A herpesvirus associated with massmortality of juvenile and adult koi,a strain of common carp[J].JAquat Anim Health,2000,12(1):44 - 57.
[2] 劉 葒,史秀杰,高隆英,等.進口錦鯉暴發病病原的nested-PCR 鑒定[J].華中農業大學學報,2002,21(5):414-418.
[3] Pikarsky E,Ronen A,Abramowitz J,et al.Pathogenesis of acute viral disease induced in fish by carp in-terstitial nephritis and gill necrosis virus[J].JVirol,2004,78:9544 -9551.
[4] Aoki T,HironoI,Kurokawa K,et al.Genome sequences of three koi herpesvirus isolates representing the expanding distribution of anemerging disease threatening koi and common carp world wide[J].JVirol,2007,81:5058 -5065.
[5] 朱 霞,王 好,周井祥,等.錦鯉皰疹病毒病的研究進展[J].中國獸醫科學,2011,41(1):106 -110.
[6] 李新偉,周井祥,朱 霞,等.錦鯉皰疹病毒-CJ株ORF83基因的克隆及生物信息學分析[J].中國獸醫科學,2011,41(10):1016-1020.
[7] 周井祥,李新偉,朱 霞,等.錦鯉皰疹病毒-CJ株ORF25基因的克隆及生物信息學分析[J].中國獸藥雜志,2012,46(3):1-4.
[8] 周井祥,李新偉,王 好,等.錦鯉皰疹病毒-CJ株ORF81基因的克隆及生物信息學分析[J].水產學報,2011,35(12):1780-1786.
[9] Agus Sunarto,Clifford Liongue,Kenneth A McColl,et al.Koi herpesvirus encodes and expresses a functional interleukin-10[J].JVirol,2012,86(21):11512 - 11520.
[10] Takashi Aoki,Tomokazu Takano,Sasimnanas Unajak,et al.Generation of monoclonal antibodies specific for ORF68 of koi herpesvirus[J].Comparative Immunology,Microbiology and Infectious Diseases,2010,11:1 -8.
[11] Murwantoko,Dewi Nur’aeni Setyowati,Rarastoeti Pratiwi,et al.Cloning and expression of ORF124 koi herpesvirus as a vaccine[J].Indonesian Journal of Biotechnology,2012,17(1):42 -50.
[12]朱 霞,王 好,周井祥,等.一株錦鯉皰疹病毒的分離與鑒定[J].中國預防獸醫學報,2011,33(5):340 -343.
[13] Hasegawa S,Somamoto T,Nakayasu C,et al.A cell line(CFK)from fin of isogeneic ginbuna crusian carp[J].Fish Pathol,1997,32:127-128.
[14] Neukirch M,Bottcher K,Bunnajirakul S,et al.Isolation of a virus from koiwith altered gills[J].Bull Eur Assoc Fish Pathol,1999,19:221-224.
[15] Schult Z U,Kock J,Schlich T H J,et al.Recombinant duck interferon:a new reagent to study the mode of interferon action against H epatitis B virus[J].Virology,1995,212(2):641 -649.
[16]韋 雪,芳 王,冬 梅,等.信號肽及其在蛋白質表達中的作用[J].生物技術通報,2006,6:38 -42
[17] Haagglund P,BunKenborg J,Elortza F,et al.A new strategy for identification of N-glycosylated proteins and unambiguous assignment of their glycosylation sitesusing HILIC enrichmentand partial deglycosylation[J].JProteome Res,2004,3(3):556.
[18] Weerapana E,Imperiali B.Asparagin e linked protein glycosylation:from eu karyotic to prokaryotic systems[J].G ycobology,2006,16(6):91R -101R.
[19] Gunn P,Sato F,Powell K,et al.Rotavirus neutralizing protein VP7:antigenic det-erminants investigated by sequence analysis and peptide synthesis[J].JVirol,1985,54(3):791 -797.
[20]李海俠,毛旭虎.蛋白質抗原表位研究進展[J].微生物學免疫學進展,2007,35(1):54 -58.

