胃癌細胞系SGC-7901腫瘤干細胞樣細胞的分離和鑒定
許揚梅,龔福生,陳雪芳,鄭秋紅
近年研究表明,腫瘤是一種干細胞疾病,在多種實體瘤及其衍生腫瘤細胞系中已經發現了腫瘤干細胞的存在,胃癌干細胞的研究雖進展緩慢但逐漸受到重視[1]。Li和She等運用Side Population(SP)法證明了不同胃癌細胞系中SP細胞的干細胞特性[2-3]。Chen等發現CD44陽性胃癌細胞具有干細胞特性[4]。Jiang等發現CD90胃癌細胞能形成懸浮細胞球,有成瘤能力,并對靶向藥物曲妥珠單抗敏感[5]。Liu發現胃癌懸浮細胞球具有腫瘤干細胞特征[6]。上述研究提示胃癌干細胞的存在。本實驗采用懸浮細胞法和SP 2種方法來證明胃癌干細胞特性,并采用基因芯片技術篩選胃癌干細胞相關標志物,3種方法相互支持、驗證,為胃癌干細胞的研究提供依據。
1 材料與方法
1.1 材料
1.1.1 試劑 1640培養基及B27(美國Gibico公司)、10%胎牛血清(FBS)、DMEM/F12培養基(美國Hyclone公司),堿性成纖維細胞生長因子(bFGF,美國Peprotech公司)、表皮生長因子(EGF,美國Peprotech公司),胰島素及胰酶(美國Sigma公司),瓊脂粉(北京邦定生物公司),RFQ-PCR實驗試劑E.Coli polyA polymerase(NEB)、M-MLV Reverse Transcriptase(美國Promega公司),SYBR?Premix Ex TaqTMII(日本Takara公司),華聯表達譜基因芯片(上海康成生物工程)。
1.1.2 動物 雌性NOD/SCID鼠[上海實驗動物中心,許可證號SYXK(閩)2008-0001],鼠齡4~5周,體質量20~23g,自由飲食。
1.1.3 細胞株和細胞培養 人胃癌細胞系SGC-7901(上海細胞所)復蘇后用含10%的小牛血清1640培養基培養,3d換液1次,在37℃、體積分數為0.05的CO2培養箱中培養。細胞達80%融合時以0.25%胰酶消化、傳代。按照bFGF 10ng/mL、EGF 20ng/mL、B27 10μL/mL和胰島素5μg/mL的劑量,將各種生長因子加入到經過濾除菌的DMEM/F12培養基中配成無血清培養基。胰酶消化的單細胞離心洗滌,重懸于無血清培養基進行懸浮細胞球的培養。
1.2 方法
1.2.1 流式細胞術檢測SP側群細胞 取對數生長期的貼壁細胞和懸浮細胞球,分別制備成濃度為1×106mL-1的單細胞懸液,實驗組加入5μg/mL的熒光染料 Hoechst33342,對照組5μg/mL加入Hoechst33342和 50μmol/L維拉帕米(Verapamil),置于37℃水浴鍋孵育90min,每隔30min震蕩混勻1次。1 200r/min低速離心,棄上清,2mL PBS重懸,400目篩網過濾,檢測前加碘化丙啶染色標記死亡細胞。采用Moflo XDP高端流式細胞儀,紫外激發光檢測。Hoechst33342陰性或弱陽性為SP 細 胞,Hoechst33342 陽 性 為 Non-SP(NSP)細胞。
1.2.2 懸浮細胞球自我更新能力 以貼壁細胞作為對照組,用0.25%胰酶分別消化懸浮細胞球和貼SGC-7901細胞成單個細胞,臺盼藍染色作活細胞記數后,用無血清培養基分別稀釋瘤細胞懸液至103mL-1。混勻后,用移液槍將兩種細胞懸液分別轉移到96孔板內,每組各20孔,每孔100μL即平均每孔含100個細胞。每孔分別再添加100μL的無血清培養基,靜置培養。每隔2d添加25μL培養基,7d后記數每孔形成細胞球數。
1.2.3 NOD/SCID鼠皮下成瘤實驗 0.25%胰酶消化處于對數生長期的貼壁細胞和懸浮細胞球,臺盼藍染色作活細胞記數。離心后重懸于生理鹽水中并計數,配成濃度為5×102,5×103,5×104,5×105mL-1的細胞懸液。同一批次購買的NOD/SCID鼠20只,每1個細胞濃度注射5只,在其左右腋窩皮下分別注射貼壁細胞和懸浮細胞懸液各0.2mL。觀察小鼠的生活狀況及局部腫瘤生長情況。6周后頸部脫臼處死,解剖并觀察腫瘤的數目和大小。10%福爾馬林固定腫瘤塊24h。石蠟包埋,常規切片并H-E染色。
1.2.4 基因芯片檢測 懸浮球和貼壁細胞分別提取總RNA,質檢合格的RNA按華聯表達譜基因芯片操作要求進行標本預雜交、探針標記、雜交和洗片。用ScanArray 4000掃描儀掃描圖像,GenePix-Pro 3.0圖像軟件進行處理,數據按篩選標準進行均一化處理,計算出各基因點貼壁細胞與懸浮細胞球的差異表達Ratio值=cy5cy3,以Ratio<0.5為表達下調,0.5~2.0為非差異表達,>2.0為表達上調。
1.2.5 實時熒光定量PCR分析 將質檢合格的貼壁細胞和懸浮細胞球總RNA分別逆轉錄合成cDNA,再將兩樣品的目的基因以及管家基因進行擴增,其產物進行梯度稀釋作標準曲線,后將標準曲線樣品和待測樣品加入到含SYBR Green熒光染料反應體系中,在 Rotor-Gene 3000Real-time PCR儀上進行實時定量擴增。檢測結果用管家基因進行校正。引物序列和反應溫度見表1。

表1 引物序列和反應溫度Tab 1 Primer sequence and annealing temperature
1.3 統計學處理 計量資料采用±s表示,SPSS 11.5統計軟件處理數據。P<0.05為差別具有統計學意義。
2 結 果
2.1 無血清培養基培養胃癌SGC-7901細胞SGC-7901細胞用無血清培養基培養7d后,大部分細胞死亡,小部分細胞繼續貼壁生長,(8.00±0.54)%的單個細胞可以懸浮生長并增殖形成細胞球(圖1)。
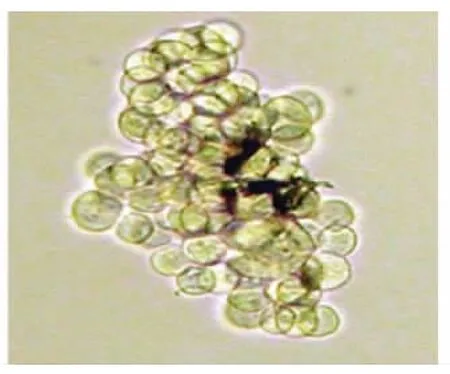
圖1 單個細胞形成的懸浮細胞球(SP ×400)Fig 1 A floating sphere formed from a single(SP ×400)
2.2 SP側群細胞檢測 流式細胞儀檢測結果顯示染料Hoechst33342加拮抗劑Verapamil組SP細胞含量明顯下降,細胞外排染料的能力被Verapamil阻滯。懸浮細胞球中SP細胞占(12.34±1.01)%,而貼壁細胞中SP占(0.62±0.05)%,即懸浮球比貼壁細胞富集SP細胞(圖2)。
2.3 懸浮球細胞自我更新 100個貼壁細胞在無血清培養基中可形成(9.75±1.85)個細胞球,而100個懸浮細胞球細胞形成的細胞球數則是(31.42±6.13),明顯多于貼壁細胞組,差別有統計學意義(P<0.05)。
2.4 NOD/SCID小鼠成瘤實驗 懸浮細胞球組在1×103個細胞的注射劑量能使3只小鼠致瘤,而貼壁細胞不能致瘤。在1×105個細胞的注射劑量時,懸浮細胞球組能使5只小鼠全部致瘤,而貼壁細胞只能使2只小鼠致瘤。懸浮細胞球比貼壁細胞具有更強的腫瘤形成能力(表2)。

表2 NOD/SCID鼠成瘤情況Tab 2 NOD/SCID mice tumor formation
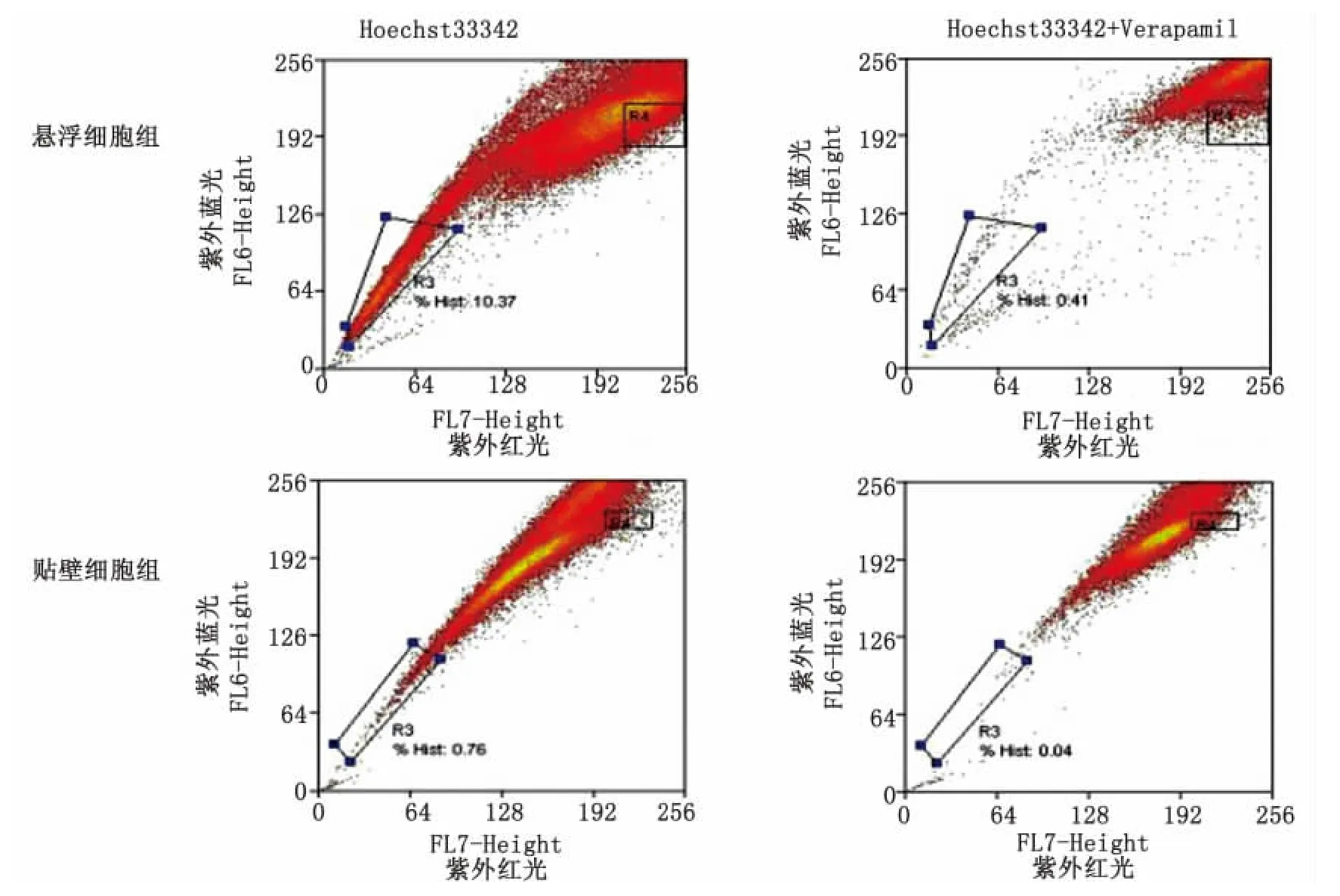
圖2 懸浮細胞球與貼壁細胞組SP含量檢測Fig 2 SP test by flow cytometry
2.5 H-E染色結果 貼壁細胞和懸浮細胞球在NOD/SCID鼠形成的腫瘤其形態學無明顯差異,兩者都可見形態異常的腫瘤細胞,核大、深染,可見病理性核分裂相。腫瘤分化程度底,但仍可見少許腺體結構(圖3)。
2.6 基因芯片檢測結果 本實驗使用的全人類基因組芯片共包含30 968個基因探針。結果顯示:懸浮細胞球組表達上調2倍以上的基因共有358個,但是已知基因只有297個(圖4)。運用David生物信息學系統分析,發現這297個基因大部分與代謝過程、蛋白黏附以及細胞器等有關。懸浮細胞球高表達3個干細胞相關基因,分別是ABCG2、HES1和KRT15(表3)。
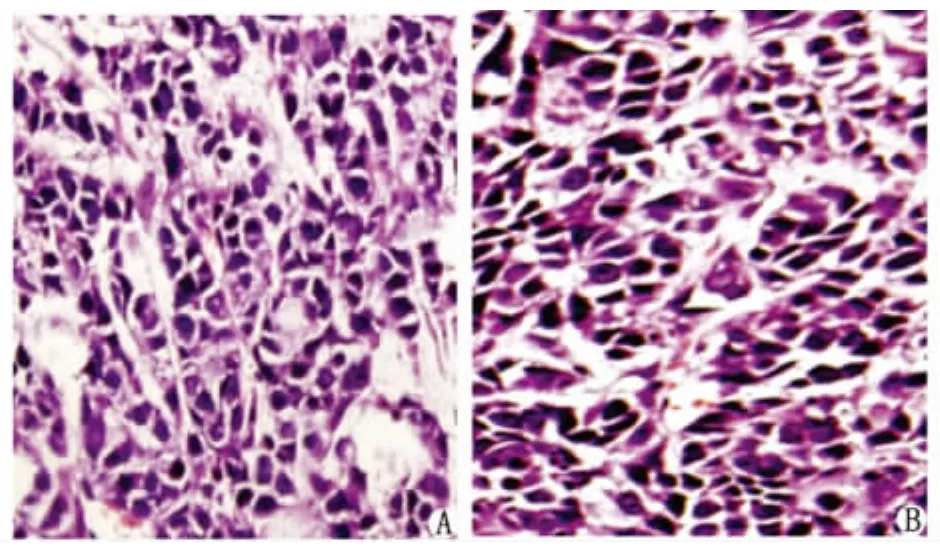
圖3 NOD/SCID鼠腫瘤標本H-E染色(SP ×400)Fig 3 H-E staining of tumor formed in NOD/SCID mice(SP ×400)

表3 懸浮細胞球組表達上調2倍以上的干細胞相關基因Tab 3 Up-regulated genes in floating spheres
2.7 實時熒光定量PCR檢測結果 在基因芯片檢測結果的基礎上,挑選出ABCG2、HES1、KRT15和CD44共4個基因進行實時熒光定量PCR檢測。采用實時熒光定量PCR相對定量法,最終得到的是樣品待測基因的相對含量(表4)。結果可見ABCG2、HES1、KRT15在懸浮細胞球中高表達,CD44表達無差異。實時熒光定量PCR與基因芯片結果基本一致。

圖4 懸浮球與貼壁細胞基因表達相關性散點圖Fig 4 Scatter picture of log2(fluorescence signal)of floating spheres and adherent cells

表4 實時熒光定量PCR檢測結果Tab 4 RFQ-PCR data
3 討 論
運用特定的細胞表面標志物和懸浮細胞球培養法,許多學者已經證明了胃癌干細胞的存在[1-6]。但其來源還有待進一步的研究證實。研究提示,胃癌干細胞可能來源于胃干細胞或是骨髓干細胞[1]。本實驗運用無血清培養基體外懸浮法和SP側群細胞2種方法在胃癌細胞系SGC-7901證明了具有胃癌干細胞特性的細胞,因沒有證明其全能性和多向分化能力,故稱為胃癌干細胞樣細胞。無血清培養基體外懸浮法是腫瘤干細胞培養的主要方法,應用在神經、乳腺等多種干細胞和相應的腫瘤干細胞的培養。在胃癌干細胞的培養中也是常用的方法。本實驗中,(8.00±0.54)%的SGC-7901細胞能形成懸浮細胞球,為了證明懸浮細胞球細胞是否具有腫瘤干細胞的特性,進而檢測懸浮細胞球中SP細胞的含量。
SP細胞被認為是具有腫瘤干細胞特性的細胞,在多種腫瘤中已經證實SP細胞的存在。但是不同的學者對于SP細胞的干細胞特性意見不同。Zhang研究結果表明并不是所有的胃腸道腫瘤的SP細胞都富集干細胞[7]。SP法的原理依賴細胞膜表面ABC轉運子蛋白將染料泵出細胞外,所以保持恒定的細胞生理功能至關重要。細微的實驗條件改變會引起細胞生理功能的改變,包括孵育時間、震蕩間隔、實驗細胞的培養天數和染料的濃度等均會影響SP含量,這可能是導致實驗結果不一致的原因之一[8]。在嚴謹的實驗條件下,結果顯示懸浮細胞球SP含量遠高于貼壁細胞組。
利用細胞膜表面標記物來分離和鑒定腫瘤干細胞是一個重要的研究方法。為尋找可以作為胃癌干細胞的標記物,本實驗利用基因芯片技術檢測懸浮和貼壁細胞的基因表達譜,尋找差異表達基因。實驗結果經實時熒光定量PCR檢測驗證,發現懸浮細胞高表達干細胞相關的基因ABCG2、HES1和KRT153。其中只有ABCG2是膜表面蛋白,屬于ABC(ATP Binding Cassette)超家族成員,是一種多藥耐藥相關的膜轉運蛋白。ABCG2/BCRP1具有將Hoechst33342泵出細胞外的特性,SP表型與ABCG2有關。She和Jiang等的研究認為在胃癌中ABCG2與細胞分化、化療抵抗有關,具有干細胞特性[3,9]。懸浮細胞球具有干細胞的特性,而且懸浮細胞球又富含SP細胞,兩者都高表達ABCG2,因此筆者認為ABCG2可以作為胃癌干細胞的潛在標志之一。CD44是胃癌干細胞的標志,但在本實驗中表達沒有差異。采用流式細胞儀檢測懸浮細胞球和貼壁細胞CD44的表達,發現CD44表達都>90%。筆者認為,這種情況與SGC-7901細胞系本身的特性相關,說明該細胞系具有高轉移潛能,并不能否定CD44作為胃癌干細胞標志的可能性。
本研究發現懸浮細胞球富集SP細胞,自我更新能力強,具有高致瘤性且高表達干細胞相關標志,從而證明了SGC-7901中胃癌干細胞樣細胞的存在。但是不足之處在于采用的是細胞系而非腫瘤組織。在后續實驗中,擬采用胃癌組織標本進行懸浮培養以及干細胞標志物ABCG2和CD44等的檢測,希望可以為胃癌干細胞的研究提供參考依據。
:
[1] Han M E,Oh S O.Gastric stem cells and gastric cancer stem cells[J].AnatCellBiol,2013,46(1):8-18.
[2] Li R,Wu X,Wei H,etal.Characterization of side population cells isolated from the gastric cancer cell line SGC-7901[J].OncolLett,2013,5(3):877-883.
[3] She J J,Zhang P G,Wang X,etal.Side population cells isolated from KATO III human gastric cancer cell line have cancer stem cell-like characteristics[J].WorldJGastroenterol,2012,18(33):4610-4617.
[4] Chen T,Yang K,Yu J,etal.Identification and expansion of cancer stem cells in tumor tissues and peripheral blood derived from gastric adenocarcinoma patients[J].CellRes,2012,22:248-258.
[5] Jiang J,Zhang Y,Chuai S,etal.Trastuzumab(herceptin)targets gastric cancer stem cells characterized by CD90phenotype[J].Oncogene,2012,31:671-682.
[6] Liu J,Ma L,Xu J,etal.Spheroid body-forming cells in the human gastric cancer cell line MKN-45possess cancer stem cell properties[J].IntJOncol,2013,42(2):453-459.
[7] Zhang H,Xi H,Cai A,etal.Not all side population cells contain cancer stem-like cells in human gastric cancer cell lines[J].DigDisSci,2013,58(1):132-139.
[8] Mo S L,Li J,Loh Y S,etal.Factors influencing the abundance of the side population in a human myeloma cell line[J].BoneMarrowRes,2011,52:2148-2157.
[9] Jiang Y,He Y,Li H,etal.Expressions of putative cancer stem cell markers ABCB1,ABCG2,and CD133are correlated with the degree of differentiation of gastric cancer[J].Gastric Cancer,2012,15(4):440-450.

