葫蘆[7]脲的合成及其與甲基橙的超分子行為研究
——綜合性研究型實驗設計
張海波 龔林波 夏春蘭 丁瓊
(武漢大學化學與分子科學學院 湖北武漢 430072)
葫蘆脲(cucurbit[n]uril,n=5~10,縮寫CB[n]),是超分子化學中繼冠醚(crown ether)、穴醚(cryptands)、杯芳烴(calixarene)、環糊精(cyclodextrin)之后發展起來的一類新型高度對稱的籠狀大環主體分子化合物[1],具有疏水的內部空腔及由環繞的羰基氧原子組成的端口。這些結構特征使它能夠通過疏水作用、氫鍵、離子-偶極等鍵合作用鍵合多種有機陽離子,通過與金屬配位形成金屬配合物。隨著超分子化學的興起,葫蘆脲以其特有的結構特性和廣闊的應用前景,越來越受到主客體化學、自組裝超分子化學、環境化學、催化、材料化學、生物化學等學科研究者的關注。特別是進入到21世紀,這一領域呈現蓬勃發展的趨勢[2]。本文介紹的實驗可作為本科生綜合實驗,使學生較早地接觸前沿科學,更好地了解超分子化學的發展方向,有利于高素質人才的培養。
1 實驗目的
(1) 了解葫蘆脲及其在超分子化學中的應用。
(2) 熟悉葫蘆脲的制備方法和同系物的分離方法。
(3) 熟悉葫蘆脲的超分子行為及常用研究手段。
2 實驗原理
葫蘆脲的最重要性質是其端口和空腔具有負靜電勢能。首先,葫蘆脲兩端分別分布著與其結構單元數相同的羰基基團,這些羰基基團對電荷稠密的金屬陽離子來說是優良的σ給體;同時,羰基鍵的高極性也對鍵合有利;而對電荷稠密的金屬陽離子來說,它本身是優良的σ接受體。因此,葫蘆脲對多種有機陽離子、金屬離子具有選擇性包結配位能力[3]。其次,葫蘆脲的環壁上含有4倍于其結構單元數的N,它們環繞所形成的空腔是疏水性的,可以包結有機分子、氣體分子和其他客體小分子。再次,其羰基O和N都有可能形成氫鍵,可與存在的金屬離子相互作用,形成自組裝的分子膠囊或主-客體實體。
合成分離原理是:首先,由乙二醛和尿素合成甘脲并分離純化,然后由自制甘脲與多聚甲醛反應,制備葫蘆[5~8]脲同系物的混合產物,再利用葫蘆[5~8]脲同系物的性質差別進行分離純化,得到CB[5],CB[6],CB[7]和CB[8]。圖1給出了甘脲和葫蘆脲的合成示意圖。

圖1 甘脲和葫蘆脲的合成示意圖
本實驗內容設計為兩部分:① 葫蘆脲的合成和分離;② 中性水體系中甲基橙與葫蘆[7]脲的超分子作用。
3 實驗儀器及藥品
藥品:乙二醛(40%水溶液),尿素(分析純),多聚甲醛(化學純),鹽酸(36%),丙酮(分析純),甲基橙(分析純)。
儀器:500mL圓底燒瓶,10mL容量瓶,磁力攪拌器,恒壓滴液漏斗,球型回流冷凝管,旋轉蒸發儀,恒溫槽,循環水多用真空泵,電熱真空干燥箱,超聲波清洗器,UV-2010型紫外可見分光光度計(UV),紅外光譜儀(IR),Varian Mercury VX-300M型核磁共振儀。
4 實驗過程
4.1 甘脲的合成
將120.00g尿素溶于300mL水中,滴加濃硫酸調節pH至1~2,攪拌下升溫至75℃,用滴液漏斗向其中緩慢滴加92mL 40%乙二醛水溶液,約1h滴完。升溫至80℃繼續反應約8h。冷卻至室溫,過濾,分別用大量去離子水、丙酮洗滌固體,真空干燥24h, 得白色粉末狀固體107.58g,收率為94.7%。IR(KBr):3203cm-1(s,NH),2848cm-1(s,CH),1732 cm-1(s,CO)。與甘脲標準圖譜一致。
4.2 葫蘆[5~8]脲的合成及葫蘆[6~8]脲分離與純化
稱取28.40g甘脲,加入150mL濃鹽酸,攪拌使甘脲完全溶解。在室溫攪拌下加入12.00g多聚甲醛粉末,數分鐘后得到膠狀溶液。緩慢升溫至100℃,一段時間后膠狀固體溶解,得棕紅色溶液。12h后反應完全,停止反應。冷卻至室溫,盡量蒸除HCl后減壓濃縮,然后分次加入大量丙酮直至沉淀不再增多為止,所得沉淀為固體a。固體a用大量水洗至固體不再溶解減少,所得洗滌液c中分次加入大量丙酮析出固體d,而洗滌后所剩固體為固體b。
固體b中主要含CB[6]和CB[8]。用4mol/L HCl水溶液洗滌幾次,所剩固體為粗CB[8],洗滌液濃縮后加入大量丙酮析出沉淀,為粗CB[6]。粗CB[6]以濃鹽酸重結晶,真空干燥,得純CB[6]。
固體d中主要含CB[5]和CB[7]。用20mL的3mol/L HCl水溶液洗滌,所剩固體為粗CB[5]。洗滌液稍濃縮后加入丙酮析出沉淀,所得固體再用50%的甲醇水溶液反復洗滌幾次,可以得到純CB[7]。將CB[7]溶于稀硫酸中,在密閉容器中用丙酮小分子擴散的方法,可以得到純度更高的CB[7]。葫蘆脲的分離過程見圖2。

圖2 葫蘆脲同系物的分離示意圖
葫蘆脲同系物的分離一般都是利用CB[n]在不同溶液中溶解度的差異,采用多次溶解沉淀進行的。在將反應體系進行沉淀而與溶液分離之后,利用CB[6,8]和CB[5,7]在水中溶解度的差別可以實現兩者的分離。所得的CB[6,8]混合物可以用4mol/L HCl水溶液很好地分離,提取出來的CB[6]重結晶后純度較好;而CB[5,7]的分離在參考文獻[4]的基礎上經過反復實驗,最后選定使用以下方法:先用適量的3mol/L HCl水溶液洗滌CB[5,7],在洗滌液濃縮并沉淀后,再用50%的甲醇水溶液反復洗滌沉淀。合成分離純化示意圖如圖2所示。實驗證明,該方法可以得到較純的CB[7]。
4.3 葫蘆[7]脲與甲基橙的超分子行為研究
4.3.1 實驗方法

4.3.2 包結物的可見光譜
以水作參比液,用紫外分光光度計在300~600nm的波長范圍內測定葫蘆[7]脲與甲基橙形成的包結物的吸光度,其結果如圖3所示。
從圖3可以看出,在300~600nm的波長范圍內,吸光度的強度發生了明顯變化,在波長400nm處有最低吸光度,波長在515nm處顯示最大吸光度;包結物的形成可改變甲基橙吸光度的最低和最高位置,且包結物的吸收光譜與酸性或中性甲基橙的光譜的峰形也發生了改變,這說明有新物質生成;此外葫蘆[7]脲與甲基橙形成配合物時,甲基橙的結構發生了明顯改變。

圖3 不同pH下甲基橙(MO)和包結物(MO@CB[7])的紫外光譜
4.3.3 CB[7]與甲基橙形成的超分子的包結比和穩定常數

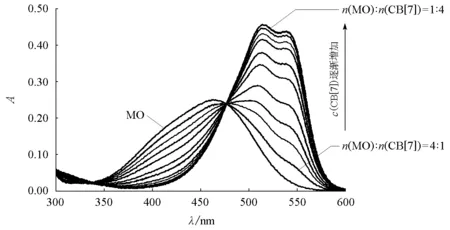
圖4 不同濃度的甲基橙和CB[7]的吸光度-吸收波長圖固定甲基橙濃度為1×10-5mol/L,CB[7]的濃度從2×10-6mol/L逐漸增至8×10-5mol/L

圖5 CB[7]與甲基橙作用體系的Job滴定曲線
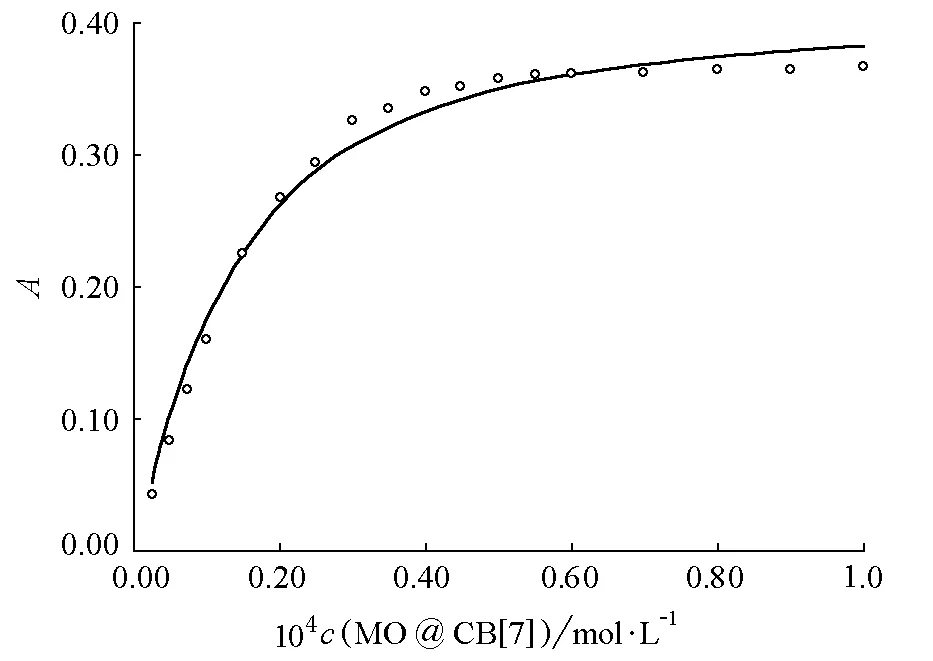
圖6 CB[7]與甲基橙形成的超分子的包結常數擬合曲線
5 思考和討論
(1) 何為葫蘆脲?葫蘆脲的同系物有哪些?它們的超分子行為有什么不同之處?
(2) 分離葫蘆脲同系物的原理是什么?
(3) 怎樣用紫外法確定葫蘆脲[7]和甲基橙的包結常數?
本實驗綜合了基礎化學和有機化學等實驗的原理和基本操作,可以培養學生初步掌握大環主體分子的合成、分離和純化的手段,并熟悉超分子化學的基本研究方法。
由于本實驗內容較為豐富,所用原料簡單易得,價格低廉,綠色環保,符合實驗教學發展的趨勢,適合不同類別學校和專業開設。在開設過程中,各校各專業可根據各自教學內容與實驗時數自行取舍。該綜合實驗反映了科學研究的新成果,可操作性強,有利于激發學生的創新能力,有利于培養學生的學習能力和實踐能力。實踐表明,這是一個值得推薦的綜合實驗項目。
參 考 文 獻
[1] Day A I,Arnold A P,Blanch R J,etal.JOrgChem,2001,66:8094
[2] 張桂玲,徐周慶,薛賽鳳,等.無機化學,2003(6):655
[3] Lagona J,Mukhopadhyay P,Chakrabarti S,etal.AngewChemIntEd,2005,44:4844
[4] 羅緒強,薛賽鳳,祝黔江,等.貴州大學學報(自然科學版),2003,20:184

