Mn(Ⅴ)的定性檢驗及試管實驗的條件優化
楊天鶴 亢立群 寇焜照 楊娟
(北京大學化學與分子工程學院 北京 100871)
錳(Mn)元素擁有豐富的電子價態,包括+2,+3,+4,+5,+6和+7價,不同價態通常對應不同顏色。其中,Mn(Ⅴ)最不穩定,容易發生迅速而完全的歧化,因此Mn(Ⅴ)的化合物在一般實驗室條件下很難制備。在大學普通化學實驗“氧化還原及元素性質:鉻、錳”中,對Mn(Ⅱ)、Mn(Ⅲ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)的生成、顏色及存在條件均有詳細描述,但卻沒有涉及Mn(Ⅴ)。為此,我們探討了在實驗室制備Mn(Ⅴ)的反應條件,提出了在試管實驗里迅速制備和檢驗Mn(Ⅴ)的方法,以幫助學生認識Mn的所有電子價態。
1 實驗原理
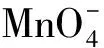
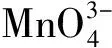

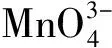
2 試劑及儀器
實驗中使用的試劑有:0.01mol/L KMnO4(aq),40%NaOH(aq),飽和Na2SO3(aq),0.5mol/L Na2SO3(aq),MnO2(s),冰,去離子水。
實驗中使用的儀器為:紫外可見吸收光譜儀(Shimadzu UV-2450)。
3 實驗步驟和現象
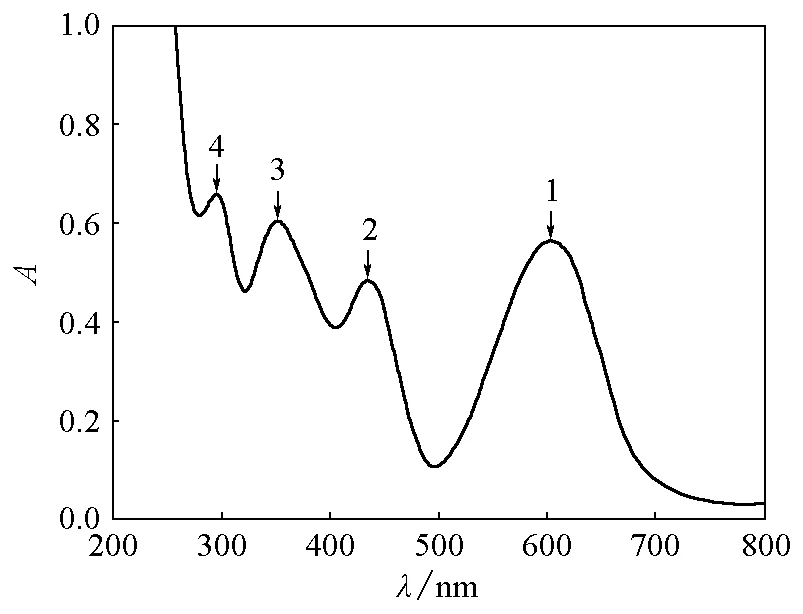
取5mL 0.01mol/L KMnO4置于燒杯中,加入15mL 40%NaOH,在冰水浴冷卻下緩慢滴加飽和Na2SO3溶液,溶液顏色變為綠色;繼續滴加直至溶液呈亮藍色。
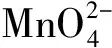
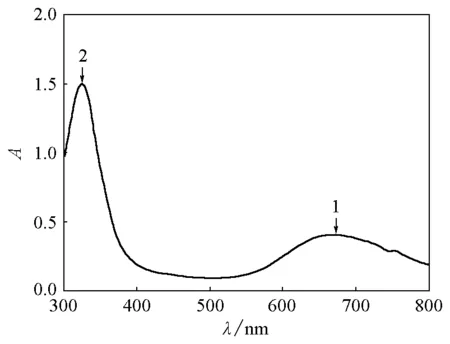
取1mL上述亮藍色溶液,置于離心管中,用1mL去離子水稀釋,產生棕色渾濁,溶液變為藍綠色。離心,取1mL上清液測定紫外可見吸收光譜。
3.4 逐滴反應后溶液的吸收光譜測定
取1滴0.01mol/L KMnO4滴入1mL 40%NaOH中,置于冰水浴中冷卻,逐滴加入0.01mol/L Na2SO3,每加入一滴后,觀察溶液顏色并測定其紫外可見吸收光譜。
4 光譜數據及討論
4.1 亮藍色溶液的吸收光譜
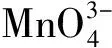
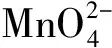
圖的紫外可見吸收光譜
圖的紫外可見吸收光譜
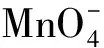
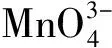
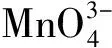
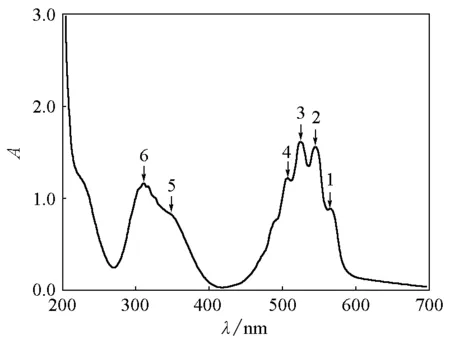
圖溶液的紫外可見吸收光譜

圖溶液稀釋后離心上清液的紫外可見吸收光譜
4.4 KMnO4溶液中加入Na2SO3溶液的吸收光譜


圖5 向溶液中逐滴加入溶液的紫外可見吸收光譜變化圖圖中數字為與譜圖對應的加入滴數;隨著的加入量增大,吸收峰位逐漸紅移。
5 優化的Mn(Ⅴ)試管實驗步驟
5.1 Mn(Ⅴ)制備

5.2 Mn(Ⅴ)檢驗

6 結論
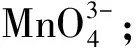
參 考 文 獻
[1] Holleman A F,Wiberg E.Inorganic Chemistry.34th ed.London:Academic Press,2001
[2] Sekula-Brzezińska K,Wrona P K,Galus Z.ElectrochimActa,1979,24:555
[3] 北京大學普通化學教研室.普通化學實驗.北京:北京大學出版社,1999
[4] Kingsley J D,Prener J S,Segall S.PhysRev,1965,137:A189

