還原半反應的相關熱力學計算湖北省教育廳重點科技
余高奇 陳陽 李鳳蓮
(武漢科技大學化學工程與技術學院 湖北武漢 430081)
還原半反應的相關熱力學計算湖北省教育廳重點科技
余高奇 陳陽 李鳳蓮
(武漢科技大學化學工程與技術學院 湖北武漢 430081)
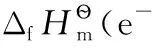
關鍵詞還原半反應 熱力學 電子的標準摩爾熵 熱力學“0”標準
研究項目(No.2002A01018);湖北省優秀青年人才科研計劃項目(No.2002B011004);武漢科技大學校教改項目(No.2007050X)
盡管還原半反應目前已經在氧化劑和還原劑相對強弱的比較、氧化還原反應進行方向的判斷和氧化還原反應進行程度的衡量等領域得到了應用[1-3],但它的熱力學研究仍略顯欠缺,主要表現在:(1) H+(298.15K,aq,∞)的標準摩爾生成焓、標準摩爾生成吉布斯自由能及標準摩爾熵均規定為0的理由探討不充分[4-6];(2) 離子的熱力學數據與單質或化合物的熱力學數據能否互相借用不明確[7-8];(3) 在還原半反應中,電子的角色及其對應的標準熱力學數據研究不深入[9-10]。本文針對上述問題,擬從不同角度探討還原半反應的熱力學規律。
1 水溶液中,熱力學“0”標準的選取
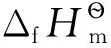
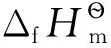
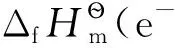

表1 質子及電子的標準熱力學數據(298.15K,100kPa)[11-12]
2 離子的熱力學數據與單質或化合物的熱力學數據互相借用
離子的熱力學數據與單質或化合物的熱力學數據可以互相借用。這一點可由298.15K、100kPa時,水合氯離子的標準摩爾生成焓、標準摩爾吉布斯自由能及標準摩爾熵數據的獲取說明。
設計原電池:
Pt∣Cl2(100kPa,g)∣Cl-(1.0mol·dm-3,aq)‖H+(1.0mol·dm-3,aq)∣H2(100kPa,g)∣Pt
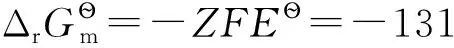
(2-1)
H2、Cl2是穩定單質,在298.15K時,它們的標準摩爾生成焓及標準摩爾吉布斯自由能均為0;同時298.15K時質子的標準摩爾生成焓和標準摩爾吉布斯自由能均為0,質子的標準摩爾熵也為0;另查熱力學數據表可得298.15K時H2、Cl2的標準摩爾熵數據。
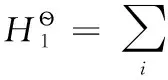
(2-2)
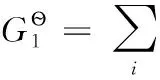
(2-3)
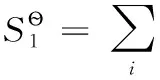
(2-4)
可以看出,離子的標準摩爾生成焓和標準摩爾生成吉布斯自由能數據是在承認穩定單質及質子的標準摩爾生成焓和標準摩爾生成吉布斯自由能均為0的前提下得到的;同時離子的標準摩爾熵是在認同穩定單質H2、Cl2的標準摩爾熵數據及質子的標準摩爾熵為0前提下所得。這些表明兩套熱力學數據可以互相借用。
3 還原半反應熱力學計算公式
還原半反應:aOx+ne-=bRed;熱力學計算時,電子可看成是一獨立反應物,地位與氧化型物質Ox和還原型物質Red完全相同,相應計算公式為:
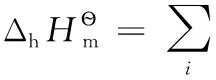
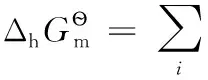
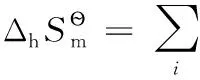
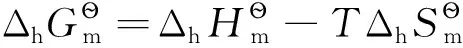
式中i代表氧化性物質Ox、電子及還原性物質Red中的任意一種。
4 不同類型電極的還原半反應計算實例
4.1 氧化還原電極之一
例:Fe3++e-=Fe2+,標準電極電勢為E?=0.769V,相關熱力學數據參見表2。
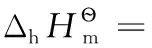
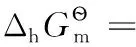
另:
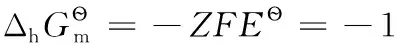
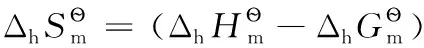
又因為
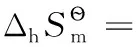
將有關數據代入得:
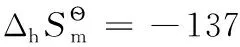
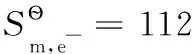
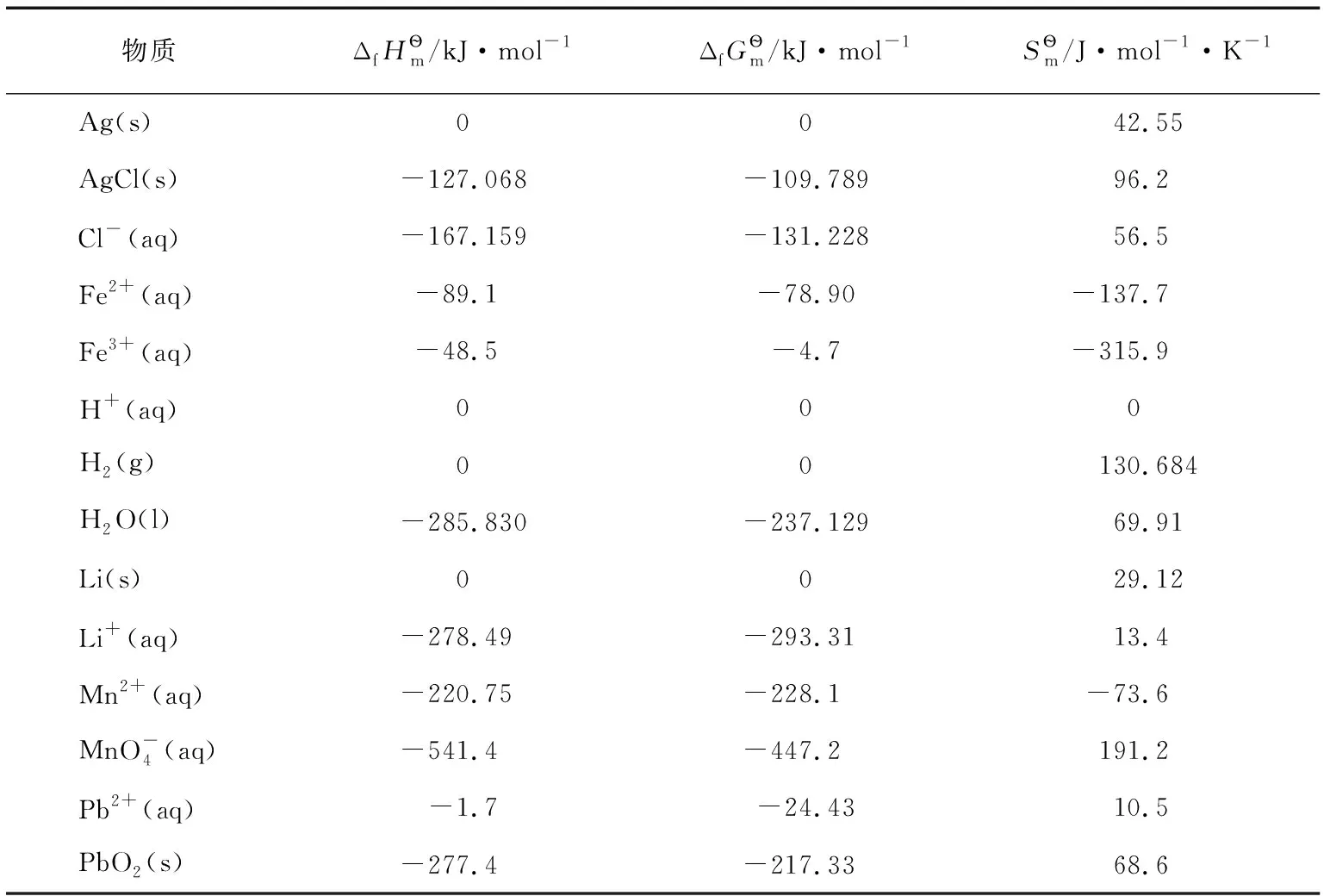
表2 一些物質的標準熱力學數據(298.15K,100kPa)[16-17]
4.2 氧化還原電極之二
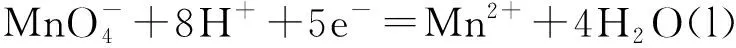
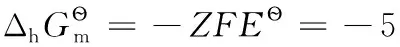
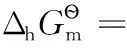
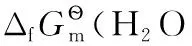
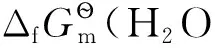
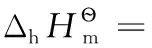
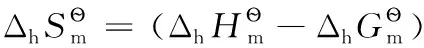
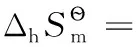
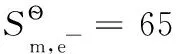
4.3 金屬電極
例:Li++e-=Li,標準電極電勢為E?=-3.040V,相關熱力學數據參見表2。
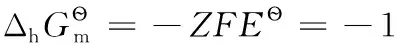
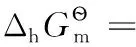
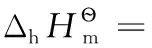
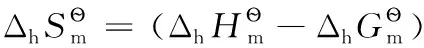
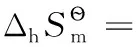
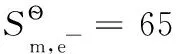
4.4 氣體電極
例:2H++2e-=H2,標準電極電勢為E?=0.000V,相關熱力學數據參見表2。
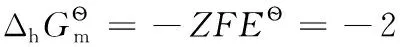
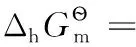
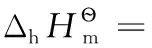
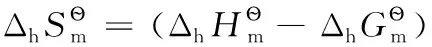
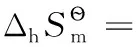
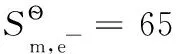
4.5 難溶氧化物電極
例:PbO2(s)+4H++2e-=Pb2++2H2O(l),標準電極電勢為E?=1.458V,相關熱力學數據參見表2。
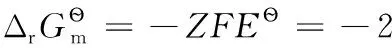
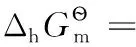
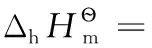
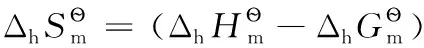
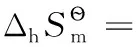
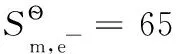
4.6 難溶鹽電極
例:AgCl(s)+e-=Ag(s)+Cl-,標準電極電勢為E?=0.2222V,相關熱力學數據參見表2。
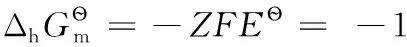
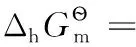
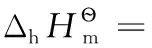
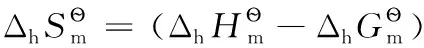
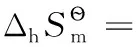
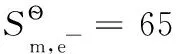
由上述還原半反應熱力學計算結果可得電子標準摩爾熵的平均值為:
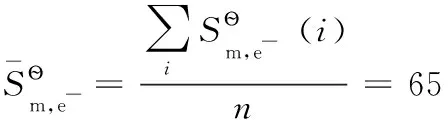
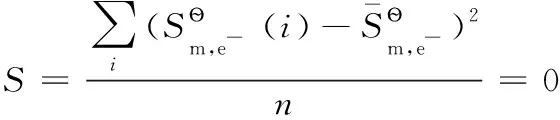
以上熱力學計算結果進一步證實:離子的熱力學數據與單質或化合物的熱力學數據可以互相借用;在298.15K及標態下,還原半反應中電子的標準摩爾生成焓、標準摩爾生成吉布斯函數變均為0,電子的標準摩爾熵近似為65.32J·mol-1·K-1,同時計算也表明了相關熱力學計算公式的正確性。
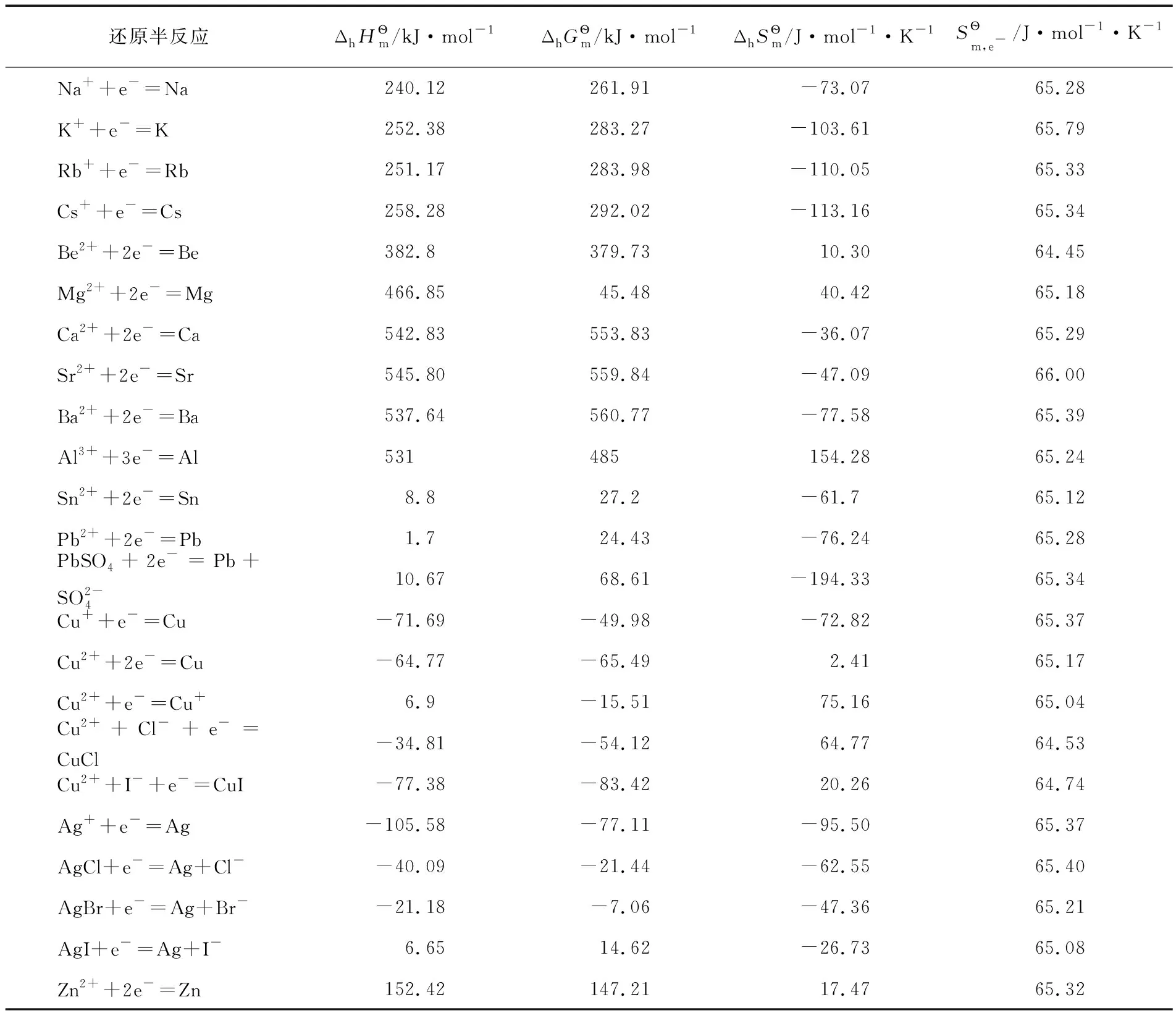
表3 還原半反應的標準摩爾焓變、標準摩爾吉布斯函數變、標準摩爾熵變及電子的標準摩爾熵
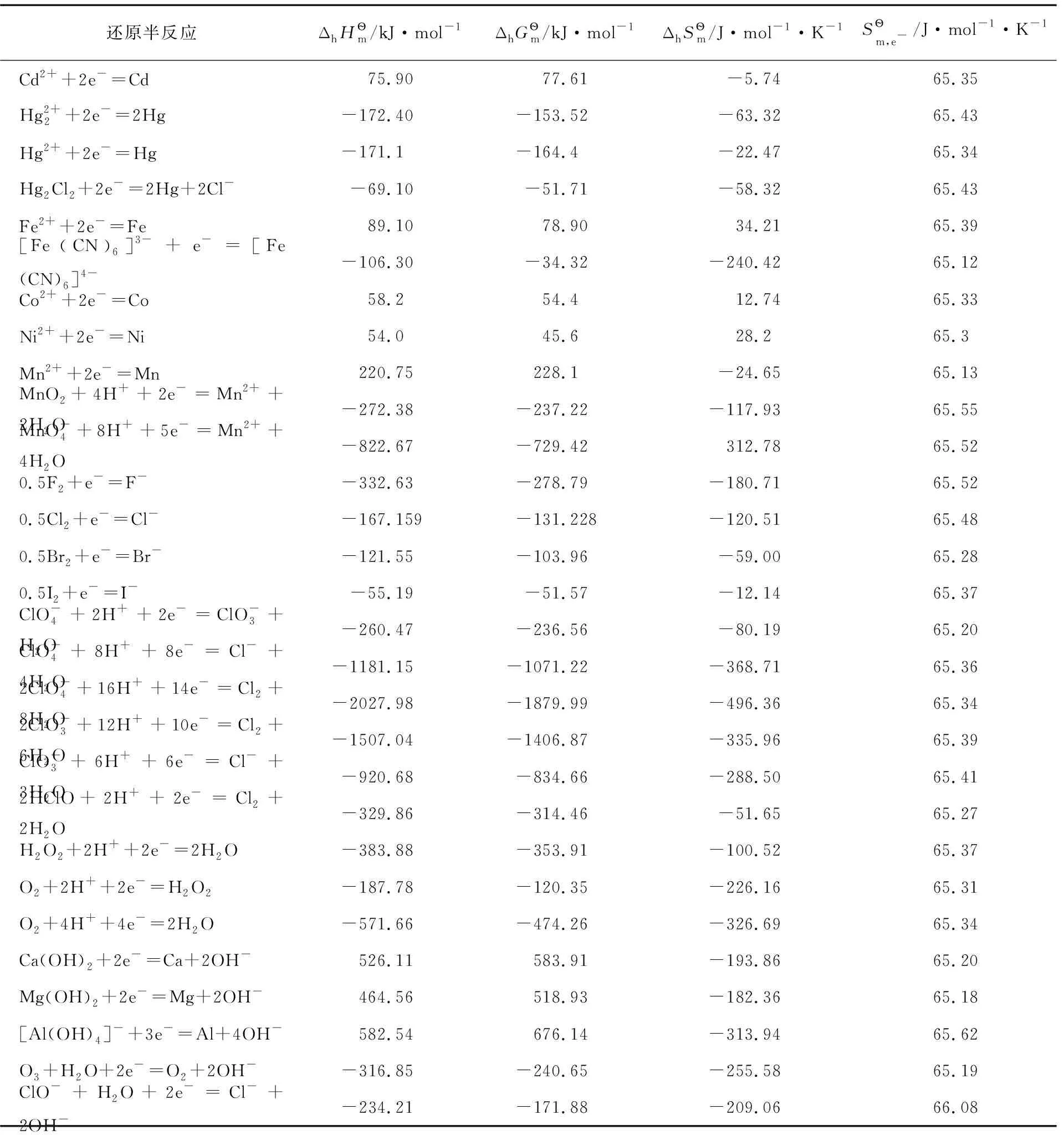
續表
5 結論
(2) 離子的熱力學數據與單質或化合物的熱力學數據可以互相借用。
(3) 還原半反應:aOx+ne-=bRed,相關熱力學計算公式為:
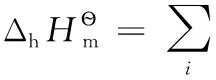
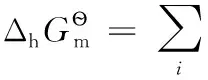
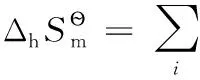
式中i代表氧化性物質Ox、電子及還原性物質Red中的任意一種。
參 考 文 獻
[1] Jamroziak K,Jargulinski W.ArchMaterSciEng,2010,41(1):21
[2] Carleton A C,George K S.JGeol,1947,55(1):43
[3] 惠永基.高等學校化學學報,1989,10(7):775
[4] Branko R,Reinhardt E P,Melita L M,etal.JPhysChemA,2004,108(45):9979
[5] Vanderzee C E,Wauch D H,Hass N C,etal.JChemThermodyn,1980,12(1):27
[6] 李建宇.大學化學,2001,16(3):55
[7] Marky L A,Breslauer K J.Biopolymers,1987,26(9):1601
[8] Zwolinski B J,Danti A.AnnuRevPhysChem,1961,12:325
[9] Robaszkiewicz S,Micnas R,Chao K A.PhysRevB,1981,23:1447
[10] Galam S,Hansen J P.PhysRevA,1976,14:816
[11] Némethy O,Scheraga H A.JChemPhy,1962,36(12):3401
[12] Redlich O,Kister A T.IndEngChe,1948,40(2):345
[13] 天津大學物理化學教研室.物理化學.第5版.北京:高等教育出版社,2009
[14] Bassett R L.GeochimCosmochimActa,1980,44(8):1151
[15] Noyes R M.JAmChemSoc,1962,84(4):513
[16] 梁英教,車蔭昌.無機物熱力學數據手冊.沈陽:東北大學出版社.1993
[17] 大連理工大學無機教研室.無機化學.第5版.北京:高等教育出版社,2006

