正交設計法優選芪參口服液提取工藝
王建舫,崔 昊,高會軍,姜代勛,董 虹,穆 祥
(1.北京農學院 獸醫學(中醫藥)北京市重點實驗室,北京 昌平 102206;2.石家莊華牧牧業有限責任公司獸藥分公司,河北 石家莊 050061)
芪參口服液是由傳統的中藥方劑四君子湯加減而來。方中黃芪益氣健脾為君藥;人參補中益氣為臣藥;白術苦溫,健脾燥濕為佐藥;甘草甘溫,益氣和中,調和諸藥為使藥。諸藥相合,共奏補中益氣、健脾胃之功效。前期的臨床研究證實,該制劑能夠增強雞的免疫能力。因此,為推動芪參口服液的臨床應用開發,本試驗根據處方中藥材有效成分的理化性質和藥理作用,選擇以干膏率和芪參口服液中主要藥效成分之一的黃芪甲苷提取量[1-6]為定量檢測指標,采用L9(34)正交試驗對藥物加水量、煎煮時間和煎煮次數加以考察,對芪參口服液的水提工藝進行了優化研究。
1 材料與方法
1.1 儀器 Waters2695高效液相色譜系統,Waters2424蒸發光檢測器,Empower工作站,日本YMC-Pack ODS-A色譜柱 (5μm,150mm×4.6 mm)。美國Millipore水純化系統,針筒式微孔濾膜過濾器(上海興亞凈化材料廠產品,孔徑0.45μm)。旋轉蒸發儀(上海亞榮生化儀器廠,RE-3000A)。電熱鼓風干燥箱(上海一恒科學儀器有限公司,DHG-9145A)。電子分析天平(Sartorius,CP423S)。
1.2 藥品與試劑 黃芪甲苷對照品(批號:110781-200613,購自中國藥品生物制品檢定所);乙腈(色譜純,天津市光復精細化工研究所)。黃芪產自甘肅省,人參產自吉林省,白術產自河北省,甘草產自內蒙古,以上4味藥材,均購自河北省安國市淤校中藥材棧。
1.3 正交試驗設計
1.3.1 因素水平的選擇 以加水量、煎煮時間和煎煮次數為考察因素,各取3個水平,進行L9(34)正交試驗。篩選最佳工藝條件,因素水平表見表1。
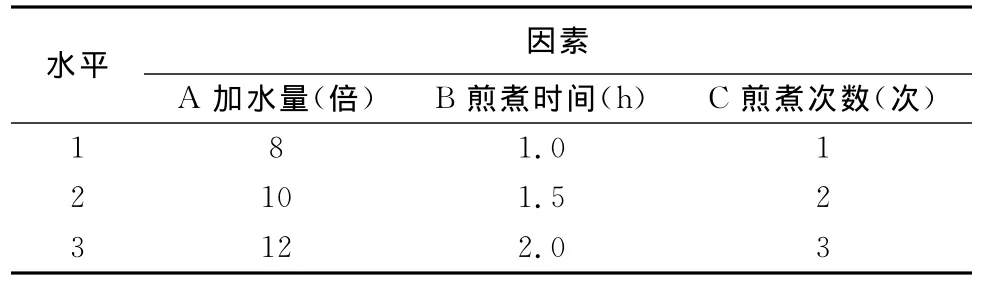
表1 正交試驗設計因素水平
1.3.2 樣品的制備 按處方量,稱取黃芪、人參、白術和甘草4味藥材,混合后浸泡1.0h,按照表2正交試驗設計方案水煎提取,提取液混合后過濾、濃縮至1g/mL、放冷,置250mL玻璃瓶中備用。
1.4 干膏率的測定 精密量取工藝研究樣品20 mL,至蒸發皿蒸干,于105℃干燥至恒溫,稱重得干膏重(g),計算干膏得率。公式為:干膏率=(干膏重/生藥材重量)×100%
1.5 黃芪甲苷含量的測定
1.5.1 色譜條件 色譜柱:YMC-Pack ODS-A 柱(5μm,150mm×4.6mm);流動相:乙腈∶水=35∶65;流速:1.0mL/min。蒸發光檢測器:增益:1000;氮氣壓力:30psi;噴霧器溫度:36℃;漂移管溫度:65℃。
1.5.2 溶液的制備 對照品溶液:精密稱取黃芪甲苷對照品1.2mg,置10mL容量瓶中,定容至刻度,制成每毫升含1.2mg的黃芪甲苷對照品溶液,搖勻,即得。
供試品溶液:精密量取本品20mL,用水飽和正丁醇振搖5次,每次25mL,合并正丁醇液;用氨試液振搖洗滌2次,每次20mL,合并正丁醇液;用蒸餾水洗滌2次,每次20mL,棄去水液;正丁醇液蒸干,殘渣加5mL甲醇使溶解作為供試品溶液。測定時過0.22μm微孔濾膜,取10μL進樣。
陰性(缺黃芪)對照溶液:取缺黃芪的陰性樣品20mL,按供試品溶液制備項下的方法操作,得陰性對照溶液。
1.5.3 專屬性試驗 按上述儀器和試驗條件,吸取供試品溶液、對照品溶液、陰性對照溶液各10μL,注入液相色譜儀。
1.5.4 線性關系考察 精密吸取5、10、15、20、25、30、35μL對照品溶液注入色譜儀,測定峰面積。以對照品進樣量的對數值為橫坐標,以對照品峰面積的對數值為縱坐標,繪制標準曲線。
1.5.5 精密度試驗 取線性項下的同一份對照品溶液,連續進樣6次,每次進樣10μL,測定峰面積,結果精密度試驗相對標準偏差(RSD)為1.67%,精密度符合規定。
1.5.6 重復性試驗 用同一批樣品溶液,重復配制6份供試品溶液,各取10μL注入色譜儀,結果6份供試品峰面積RSD為2.60%,重復性符合規定。
1.5.7 溶液穩定性試驗 取同一份供試品溶液,分別在0、2、4、6、8和10h進樣10μL,測定峰面積,結果表明,供試品溶液10h內峰面積相對標準偏差RSD為2.03%,表明樣品溶液在10h內穩定。
1.5.8 加樣回收率試驗 精密量取已知含量的同一批樣品6份,按照供試品項下制備6份供試品溶液,分別精密加入5mL黃芪甲苷對照品溶液,取10 μL注入色譜儀,記錄色譜圖,計算加樣回收率。結果6份樣品平均回收率為97.88%,RSD為3.20%,表明回收率良好。
1.5.9 樣品的測定 按供試品溶液制備項下方法分別制得9批工藝樣品溶液,按照上述色譜條件,測定黃芪甲苷的峰面積,用對數外標法計算其含量。
2 結果
2.1 專屬性考查
吸取對照品溶液、供試品溶液、陰性對照溶液各10μL,注入液相色譜儀中,按上述色譜條件,進行測定。結果在黃芪甲苷對照品色譜峰相應的位置上,供試品溶液具有相同保留時間的色譜峰,陰性對照溶液在此保留時間處未見明顯的色譜峰,說明雜質對本品黃芪甲苷含量測定無干擾,方法專屬性強(見色譜圖1~3)。
2.2 線性關系考察 經對不同體積的黃芪甲苷對照品進行測定,得回歸方程為:y=1.7327x+3.7372,R2=0.9989,r=0.9994。結果表明,黃芪甲苷在0.60~6.00μg范圍內,峰面積的對數值與黃芪甲苷進樣量的對數值具有良好的線性關系。
2.3 干膏率的測定 精密量取工藝研究樣品20 mL,至蒸發皿蒸干,于105℃干燥至恒溫,稱重得干膏重(g),結果見表2。
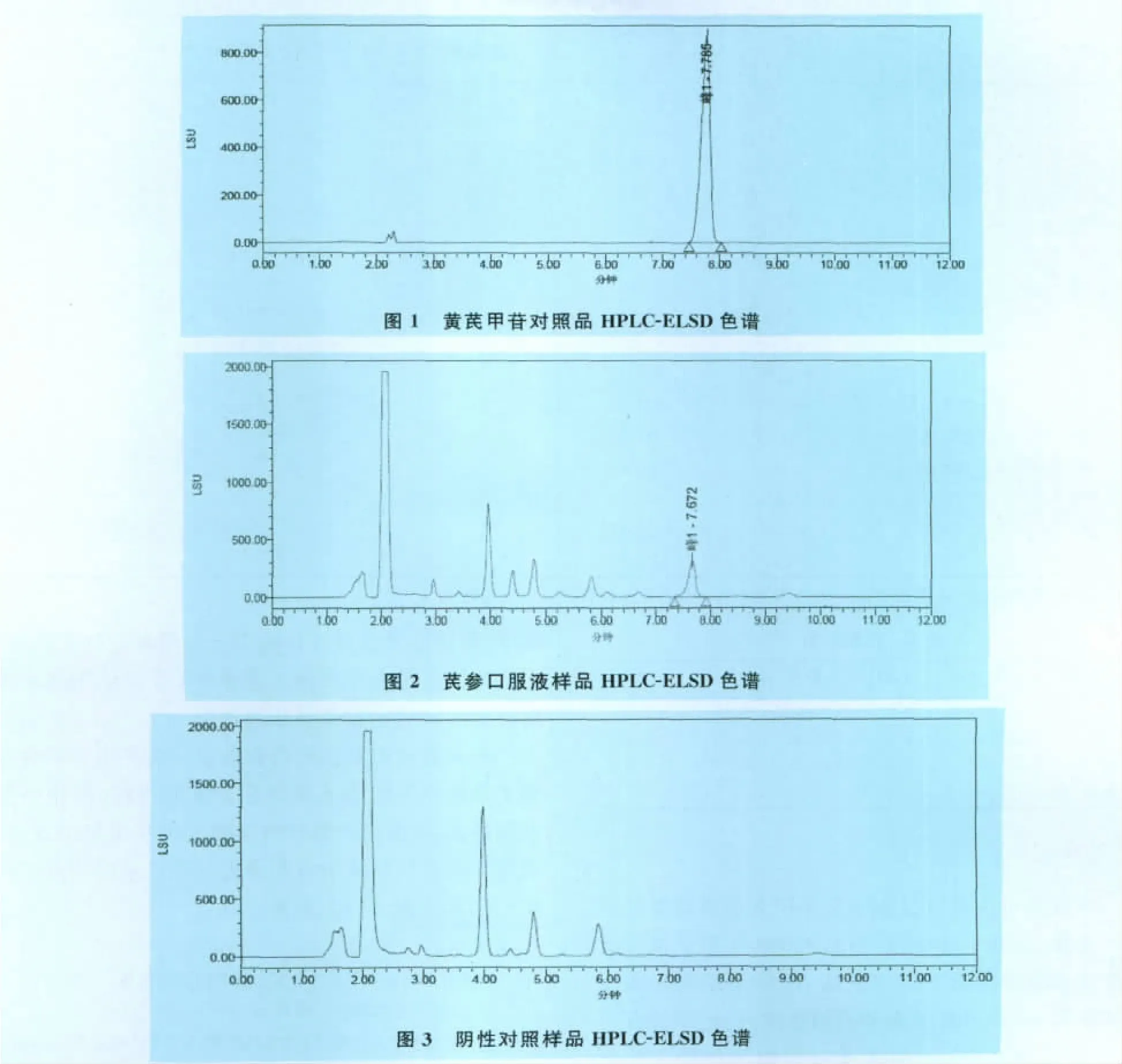
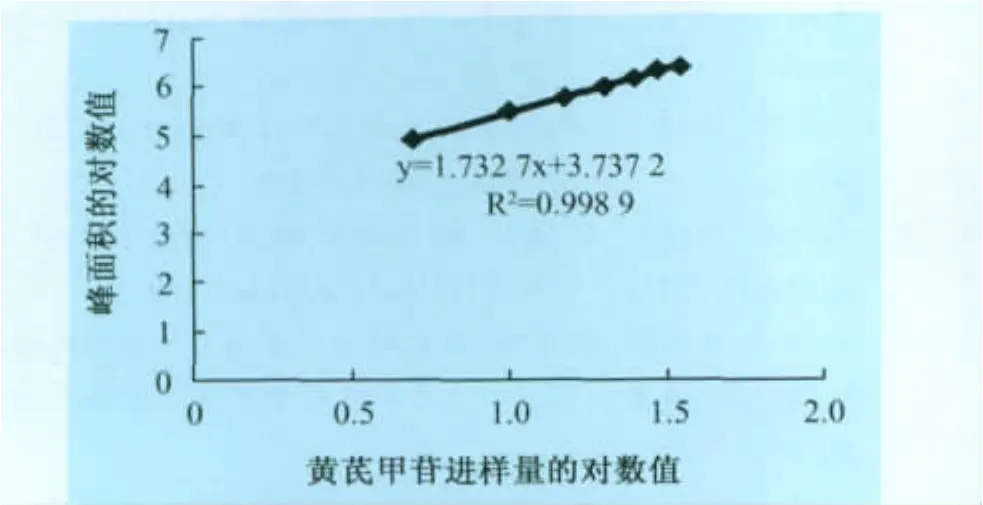
圖4 黃芪甲苷的標準曲線
2.4 黃芪甲苷含量的測定 9批工藝樣品溶液,按照上述色譜條件進行測定,測定結果見表2。
2.5 工藝的綜合評定 正交試驗兩個評價指標干膏率和黃芪甲苷含量,采用綜合評分進行數據分析,干膏率和黃芪甲苷含量的權重系數均為0.5計。干膏得率評分=(樣品干膏得率/最大干膏得率)×0.5×100;黃芪甲苷含量評分=(樣品黃芪甲苷含量/最大黃芪甲苷含量)×0.5×100;綜合評分=干膏得率評分+黃芪甲苷含量評分(見表2)。
采用Microsoft Excel進行分析,綜合直觀分析和方差分析判斷各因素對提取效果的影響程度,篩選出在該試驗條件下的優化提取參數(見表2)。根據正交試驗結果可知,以干膏率和黃芪甲苷為評價指標,各因素的影響順序為煎煮時間>煎煮次數>加水劑量,其中煎煮時間和煎煮次數對工藝有極顯著影響(見表3),因此煎煮時間為1h,煎煮次數為3。而對于無顯著影響的因素,只需結合具體工作及生產要求,本著盡量選擇平均數最大的水平,最終確定為煎煮時間1h,加水量10倍,煎煮3次。
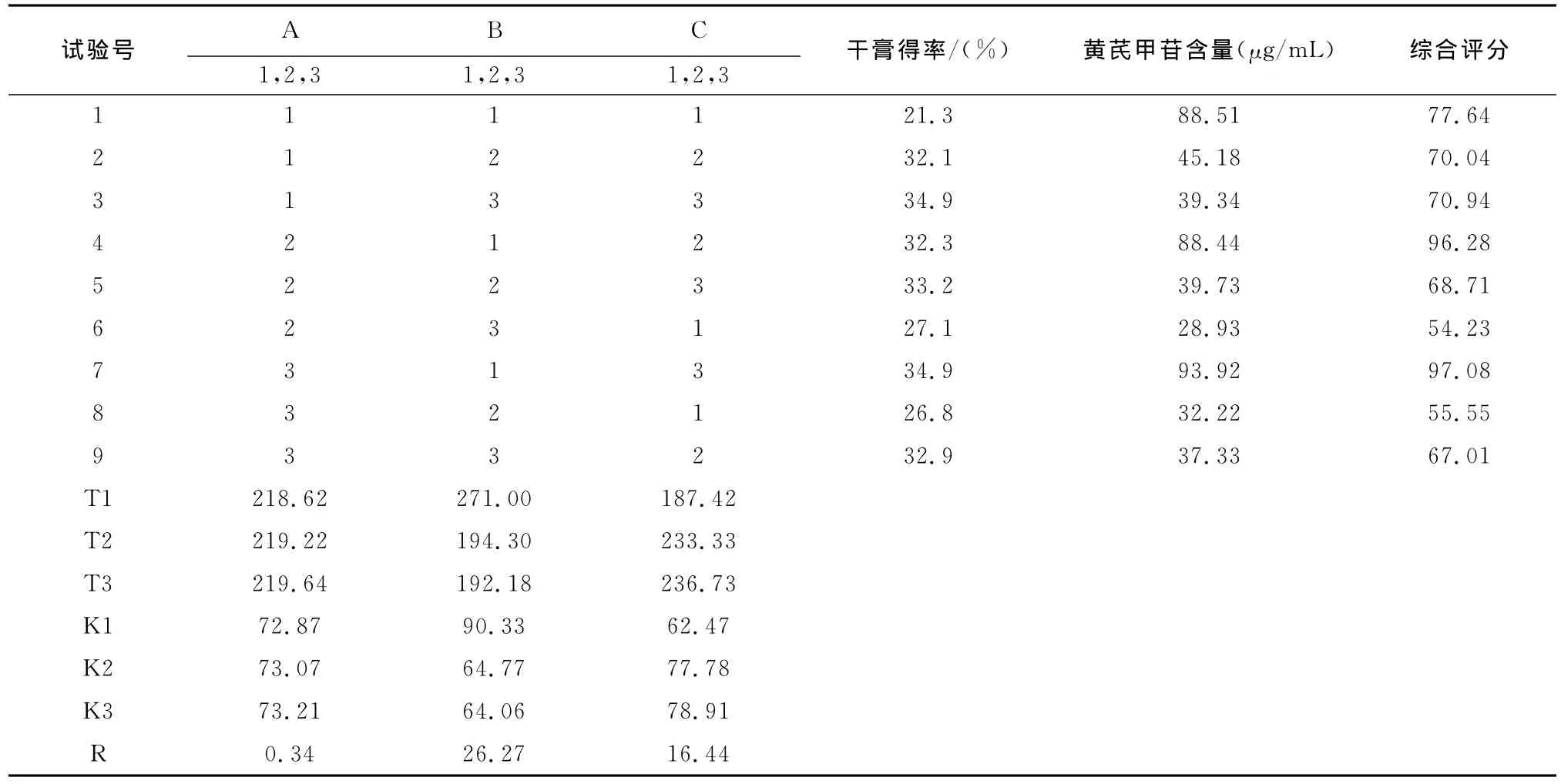
表2 正交試驗

表3 方差分析
3 討論
本試驗對芪參口服液中黃芪甲苷的提取條件進行了考察,參考了《中國獸藥典》2005年版2部[1]黃芪甲苷含量測定項下提取方法,將樣品用水飽和正丁醇提取,分別用氨試液和蒸餾水洗滌,正丁醇蒸干后,比較了通過D101型大孔吸附樹脂柱除雜的處理方法和省略使用大孔吸附樹脂柱除雜的處理方法[7]。結果不經D101型大孔吸附樹脂柱吸附洗脫的樣品在黃芪甲苷保留時間處無雜質峰干擾,分離度好,而通過D101型大孔吸附樹脂柱吸附洗脫的樣品受試驗操作影響較大,回收率較低。故本試驗選用不經大孔吸附樹脂柱除雜的處理方法。
目前,黃芪甲苷測定方法有薄層掃描法,但誤差較大。又由于皂苷為一類具有極性,結構復雜的化合物,它只在紫外末端有吸收,若采用紫外檢測末端吸收法(200~210nm)則有干擾峰,無法使用[5]。而蒸發光散射檢測器為質量型檢測器,不受外部環境干擾,試劑在檢測器中全部蒸發,不干擾檢測,靈敏度、穩定性及重現性均能符合含量測定的要求[6]。因此為提高芪參口服液工藝水平,可以采用蒸發光散射檢測器測定黃芪甲苷的含量。
本試驗選取黃芪藥材有效成分黃芪甲苷的含量和干膏得率為優選正交試驗方案的指標,采用高效液相色譜-蒸發光散射檢測器測定黃芪甲苷的含量,確定了芪參口服液中黃芪水提的最佳條件為煎煮時間1h,加水量10倍,煎煮3次。
[1] 中國獸藥典委員會編.中華人民共和國獸藥典(二部)[S].北京:中國農業出版社,2005:312-313.
[2] 高建,夏泉,黃建剛,等.HPLC-ELSD同時測定當歸補血總苷中黃芪甲苷和黃芪皂苷II[J].中成藥,2012,34(2):268-272.
[3] 王紅霞,王 蕾.HPLC-ELSD法測定利肝隆顆粒中黃芪甲苷的含量[J].中國藥房,2011,22(44):4208-4209.
[4] 吳青業,周恩麗,付小環,等.HPLC-ELSD法測定葛根口服液中黃芪甲苷[J].中草藥,2010,41(8):1305-1306.
[5] 易愛玲,周從輝,熊義濤.高效液相色譜-蒸發光散射檢測器法測定補氣養血口服液中黃芪甲苷的含量[J].時珍國醫國藥,2008,19(6):1407-1408.
[6] 王欣,郭宏偉,張愨,等.HPLC-ELSD法測定阿膠黃芪口服液中黃芪甲苷的含量[J].現代中西醫結合雜志,2011,20(13):1641-1642.
[7] 謝委,方建國,杜光,等.高效液相色譜-蒸發光散射法測定扶正強筋片中黃芪甲苷含量[J].醫藥導報,2012,31(2):208-210.

