牛奶中金黃色葡萄球菌的耐藥性及其腸毒素分型研究
王 娟,黃秀梅,劉書科,李玉清,趙思俊,曲志娜,王玉東,王君瑋
(1.中國動物衛生與流行病學中心,山東 青島266032;2.山東省平度市崔召鎮動物防疫監督站,山東 平度266752)
金黃色葡萄球菌是造成人類食物中毒的常見致病菌之一,并且在自然界分布非常廣泛,因此食品受其污染的機會很多。近年來,美國疾控中心報告,由金黃色葡萄球菌引起的食源性疾病位居第二位,占整個細菌性食物中毒的33% ,加拿大則更多,占45%,引起中毒的食品主要有奶、肉、蛋等及其制品。為了解我國目前生鮮牛奶中金黃色葡萄球菌的污染狀況和耐藥情況,本文對奶牛養殖大省山東、山西和內蒙的奶牛場和擠奶站采樣進行監測,為指導奶牛養殖場安全合理用藥和保障消費者食品安全提供有利保障。
1 設備與材料
1.1 設備 生物安全柜、恒溫培養箱、冰箱、自動細菌鑒定儀、可見分光光度計、基因擴增儀、水浴鍋、離心機、凝膠成像系統等。
1.2 材料 標準菌株 ATCC29213、7.5%NaCl肉湯、Baird-Parker瓊脂、科瑪嘉顯色培養基、MH肉湯、凍干兔血漿、過氧化氫、dNTP、rTaq聚合酶、瓊脂糖等。
2 樣品來源
在山東省、山西省和內蒙古自治區共選擇6個擠奶站和奶牛場進行樣品采集,共采集鮮奶樣品338份。
3 細菌分離鑒定
3.1 金黃色葡萄球菌分離 取1mL牛奶樣品接種到10mL7.5%NaCl肉湯中,于37℃溫箱培養20 h后,將增菌后的液體接種于Baird-Parker平板,36℃培養48h,然后挑取可疑菌落接種到科瑪嘉顯色培養基上[1]。
挑取可疑菌落,劃線接種到營養瓊脂純化培養后,待進一步細菌鑒定。
3.2 金黃色葡萄球菌鑒定 通過生化方法和PCR方法進行鑒定。
3.2.1 生化鑒定 挑取純化好的單個菌落進行觸酶試驗和血漿凝固酶試驗。觸酶試驗陽性的菌落再進行血漿凝固酶試驗;血漿凝固酶試驗中,呈現凝集者判為陽性,則該菌為金黃色葡萄球菌陽性。
3.2.2 PCR方法 設計引物,上游引物 P1:5′-TCTTCAGAAGACGCGGAATA-3′,下游引物P2:5′-TAAGTCAAACGATACCATACG-3′。擴增片段長度為420bp標準菌株和臨床牛奶樣品中基因組DNA的提取按常規方法進行,以基因組DNA為模板進行PCR擴增。樣本DNA擴增的PCR反應體系(25μL):10×Buffer 2.5μL,上下游引物(25 pmol/μL)各1μL,dNTP(10mmol/μL),rTaq聚合酶0.25μL,DNA模板1μL,ddH2O補至25μL。PCR循環條件為:95℃預變性5min;95℃變性1 min,57℃退火50s,72℃延伸50s,擴增36個循環;最后72℃延伸10min。取PCR擴增產物5μL進行1.5%瓊脂糖凝膠電泳(含EB0.5%μg/mL),電泳結束后,在紫外燈下觀察并用電泳圖像分析系統拍照,記錄試驗結果。PCR產物為420bp,陽性對照出現420bp的條帶,檢測分離菌也出現同樣條帶的,均判為金黃色葡萄球菌陽性。

圖1 金黃色葡萄球菌PCR擴增結果
3.3 檢測結果 從采集的338份生牛奶中,檢出金黃色葡萄球菌39株,檢出率為11.54% ,PCR結果與生化鑒定結果一致。結果說明,這些奶牛養殖場和擠奶站的生鮮牛奶存在金黃色葡萄球菌的污染,其主要源于在擠奶過程中污染了牛奶。因此,要防止金黃色葡萄球菌對奶及奶制品的污染。奶牛場要定期檢查奶牛的乳房,并且奶擠出后,要迅速冷藏,以防細菌繁殖、毒素生成,奶制品要以消毒牛奶為原料,注意低溫保存。食品中食源性致病菌的污染是引發食品安全問題的重要原因之一,因此,從源頭上杜絕本菌對食品的污染,以降低金黃色葡萄球菌食物中毒的發生風險。
4 藥敏試驗
用微量肉湯稀釋法測定所有菌株對8類13種抗菌藥的最小抑菌濃度。8類13種抗菌藥分別是:青霉素類(青霉素、氨芐西林、奧格門丁);頭孢類(頭孢西丁、頭孢噻呋);大環內酯類(替米考星、紅霉素、泰妙菌素);萬古霉素類(萬古霉素);磺胺類藥物(磺胺異惡唑、新諾明);氟喹諾酮類(恩諾沙星、氧氟沙星)。
4.1 金黃色葡萄球菌的耐藥性 39株金黃色葡萄球菌對8類13種抗菌藥的耐藥性檢測結果表明,除了對頭孢噻呋、萬古霉素以及奧格門丁沒有耐藥菌株外,對其他藥物都有不同程度的耐藥性。耐藥性最嚴重的藥物是磺胺類藥物(磺胺異惡唑、新諾明),耐藥率分別為97.44%、94.87%;其次是對青霉素類中的青霉素、氨芐西林,耐藥率分別為92.31%、89.74%。耐藥率在40%以上抗菌藥有6種,共有對5種抗菌藥的耐藥率小于10%,這與張蘭榮[2]、徐勤[3]等的試驗結果基本吻合。
此外,頭孢西丁可以作為篩選耐甲氧西林金黃色葡萄球菌的藥物,此次檢測中,有1株菌株對頭孢西丁耐藥,但對頭孢噻呋不耐藥,有待于進一步確證是否是耐甲氧西林金黃色葡萄球菌。
分離菌株對青霉素類藥中青霉素、氨芐西林的耐藥率均在90%左右,而對奧格門丁的耐藥率為0,相差懸殊;其次是對大環內酯類藥物的耐藥率在22.56%~53.85%之間;而對其余同類抗菌藥的耐藥率差別不大(見表1)。
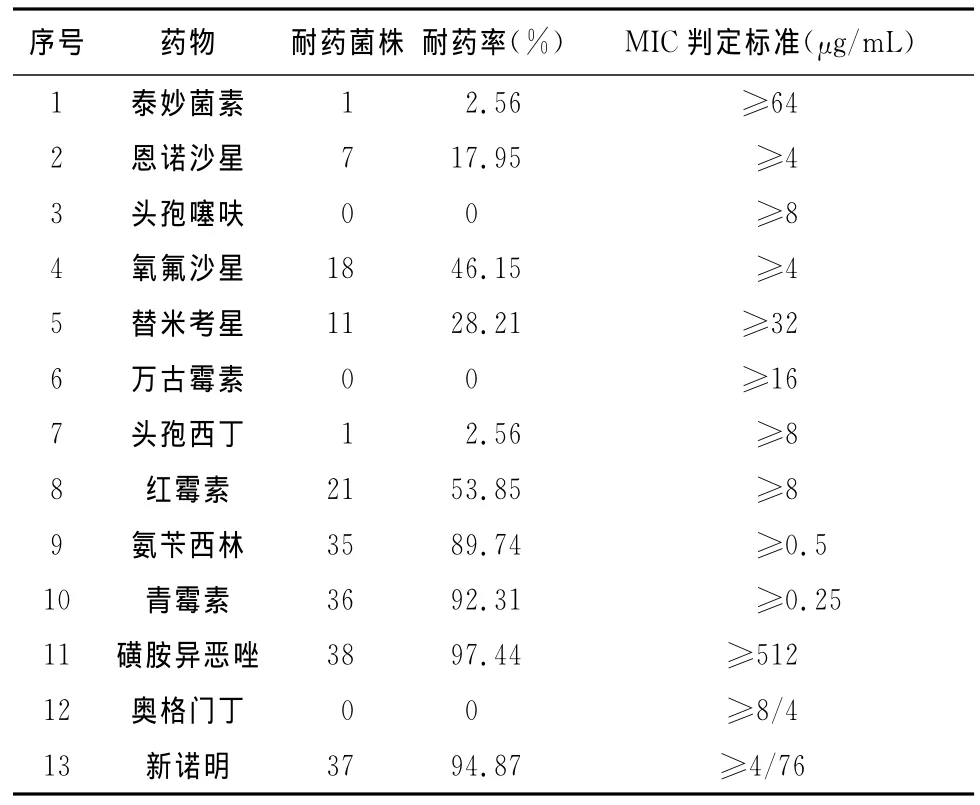
表1 牛奶中金黃色葡萄球菌的耐藥率
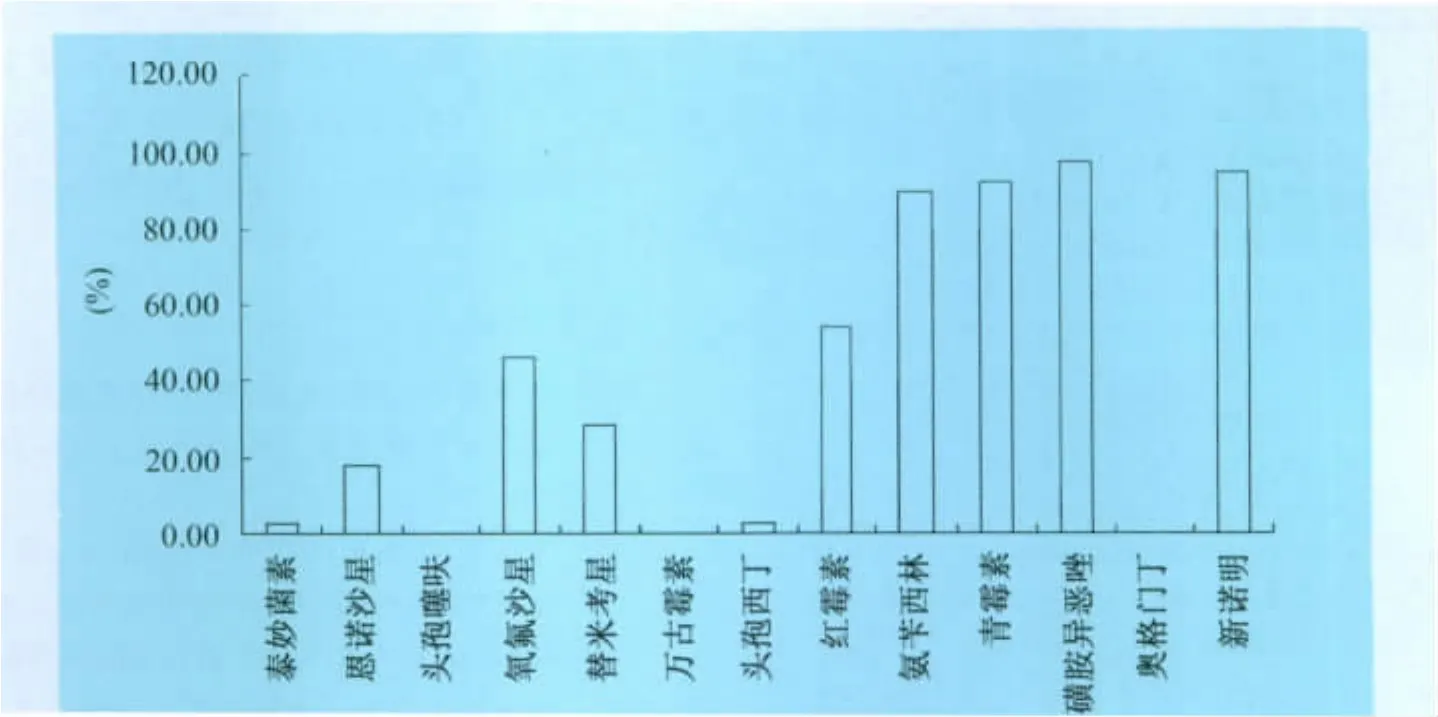
圖2 牛奶中金黃色葡萄球菌耐藥情況
4.2 金黃色葡萄球菌的多重耐藥性 39株牛源金黃色葡萄球菌中沒有0耐菌株出現,1耐和8耐各有1株,無2耐及8耐以上菌株。分離菌株都具有多重耐藥性,主要集中在4耐~5耐,占總分離菌株的61.54%。
4.3 結果分析 食源性致病菌的耐藥性對食品安全及人類健康的影響已經引起很多國家的重視。金黃色葡萄球菌的耐藥性也呈多重化趨勢,本次調查中39株金黃色葡萄球菌對磺胺類藥物和青霉素的耐藥率高達90%以上,對氨芐西林的耐藥率也達89%以上,在13種抗生素中有10種抗生素存在不同程度的耐藥現象,生鮮牛奶中金黃色葡萄球菌的耐藥性可能與奶牛在飼養過程中食入添加抗生素的飼料有關,因此,控制飼料中抗生素的安全使用量尤為重要,是降低食源性致病菌耐藥性發生的主要措施之一。
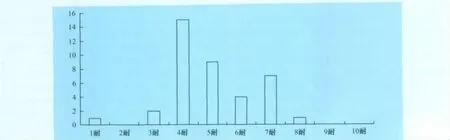
圖3 牛奶中金黃色葡萄球菌多重耐藥情況
金黃色葡萄球菌對藥物的適應性較強,耐甲氧西林和耐萬古霉素金黃色葡萄球菌都是超級耐藥菌[4]。污染耐藥性金黃色葡萄球菌的動物性食品是導致人類感染的原因[5],因此,為防止耐藥性金黃色葡萄球菌引起的危害,有必要對其進行耐藥性監測,保障人類健康。
5 金黃色葡萄球菌毒素基因分型
設計SEA、SEB、SEC、SED、SEE、SEG、SHH、SEI和SEJ共9對引物,用PCR方法對分離鑒定的39株金黃色葡萄球菌進行毒素基因分型。引物序列及產物長度見表2,反應體系見表3。

表2 引物序列及產物長度
PCR的反應程序:先94℃預變性5min,再94℃變性1min,55℃退火1min,72℃延伸2min,共進行35個循環;最后72℃終延伸10min。反應完成后4℃保存。

表3 PCR反應體系
結果表明,39株菌株中,檢測到SEA-SAJ基因的有36株,占92.3%,同時攜帶2種及以上毒素基因的菌株有27株,占69.2%。帶有SEI腸毒素基因的最多,有32株,占82.1%。同時,也攜帶著其他腸毒素基因:SEA有16株,占41.0%;SEB有3株,占7.7%;SEC有2株,占5.1%;SED有3株,占7.7%;SEE有1株,占2.6%;SEG有7株,占17.9%;SEH 有12株,占30.8%;SEJ有5株,占12.8%。
[1] 劉冬香,劉書亮,王印,等.四川省動物性食品中金黃色葡萄球菌的分離鑒定及污染分析[J],食品科學,2009,30(8):251-254.
[2] 張蘭榮,王連秀,張文得.食品中金黃色葡萄球菌的污染狀況及耐藥性分析[J].中國食品衛生雜志,2004,16(1):35-36.
[3] 徐勤,巢國祥.生牛奶中金黃色葡萄球菌污染狀況及耐藥性狀研究[J].中國衛生檢驗雜志,2005,15(8):972-973.
[4] Jones T F,Kellum M E,Porter S S ,etal.An outbreak of community acquired foodborne illness caused by methicillin resistant Staphylococcus aureus[J].Emerging Infectious Disease,2002,8:8284.
[5] Lee J H.Methicillin (oxacillin)-resistant Staphy lococcus aureus strains isolated from major food animals and their potential transmission to humans[J].Applied and Environmental Microbiology,2003,69:6489-6494.

