共軛效應對有機化合物性質的影響
白寶平
(太原大學外語師范學院,山西 太原 0 3 0 0 1 2)
有機化合物的反應歸根到底無非是舊鍵的斷裂和新鍵的生成問題,這是直接和間接與共價鍵的極性(即共價鍵上電子云的分布狀態)有關的,而共價鍵的極性不僅與成鍵原子的電負性、共價鍵的性質有關,而且與相鄰鍵的性質、不直接相連的原子之間的相互影響也有關系。這種通過鍵的極性傳遞所表現的分子中原子之間的相互影響是共用電子對沿共價鍵移動的結果,一般稱之為電子效應。可歸納為誘導效應和共軛效應。以下僅對共軛效應的影響做出討論。
在談共軛效應之前,先來看兩個例子。首先在1,3-丁二烯中,C H2=C H─C H=C H2的鍵長不是簡單的單鍵和雙鍵的鍵長,存在著平均化的趨勢。如:
一般的C─C單鍵鍵長0.1 5 4 n m;
C=C雙鍵鍵長0.1 3 4 n m;
1,3-丁二烯C─C單鍵鍵長0.1 4 7 n m;
C=C雙鍵鍵長0.1 3 7 n m。
而且體系能量降低,化合物趨于穩定。從它的同系物的不同異構體的氫化熱也可推斷出,單雙鍵交替的體系具有特殊的穩定性。
C H2=C H─C H2─C H=C H2△H=-2 5 4.3 9 K j/m o l
C H3─C H=C H─C H=C H2△H=-2 2 6.3 5 K j/m o l
再拿氯乙烯與氯乙烷比較,從誘導效應考慮氯乙烯的偶極矩,由于π鍵的電子云流動性較大,偶極矩應該加大,而實際不然,氯乙烯的偶極矩比氯乙烷的反倒減小了。同時,氯乙烯也同樣存在單雙鍵平均化的趨勢。
C H3C H2C l μ=2.0 5 DC H2=C H C l μ=1.4 4 D
這些現象說明,在單雙鍵交替排列的體系中,或具有未共用電子對的原子與雙鍵直接相連的體系中,電子云圍繞整個分子形成了整體的分子軌道。每個成鍵電子都受到成鍵原子和分子中其他原子的原子核的作用,因而分子能量降低,體系趨于穩定。這種鍵稱為離域鍵,包含著這樣一些離域鍵的體系通稱為共軛體系。在共軛體系中,原子之間相互影響的電子效應叫“共軛效應”(C o n j u g a t e d E f f e c t s)。一般以C為代表。如前所述,它是只存在于共軛體系的特殊影響,而不像誘導效應那樣可存在于一切鍵上。共軛效應也分為供電共軛效應(即+C效應)和吸電共軛效應(即-C效應)。
+C效應 C H2=C H─C l
-C效應 C H2=C H─C H=O
共軛效應通過共軛π鍵來傳遞。當共軛體系一端受電場的影響時,就能沿著共軛π鍵傳遞得很遠,同時在共軛π鍵上的原子將依次出現電子云分布的交替現象。共軛體系的類型一般常見的有下面幾種:
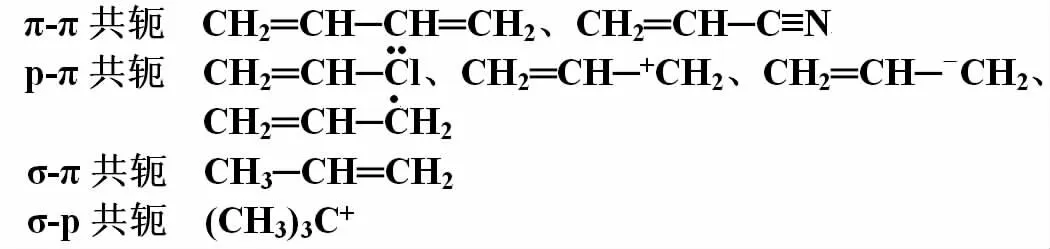
其中σ-π與σ-p共軛效應較π-π、p-π共軛效應弱得多,一般稱之為超共軛效應。
一、對反應方向的影響
在很多有機反應中,先要生成中間態,進而再生成產物,所以中間態的穩定性就決定了產物的種類和產率,也就是決定了反應的方向。中間態多是一些正離子、負離子和自由基,影響它們穩定性的因素有很多,其中很重要的一條就是共軛效應。在中間體的共軛體系中,由于電子的離域,正電荷和負電荷能夠得到很好的分散,使正、負離子得到穩定;而自由基中,由于共軛作用,可以分散獨電子性,使其穩定。例如,1,3-丁二烯與氯化氫加成反應的反應歷程:
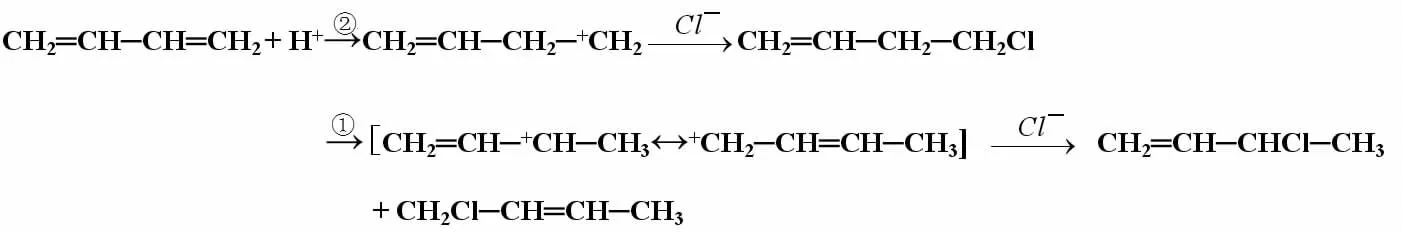
在反應中,H+先加到1,3-丁二烯上,但加完的結果卻有了不同。可以看出,①步生成的是類似于烯丙基正離子的共軛體系有兩種共振式,而②步中的正離子卻只有微弱的σ-p共軛效應,電子離域程度不如①大,正電荷的分散不如①充分,所以②的中間體非常不易形成,反應的方向以①為主。至于①中的兩種產物哪個是主要產物,需要討論化學動力學,在此不做分析。
再如,1,1-二甲基丙二烯與C l2的光照取代反應:
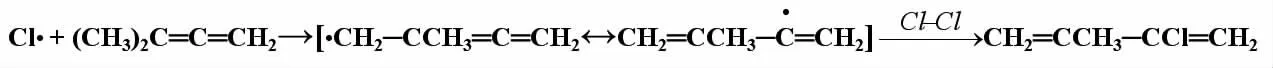
在中間態的兩個共振體中,后者屬共軛結構,較穩定,所以主要產物為2-甲基-3-氯-1,3-丁二烯。
二、對有機化合物活性的影響
前面已提到,共軛效應可分為供電共軛效應和吸電共軛效應。由于二者不同的作用,使化合物的結構發生了變化,從而使化合物發生某些反應的難易程度也有了變化。這一點在親電、親核的加成、取代反應中表現的尤為顯著。例如,苯的親電取代反應。在苯分子中,由于共軛體系可看作無限延伸,所以電子云分布已完全平均化,電子云密度較大。但當苯被某些基團一取代后,苯環和基團由于電子效應(包括誘導效應和共軛效應)會使苯環上的電子云密度發生改變。供電基團使苯環活性增大,反應速度加快;吸電基團則使苯環活性降低,反應速度減慢。下面給出了一些一取代苯硝化反應的相對速度:

通過上表可看出,共軛效應的影響是相當顯著的。再如 ,C6H5C H=C H2、p-C H3C6H4C H=C H2、p-O2N C6H4C H=C H2與H B r的加成的反應速率比較。它們的中間體碳正離子分別 是 :C6H5C H+C H3、p-C H3C6H4C H+C H3、-O2N C6H4C H+C H3,后兩者相當于在前者的苯環上加了一個取代基,但中間的甲基有σ-π的供電共軛效應,可使碳正離子的穩定性加強,而后者的π-π共軛效應卻是吸電的,使碳正離子更加不穩定。穩定性越強,轉化速度就越快,所以反應速度為:
p-C H3C6H4C H=C H2>C6H5C H=C H2>p-O2N C6H4C H=C H2。
三、對有機化合物酸堿性的影響
有機化合物酸性的大小取決于脫H+的難易,越易脫去H+,酸性就越強。而脫H+就必須降低C─H或O─H鍵上的電子云密度。有機物中若含有羧基,肯定能顯酸性,但羧基以外的結構卻會對酸性的大小產生影響。例如,實驗證明C6H5C O O H、m-C H3O C6H4C O O H和p-C H3O C6H4C O O H的p K a值分別為4.2 0、4.0 9和4.4 7。這是因為在苯環上的甲氧基因氧的電負性大,表現為-I的誘導效應,而氧原子上的未共用電子對可以與苯環形成p-π共軛,表現為+C效應。對于間甲氧基苯甲酸,由于只受甲氧基的-I誘導效應,酸性增強。而對甲氧基苯甲酸則受到甲氧基的-I誘導效應和+C共軛效應的綜合影響,其中+C效應的影響大于-I效應,所以表現為酸性減弱。再如,H C O O H和C6H5C O O H的p K a分別是3.7 7和4.2 0,可以看到苯環取代甲酸中的氫后酸性降低,因為苯環可以和羧基中的C=O雙鍵共軛,產生+C效應,使O─H鍵上的電子云密度增大,H+不易脫去,酸性增強。
若有機物容易得到H+,堿性就強,而得H+的條件就是電子云的密度大。例如,苯胺與吡啶的p K b分別為9.3 8和8.8 0。在苯胺中,氨基有-I效應和+C效應,而后者大于前者,起給電子作用,降低了N原子上的電子云密度,堿性較弱;而在吡啶中,N有-I效應和-C效應,二者皆起吸電子作用,增大了N原子上的電子云密度,所以堿性較強。
四、對紅外光譜和紫外光譜的影響
紅外光譜在有機化合物的結構鑒定與研究工作中是一種重要手段。由于一些特殊鍵或官能團在紅外光譜中有特征頻率吸收峰,可以確定一個化合物中它們的存在與否。但是,有時這些特征頻率吸收峰卻不符合數據中的值,而是發生了偏移,這正是由于電子效應等作用引起的。例如,C H3C H2C H=C H2分子中,C=C的伸縮振動吸收峰在1 6 4 7 c m-1,C H3C O C H3分子中,C=O伸縮振動吸收峰在1 7 2 0 c m-1,而在C H3C O C H=C H2分子中,C=C吸收在1 6 2 3 c m-1,C=O吸收在1 6 8 5 c m-1,均比單獨存在時低。這是因為共軛效應使共軛體系中電子云密度平均化,結果使原來雙鍵處的電子云密度降低,力常數減少,所以振動頻率降低。
紫外光譜也是現代有機物鑒定的一種重要手段,是由于分子中價電子的躍遷而產生的。常見的躍遷有σ→σ*、π→π*、n→π*、n→σ*四種。這里僅討論π→π*躍遷。如果分子中存在兩個或兩個以上的雙鍵(包括叁鍵)形成的共軛體系,π電子處于離域的分子軌道上,與定域軌道相比,占有電子的成鍵軌道的最高能級與未占有電子的反鍵軌道的最低能級的能差減小,使π→π*躍遷所需的能量減少,因此吸收向長波方向位移。隨著共軛體系的逐漸增長,躍遷能階的能差逐漸減小,吸收越向長波方向位移。下面是一些多烯化合物的吸收帶:
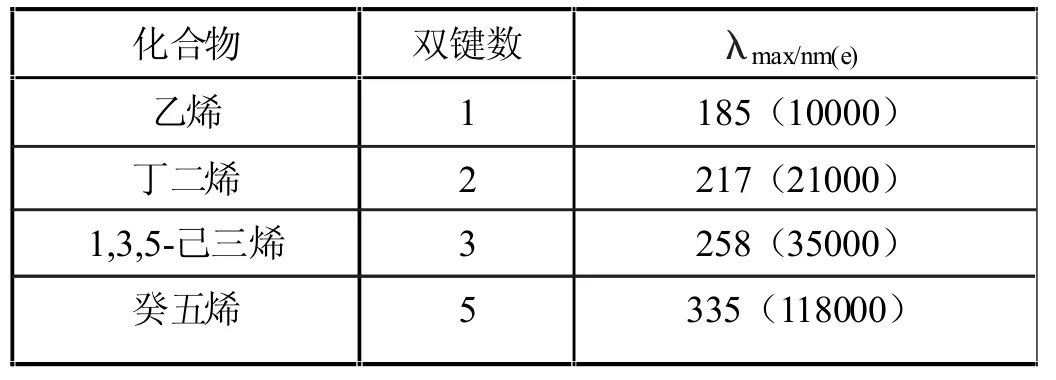
共軛效應對有機化合物的影響遠不止以上四點,在此就不一一闡述了。
[1]邢其毅,徐瑞秋,裴堅,裴偉偉等.基礎有機化學(第三版)[M].北京:高等教育出版社,2005.
[2]曾昭瓊等.有機化學(第四版)[M].北京:高等教育出版社,2004.
[3]汪小蘭等.有機化學(第四版)[M].北京:高等教育出版社,2005.
[4]高職高專化學教材編寫組.有機化學(第三版)[M].北京:高等教育出版社,2010.
[5]惲魁宏,高鴻賓,任貴忠等.高等有機化學[M].北京:高等教育出版社,1995.
[6]馮駿材,丁景范,吳琳等.有機化學習題精解(第二版)[M].北京:科學出版社,2009.

