一種末端單炔偶氮苯化合物的合成與表征
程麗云,錢 錦,吳嘉許
(東華大學材料科學與工程學院,纖維材料改性國家重點實驗室,上海 201620)
隨著現代激光技術的發展,用于防護敏感的光學儀器和人眼免于激光殺傷的被動式光限幅材料已成為國際研究熱點之一。現在廣泛研究的光眼福材料有半導體材料、有機染料、樹枝狀分子、聚合物、有機無機雜化材料等[1-6]。因具有較大的共軛體系、較好的電子流動性、可逆的順反異構而產生的大的非線性響應,偶氮苯及其衍生物被廣泛應用于有機非線性光學材料。由于小分子偶氮化合物難加工成器件,可將偶氮基團引入高分子體系[7,8]。本文設計了一種含單炔的偶氮分子,并且末端帶有強吸電子性的能增大偶氮苯光限幅效應的硝基,可用于制備側鏈含有偶氮苯的聚炔。
1 實驗部分
1.1 試劑
所用試劑均為分析純或化學純,使用前按標準方法提純。
1.2 儀器
美國Nicolet公司Nicolet8700型FTIR傅里葉紅外光譜儀(KBr壓片,400~4 000 cm-1,分辨率 2 cm-1),瑞士Bruker公司Bruker AMX-500型核磁共振測定儀。
1.3 合成
合成路線如 Scheme1 所示:
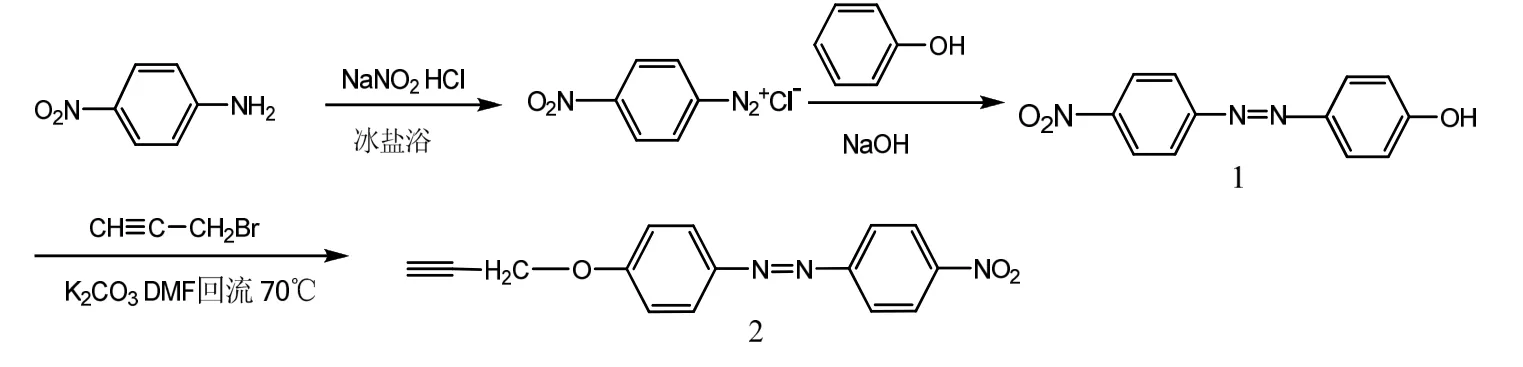
(1) 化合物1的合成:1.284 mL(2.5 mmol)對硝基苯胺,2.5 mL濃鹽酸,2 mL H2O混合攪拌, 再加入緩慢 NaNO2水溶液(0.207 g,40%)2 mL,冰鹽浴,攪拌 30 min,再加入尿素去除多余 NaNO2,靜置 15 min。將苯酚0.087 77 mL(10 mmol)置于單口瓶中,加入pH=9的緩沖溶液,冰鹽浴,再將重氮鹽緩慢加入苯酚緩沖溶液中,劇烈攪拌2 h。加二氯甲烷萃取3次,分出有機層,無水硫酸鎂干燥,濾液濃縮后加入硅膠旋干,用硅膠柱(淋洗劑石油醚∶乙酸乙酯=4∶1)提純后得紅色固體,產率85%。FT-IR(KBr film)cm-1:3400 (-OH),1411 (N=N),1510,1335(N=O);1H-NMR (400 MHz, CDCl3): δ:8.30(d, 2H,H5), 7.92 (d, 2H, H3), 7.88(d,2H, H4), 6.92 (d,2H,H2),5.24(S, 1H, H1)。
(2) 化合物2的合成:在單口瓶中加入0.243 g(1 mmol) 4-硝基偶氮苯酚,0.18 g溴丙炔(1.5 mmol),碳酸鉀0.165 g(1.2 mmol),DMF50 mL,在70 ℃下加熱回流10 h,減壓蒸餾除去DMF,再用甲烷萃取,旋干,用硅膠柱(淋洗劑石油醚:乙酸乙酯=6︰1)提純后得紅色固體,產率90%。FTIR (KBr, cm-1):3260 (H—C≡C),2120 (C≡C), 1411 (N=N),1510、1335 (N=O);1H-NMR (400 MHz, CDCl3): δ:8.31 (d,2H, H6), 7.93 (d, 2H, H5), 7.92(d, 2H , H4),7.19(d,2H,H3) ,4.74(d,6H,H2) ,2.51(m, 1H,H1)。
2 結果與討論
對于化合物1生成非線性生色團的反應主要分兩步進行:首先是對硝基苯胺與亞硝酸的重氮化;第二步是重氮鹽與苯酚的偶聯反應。對硝基苯胺與亞硝酸在強酸介質中發生重氮化反應,反應速度很快,重氮鹽的產率是非常高的,幾乎完全反應。但由于大多數的重氮鹽很不穩定,溫度稍高條件下會分解放出氮氣,故必須嚴格控制反應溫度在0 ℃左右。當氨基的對位或鄰位有強吸電子基時,其重氮鹽比較穩定,溫度可以稍高一點,所以由于反應物對于是硝基,故反應溫度可控制在5 ℃以下。重氮化反應中酸的用量一般是芳胺的 2.5~3倍,其中 1份酸與亞硝酸鈉反應生成亞硝酸,1份酸反應生成重氮鹽,剩下過量的酸是為了維持溶液一定的酸度,防止重氮鹽與未反應的胺發生偶聯。重氮化反應過程中需要注意亞硝酸鈉用量的控制,若加入過量亞硝酸鈉,則多余的亞硝酸鈉氧化重氮鹽而降低產率。因而在滴加亞硝酸鈉溶液時,可使用碘化鉀-淀粉試紙,試紙剛變藍為止停止滴加,也可加入尿素也可以除去過量的亞硝酸鈉。本實驗中的芳胺對位上有強吸電子基硝基,造成芳胺堿性較弱,與無機酸成鹽較難,且對硝基苯胺鹽酸鹽難溶于水,還易解離出對硝基苯胺。所以對該反應進行了改進,即將對硝基苯胺溶于濃鹽酸中,然后將此溶液倒入盛有碎冰塊的燒杯中,析出。
在合成(2)時,添加少量的 K2CO3作為催化劑,使產率大大提高。采取DMF作為溶劑,不僅提高反應物的溶解性,還提高了反應的溫度,從而提高了產率。
3 結 論
本文通過偶氮偶聯法和 Williamson 醚合成法首次成功的得到了一種末單炔類偶氮化合物,該化合物可以在金屬催化劑作用下通過溶液聚合反應制
[1]Yu X L, Cao C B, Zhu H S, et al. Nanometer-sized copper sulfide hollow spheres with strong optical-limiting properties[J]. Adv Funct Mater,2007, 17(8): 1397–1401.
[2]Liu Y S, Zhou J Y, Zhang X J, et al. Synthesis, characterization and optical limiting property of covalently Oligothiophene unctionalized graphene material[J]. Carbon, 2009, 47(13): 3113 – 3121.
[3]Liu Z B, Tian J G, Guo Z, et al. Enhanced optical limiting effects in porphyrin-covalently functionalized single-walled carbon nanotubes[J].Adv Mater, 2008, 20(3): 511–515.
[4]Pierre A B, Guillaume W, Gerard B, et al. Near IR Nonlinear Absorbing Chromophores with Optical Limiting Properties at Telecommunication Wavelengths[J]. Chem Mater, 2007, 19(22): 5325-5335.
[5]Liu J Z, Lam J W Y, Jim C K W, et al. Thiol-yne click polymerization:regio- and stereoselective synthesis of sulfur-rich acetylenic polymers with controllable chain conformations and tunable optical properties[J].Macromolecules, 2011, 44(1): 68-79.
[6]Westlund R, Malmstrom E, Lopes C, et al. Efficient nonlinear absorbing platinum(II) acetylide chromophores in solid PMMA matrices[J]. Adv.Funct Mater, 2008, 18(13): 1939-1948.
[7]Yin S C, Xu H Y, Fang M, et al. Synthesis and optical properties of poly[2-{N-Methyl-N-(4-(4-ethynylphenylazo)phenyl)amino}ethyl butyrate[J]. Macromol Chem Phys, 2005, 206(15): 1549-1557.
[8]Yin S C, Xu H Y, Shi W F, et al. Synthesis and optical properties of polyacetylenes containing nonlinear optical chromophores[J]. Polymer, 2005,46(18): 7670-7678.

