異丹葉大黃素下調膀胱癌細胞的細胞周期蛋白D1表達并誘導G0/G1細胞周期阻滯*
方 勇, 侯 琦, 盧 瑜
(1浙江大學醫學院,附屬邵逸夫醫院腫瘤內科,浙江杭州310016;2中國醫學科學院,協和醫科大學藥物研究所,北京100050;3南京軍區杭州療養院療養二科,浙江 杭州310007)
膀胱癌是泌尿系統最常見的腫瘤[1],無論是發病率還是死亡率均占首位,近年來發病率呈增長趨勢[2]。而浸潤性膀胱癌常出現威脅生命的遠處器官轉移,患者幾乎100%死亡。因此如果能尋找到一種天然化合物,可抑制膀胱癌細胞的侵襲和轉移,進而降低死亡率,這將具有極其重要的臨床意義[3]。
近年來的研究已經證實了膀胱癌的發展、預后均與細胞周期蛋白D1(cyclin D1)有關[4]。多項臨床研究表明,膀胱腫瘤早期即存在著異常細胞周期蛋白D1的表達[4-5]。細胞周期蛋白D1的過度表達與預后不良相關,可顯著降低患者術后的遠期生存率[6]。細胞周期蛋白D1是一個重要的細胞周期調控蛋白,通過結合細胞周期蛋白依賴性激酶4(cyclin-dependent kinase 4,CDK4)、磷酸化以及失活視網膜母細胞瘤蛋白(retinoblastoma protein,pRb),在G1到S過渡的細胞周期進程中發揮著重要作用[7]。因此,下調細胞周期蛋白D1的表達和功能成為抗腫瘤研究領域中靶向藥物研究的重要熱點之一。
從多種中藥成份中提取出的寡聚二苯乙烯類化合物(oligostilbenes)具有多種生物學活性,尤其是抗腫瘤的活性正引起眾多研究者的關注[8-9]。我們研究從植物買麻藤中提取分離的中藥單體成分異丹葉大黃素(isorhapontigenin,ISO)對膀胱癌細胞的增殖、細胞周期蛋白D1表達水平、G0/G1細胞周期阻滯及遷移的影響。
材料和方法
1 材料
ISO由中國醫學科學院北京協和醫學院藥物研究所提供,被溶解在DMSO,濃度為10 mmol/L,并進一步用DMSO稀釋,最后DMSO終濃度為0.1%(V/V)進行細胞培養實驗。相同濃度的DMSO(0.1%,V/V)被用來作為陰性對照。
抗CDK4、CDK6、細胞周期蛋白A、細胞周期蛋白B1、細胞周期蛋白D1、細胞周期蛋白E、P21、P53以及GAPDH抗體均購自Santa Cruz。抗P27抗體購自Abcam。新生牛血清和DMEM購自Gibco。DMSO購自Sigma,ATP生物熒光檢測試劑盒購自Promega。人源性膀胱癌UMUC3細胞由美國紐約大學醫學院HUANG Chuanshu教授實驗室惠贈。由于UMUC3膀胱癌細胞株遺傳背景和較強的轉移傾向,并且高表達細胞周期蛋白D1,所以選定該細胞株進行后續的實驗。
2 方法
2.1 ATP生物熒光檢測法檢測細胞活性 將UMUC3細胞在含有10%新生牛血清、1×105U/L青霉素及100 mg/L鏈霉素的DMEM培養基中,37℃、5%CO2條件下培養,每3 d傳代1次。以5×103cells/well的密度接種于96孔培養板,以不同濃度ISO(0、5、10、20、40 和 60 μmol/L)作用于細胞共 48 h。提取ATP,熒光掃描儀測定熒光強度,軟件分析藥物各濃度抑制率,計算IC50,繪制抑制曲線,評估藥物作用。
2.2 UMUC3細胞周期蛋白D1表達的檢測 采用Western blotging法檢測UMUC3細胞株細胞周期蛋白D1蛋白表達情況。進行蛋白質的提取、定量和分離。轉膜后先后與10 g/L脫脂奶粉、鼠抗人抗體(細胞周期蛋白D1、細胞周期蛋白依賴性激酶4、細胞周期蛋白依賴性激酶6、細胞周期蛋白A、細胞周期蛋白B1、細胞周期蛋白D1、細胞周期蛋白E、P21、P27、P53和GAPDH)I抗4℃孵育過夜,過氧化物酶偶聯的II抗孵育,運用ECL Western blotting kit顯色并掃描實驗結果。
2.3 UMUC3細胞周期蛋白D1 mRNA表達的檢測收集UMUC3細胞約1×106,按TRIzolTM試劑盒說明書提取總RNA,逆轉錄反應體系:模板RNA 2 μg,10 mmol/L dNTP 1 μL,RNA 酶抑制劑(RNasin)335 nKat,Oligo dT181 μL,AMV 逆轉錄酶1 μL,5 × 逆轉錄酶緩沖液5 μL,終體積為25 μL,42℃水浴30 min,采用PubMed的Primer BLAST軟件設計細胞周期蛋白D1基因PCR引物(擴增產物大小408 bp),序列如下:上游引物 5’-GAGGTCTGCGAGGAACAGAAGTG-3’,下 游 引 物 5’-GAGGGCGGATTGGAAATGAACTTC-3’。同時以 GAPDH作為內參照(擴增產物大小285 bp),上游引物5’-AGAAGGCTGGGGCTCATTTG-3’,下游引物 5’-AGGGGCCATCCACAGTCTTC-3’。PCR產物經2%瓊脂糖凝膠電泳,MGIAS-1000凝膠成像系統掃描定量并拍照。
2.4 PI染色法和流式細胞術檢測 胰酶消化并收集細胞,70%乙醇固定,4℃保存。600×g離心5 min,并用 PBS 液(含有0.5%BSA 和0.1%Triton X-100)洗2次。加入PI染色液避光保存30 min后,用流式細胞儀(Beckman Coulter)檢測細胞周期DNA含量和凋亡細胞百分數。
2.5 細胞劃痕實驗 在6孔板中,以含10%FBS的DMEM培養UMUC3細胞直到生長到80%,以絲裂霉素處理1 h,抑制細胞的分裂。以無菌的移液器吸頭劃痕,用無血清的PBS洗滌3次后,去除劃下的細胞,加入含1%FBS血清在37℃、5%CO2條件下培養,根據指定的時間進行拍照,直到細胞長滿劃痕區域。以細胞遷移分析軟件(Cell Migration Analysis Software,Muscale LLC)定量分析細胞的遷移能力。
3 統計學處理
計量數據以均數±標準差(mean±SD)表示。對各組之間采用t檢驗或方差分析,用SPSS 13.0統計學軟件進行數據分析,以P<0.05為差異有統計學意義。
結 果
1 ISO抑制膀胱癌細胞的增殖
ISO 的化學結構是 4'-甲氧基-3,3',5-三羥基二苯乙烯(4-methoxyresveratrol),見圖 1A,分子量為258 D。我們首先通過實驗證實ISO對UMUC3細胞增殖的影響。UMUC3與不同劑量ISO(0~60 μmol/L范圍)共同培養48 h后,倒置相差顯微鏡下觀察,如圖1B所示,20 μmol/L以上濃度顯著抑制腫瘤細胞增殖。通過ATP生物熒光檢測法檢測細胞增殖活性,證實ISO抑制膀胱癌細胞呈明顯劑量依賴性,UMUC3細胞株的 IC50為(22.5 ±2.8)μmol/L(n=3),見圖1C。進一步通過流式細胞術檢測,5 μmol/L ISO作用48 h后可誘導細胞出現G0/G1細胞周期阻滯,但不會誘導細胞凋亡;而20 μmol/L ISO可誘導UMUC3細胞出現典型的凋亡峰(Sub-G1峰),見圖1D。
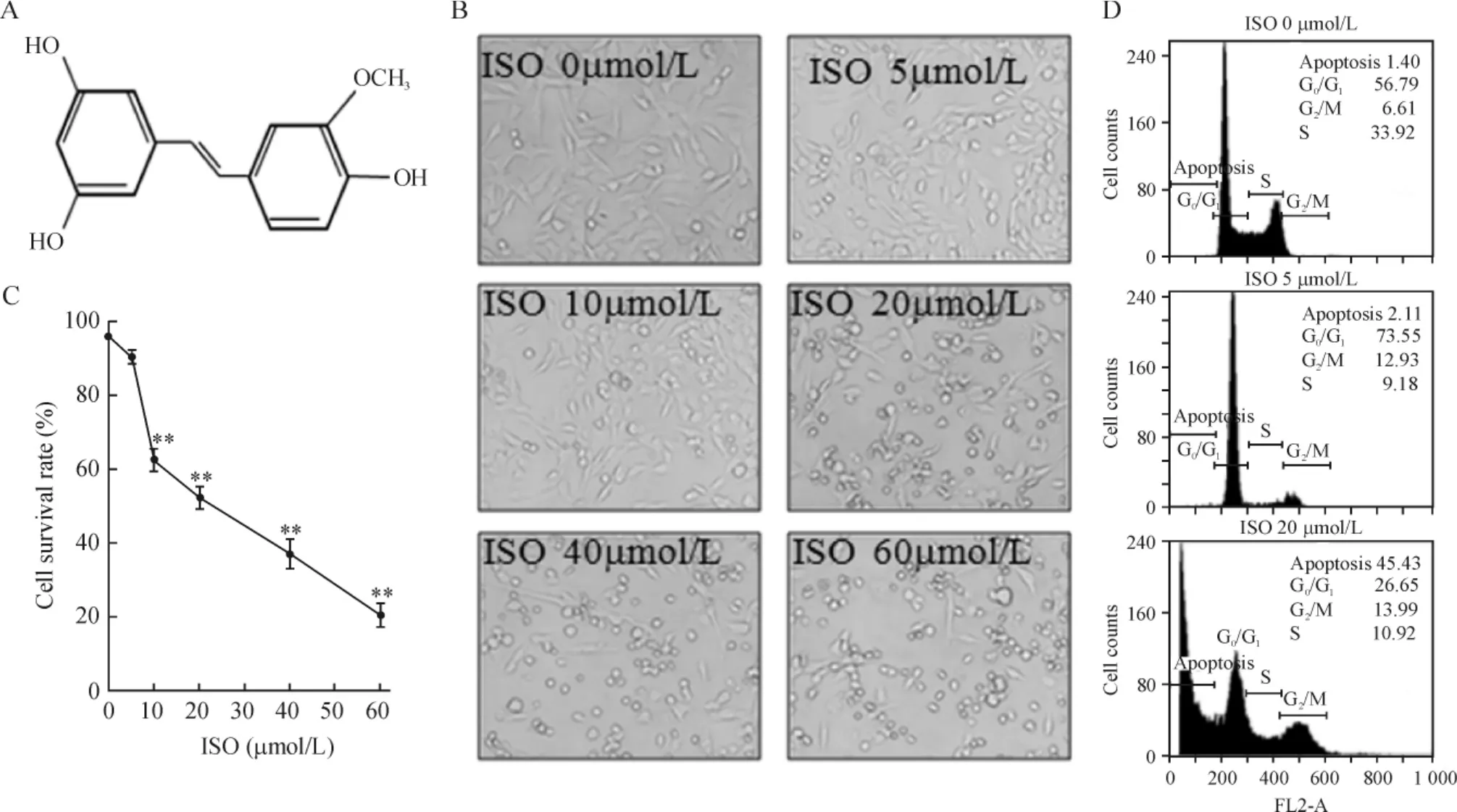
Figure 1.ISO inhibited proliferation of human bladder cancer UMUC3 cells.A:the structure of ISO.B:under phase-contrast microscope,representative images of UMUC3 cells pretreated with more than 20 μmol/L of ISO showed the inhibition of proliferation(×400).C:the UMUC3 cells were treated with different concentrations of ISO for 48 h,and followed by the detection of ATPase assay.Mean ± SD.n=3.**P <0.01 vs 0 μmol/L.D:flow cytometric analysis of cell cycle of UMUC3 cells treated with different concentrations of ISO for 48 h.20 μmol/L ISO could induce typical sub-G1(apoptosis)peak.圖1 ISO可顯著抑制膀胱癌UMUC3細胞的增殖
2 ISO可下調膀胱癌細胞細胞周期蛋白D1蛋白和mRNA表達
UMUC3與不同劑量(0~20 μmol/L)的 ISO培養24 h收集UMUC3細胞的蛋白質后,經Western blotting檢測均可見分子量為37 kD的細胞周期蛋白D1的表達受到顯著抑制(圖2A)。檢測其它細胞周期調控蛋白,ISO并未對CDK4、CDK6、細胞周期蛋白A 、細胞周期蛋白B1、細胞周期蛋白D1、細胞周期蛋白E、P53、P21和P27等產生影響。圖像分析系統表明(圖2B),5、10 和 20 μmol/L ISO 呈劑量依賴性抑制細胞周期蛋白D1蛋白表達(P<0.01)。同時,RT-PCR檢測結果顯示,ISO可顯著下調UMUC3細胞細胞周期蛋白D1 mRNA表達,見圖2C。
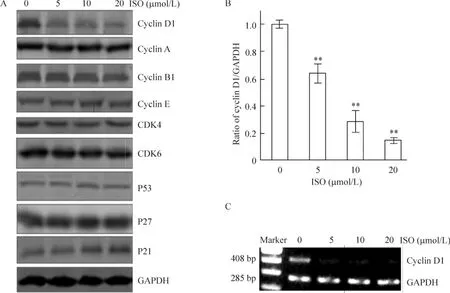
Figure 2.The protein and mRNA levels of cyclin D1 could be significantly down-regulated by ISO.A:the protein expression of cyclin D1,cyclin A,cyclin B1,cyclin E,CDK4,CDK6,P53,P27 and P21 detected by Western blotting.B:the ratio of cyclin D1/GAPDH in the UMUC3 cells pretreated with ISO.Mean ± SD.n=3.**P <0.01 vs 0 μmol/L.C:the mRNA expression of cyclin D1 detected by RT-PCR.圖2 ISO可下調UMUC3膀胱癌細胞周期蛋白D1蛋白和mRNA表達
3 ISO可誘導膀胱癌細胞出現G0/G1細胞周期阻滯
結合圖1D和圖2的結果,5 μmol/L ISO可顯著性下調細胞周期蛋白D1 mRNA水平,但不會誘導細胞凋亡。因此后面的實驗均采用5 μmol/L ISO進行研究。經流式細胞術檢測,5 μmol/L ISO作用于膀胱癌細胞12 h和24 h后,可出現不同程度G0/G1細胞周期阻滯。與對照組(47.33%)進行比較,在沒有顯著誘導腫瘤細胞凋亡的情況下,可分別在12 h(58.82%)和24 h(63.942%)顯著誘導細胞 G0/G1期生長停滯 (P <0.01),見圖3。
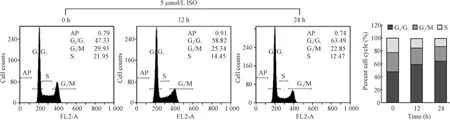
Figure 3.ISO induced G0/G1arrest of human bladder cancer UMUC3 cells.Exposure of UMUC3 cells to 5 μmol/L ISO led to significant induction of G0/G1growth arrest at both 12 h(47.33%vs 58.82%)and 24 h(47.33%vs 63.94%).AP:apoptosis.圖3 ISO可誘導膀胱癌細胞出現G0/G1細胞周期阻滯
4 ISO可顯著抑制膀胱癌細胞的遷移活性
經細胞劃痕實驗證明,與未加ISO預處理進行比較,5 μmol/L ISO均可在12 h和24 h顯著抑制膀胱癌細胞的遷移活性(P<0.01),見圖4。
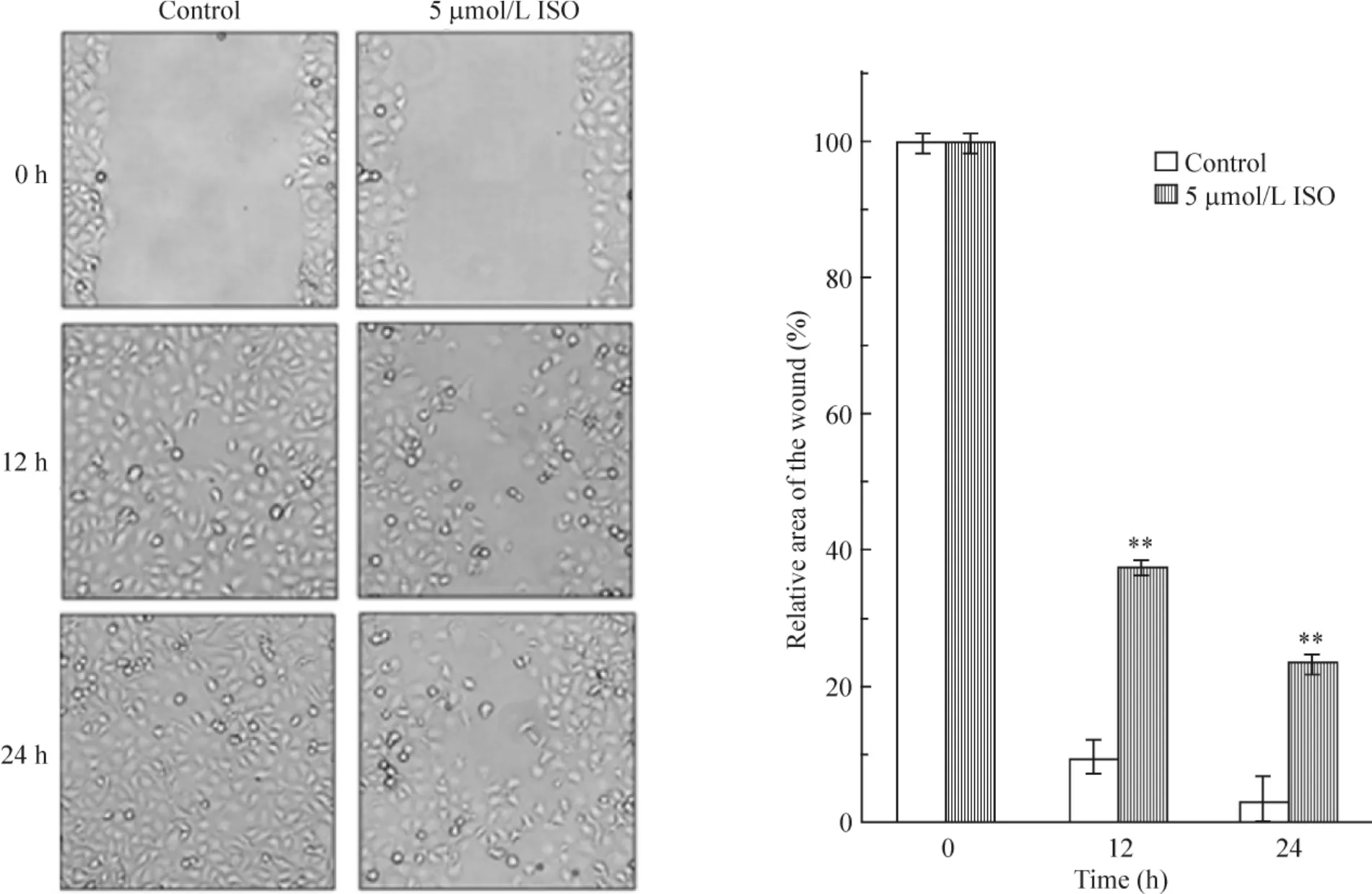
Figure 4.ISO inhibited the migration of human bladder cancer UMUC3 cells detected by wound-healing assay.Cells were wounded and then treated with DMSO or ISO(5 μmol/L).At 0,12 and 24 h,phase-contrast pictures of the wounds at the same locations were taken and then migrated cells in the wound were counted.Mean ± SD.n=3.**P <0.01 vs control.圖4 ISO可顯著抑制膀胱癌細胞遷移活性
討 論
泌尿系統來源的膀胱上皮腫瘤是我國最常見的泌尿系統惡性腫瘤。近年來發病率呈明顯上升趨勢,晚期患者接受進一步化放療的治療效果仍不理想[10]。本研究證實,ISO可抑制膀胱癌細胞的增殖,可下調細胞周期蛋白D1 mRNA和蛋白水平,誘導膀胱癌細胞出現細胞G0/G1周期阻滯,并可抑制膀胱癌細胞遷移。
在我國,約25%的膀胱癌患者最終可發展為肌層浸潤性膀胱癌或轉移性膀胱癌。我們實驗室近期的研究證實,從植物買麻藤中提取分離的中藥單體成分ISO,劑量在20~60 μmol/L濃度條件下,能顯著下調包括人膀胱癌細胞在內的多種腫瘤細胞X連鎖凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)水平,誘導細胞凋亡,發揮其抗腫瘤作用[3]。在本項研究中,我們證實低濃度 ISO(5 μmol/L)不僅能抑制膀胱癌UMUC3細胞株的細胞增殖,并可有效地下調細胞周期蛋白D1 mRNA和蛋白質水平的表達,誘導細胞周期G0/G1期阻滯。
1991年發現細胞周期蛋白 D1,又稱 PRAD1、CCND1、BCL-1,其基因位于 11q13,長約 15 kb,含 5個外顯子,4個內含子,編碼的蛋白含295個氨基酸殘基,分子量37 kD[11],為細胞內主要的癌基因之一。許多研究證據表明,在各種促進細胞炎性增殖的反應,包括致癌物質誘導細胞產生突變的過程中,首先可引起細胞周期的改變[12]。在腫瘤形成過程中,細胞周期蛋白D1比細胞周期蛋白D2和D3更加重要[13]。細胞周期蛋白D1對細胞周期蛋白依賴性激酶進行正調控,而周期素激酶抑制劑(cyclin kinase inhibitor,CKI)對細胞周期蛋白依賴性激酶進行負調控,一旦這種正負調控的平衡被破壞,細胞就可能異常增殖進而惡變。本研究證實ISO可下調細胞周期蛋白D1 mRNA的表達,但沒有影響CDK4和CDK6表達,也沒有對另一類包括P21、P27和P53等CKI蛋白產生顯著影響。
細胞周期蛋白D1作為癌基因最早見于甲狀旁腺癌,后被證實參與包括膀胱癌在內的多種實體瘤的分子病理機制。細胞周期蛋白D1表達并不限于某種病理類型,并且細胞周期蛋白D1在膀胱癌進展的各個階段持續存在。曾文利等[15]證實膀胱癌組織的細胞周期蛋白D1陽性率明顯高于正常膀胱黏膜和癌旁組織。細胞周期蛋白D1在癌變危險性大的良性病變、病理分級差以及浸潤性膀胱癌組織內,均高表達并與預后密切相關。細胞周期蛋白D1在膀胱癌中的異常表達可能參與膀胱癌的發生、發展過程[14]。除膀胱癌外,細胞周期蛋白D1在其它多種人類腫瘤,包括乳腺癌[16]、子宮頸癌[17-18]、結腸癌[19]、前列腺癌[20]、肝癌[21]和皮膚癌[22]等均不同程度地高表達。因此,細胞周期蛋白D1是腫瘤細胞周期調控及藥物治療中潛在的治療靶點。
例如,Li等[23]證實了在小鼠胚胎成纖維細胞(mouse embryonic fibroblast,MEF)中,細胞周期蛋白D1表達缺陷后細胞遷移活性明顯減低。本實驗結果證實ISO(5 μmol/L)可顯著抑制細胞周期蛋白D1表達,并通過細胞劃痕實驗證實可下調膀胱癌細胞的遷移,與Li等的結果相一致。目前下調或抑制細胞周期蛋白D1表達的分子生物學方法包括:細胞周期蛋白D1亞型(全長細胞周期蛋白D1)與小分子細胞周期蛋白依賴性激酶4/6抑制劑PD0332991[24]、小分子干擾核糖核酸(RNA干擾)[25]、細胞周期蛋白D1基因敲除[26]和抑制糖原合成酶激酶(glycogen synthase kinase,GSK)3β 活性[27]。但這些基因治療,目前仍具有穩定性差、需要多次重復給藥、細胞膜通透性差、轉染效率不穩定等不足。患者的安全性受到威脅,極大限制了臨床使用。
因此,本研究將為治療膀胱癌和其它腫瘤提供新的思路和治療策略,為進一步研究細胞周期蛋白D1在參與實體腫瘤細胞遷移、腫瘤細胞G0/G1周期調控中的作用提供了新思路,也為臨床采用中藥單體綜合治療腫瘤提供了新的策略,尤其是對一些細胞周期蛋白D1基因高表達的腫瘤。
本研究還有不足之處,如:ISO可在mRNA和蛋白水平下調細胞周期蛋白D1表達水平,其具體機制尚不清楚;另外,ISO對細胞內細胞周期調控蛋白如CDK均未產生影響,但對其它信號轉導途徑如JNK/c-Jun、JAK/Stat等是否影響,這些都有待于進一步研究。
[1] Schned AR,Andrew AS,Marsit CJ,et al.Histological classification and stage of newly diagnosed bladder cancer in a population-based study from the Northeastern United States[J].Scand J Urol Nephrol,2008,42(3):237-242.
[2] Li C,Wu W,Liu J,et al.Functional polymorphisms in the promoter regions of the FAS and FAS ligand genes and risk of bladder cancer in south China:a case-control analysis[J].Pharmacogenet Genomics,2006,16(4):245-251.
[3] Fang Y,Yu Y,Hou Q,et al.The Chinese herb isolate isorhapontigenin induces apoptosis in human cancer cells by down-regulating overexpression of antiapoptotic protein XIAP[J].J Biol Chem,2012,287(42):35234-35243.
[4] Shariat SF,Ashfaq R,Sagalowsky AI,et al.Correlation of cyclin D1 and E1 expression with bladder cancer presence,invasion,progression,and metastasis[J].Hum Pathol,2006,37(12):1568-1576.
[5] Yuan L,Gu X,Shao J,et al.Cyclin D1 G870A polymorphism is associated with risk and clinicopathologic characteristics of bladder cancer[J].DNA Cell Biol,2010,29(10):611-617.
[6] Lin DI,Lessie MD,Gladden AB,et al.Disruption of cyclin D1 nuclear export and proteolysis accelerates mammary carcinogenesis[J].Oncogene,2008,27(9):1231-1242.
[7] Tashiro E,Maruki H,Minato Y,et al.Overexpression of cyclin D1 contributes to malignancy by up-regulation of fibroblast growth factor receptor 1 via the pRB/E2F pathway[J].Cancer Res,2003,63(2):424-431.
[8] Yamada M,Hayashi K,Ikeda S,et al.Inhibitory activity of plant stilbene oligomers against DNA topoisomerase II[J].Biol Pharm Bull,2006,29(7):1504-1507.
[9] Hagiwara K,Kosaka N,Yoshioka Y,et al.Stilbene derivatives promote Ago2-dependent tumour-suppressive microRNA activity[J].Sci Rep,2012,2(3):314-322.
[10] Yafi FA,Duclos M,Correa JA,et al.Contemporary outcome and management of patients who had an aborted cystectomy due to unresectable bladder cancer[J].Urol Oncol,2011,29(3):309-313.
[11] Heighway J.HaeIII polymorphism within 3'untranslated region of PRAD1 [J].Nucleic Acids Res,1991,19(19):5451.
[12] Lee CC,Yamamoto S,Wanibuchi H,et al.Cyclin D1 overexpression in rat two-stage bladder carcinogenesis and its relationship with oncogenes,tumor suppressor genes,and cell proliferation [J].Cancer Res,1997,57(21):4765-4776.
[13] Kim JK,Diehl JA.Nuclear cyclin D1:an oncogenic driver in human cancer[J].J Cell Physiol,2009,220(2):292-296.
[14] Wagner U,Suess K,Luginbuhl T,et al.Cyclin D1 overexpression lacks prognostic significance in superficial urinary bladder cancer[J].J Pathol,1999,188(1):44-50.
[15] 曾文利.Cyclin D1在膀胱癌中的表達及意義[J].中國組織化學與細胞化學雜志,2011,20(4):354-357.
[16] Rajabi H,Ahmad R,Jin C,et al.MUC1-C oncoprotein induces TCF7L2 transcription factor activation and promotes cyclin D1 expression in human breast cancer cells[J].J Biol Chem,2012,287(13):10703-10713.
[17] Satinder K,Chander SR,Pushpinder K,et al.Cyclin D1(G870A)polymorphism and risk of cervix cancer:a case control study in north Indian population[J].Mol Cell Biochem,2008,315(1-2):151-157.
[18] 譚偉堅,張 林,仲 秋,等.宮頸上皮內瘤變及宮頸鱗癌中cyclinD1、Ki-67的表達及其意義[J].中國病理生理雜志,2010,26(2):390-392.
[19] Ogino S,Nosho K,Irahara N,et al.A cohort study of cyclin D1 expression and prognosis in 602 colon cancer cases[J].Clin Cancer Res,2009,15(13):4431-4438.
[20] Fleischmann A,Rocha C,Saxer-Sekulic N,et al.Highlevel cytoplasmic cyclin D1 expression in lymph node metastases from prostate cancer independently predicts early biochemical failure and death in surgically treated patients[J].Histopathology,2011,58(5):781-789.
[21] 劉 娟,殷 飛,姚樹坤.細胞周期素D1、視網膜母細胞瘤樣蛋白2及微小染色體維持蛋白7在肝細胞癌中的表達及對預后的意義[J].中國病理生理雜志,2011,27(2):304-309.
[22] Burnworth B,Popp S,Stark HJ,et al.Gain of 11q/cyclin D1 overexpression is an essential early step in skin cancer development and causes abnormal tissue organization and differentiation [J].Oncogene,2006,25(32):4399-4412.
[23] Li Z,Wang C,Jiao X,et al.Cyclin D1 regulates cellular migration through the inhibition of thrombospondin 1 and ROCK signaling [J].Mol Cell Biol,2006,26(11):4240-4256.
[24] Marzec M,Kasprzycka M,Lai R,et al.Mantle cell lymphoma cells express predominantly cyclin D1a isoform and are highly sensitive to selective inhibition of CDK4 kinase activity[J].Blood,2006,108(5):1744-1750.
[25] Huang H,Hu YD,Li N,et al.Inhibition of tumor growth and metastasis by non-small cell lung cancer cells transfected with cyclin D1-targeted siRNA[J].Oligonucleotides,2009,19(2):151-162.
[26] Meng H,Tian L,Zhou J,et al.PACSIN 2 represses cellular migration through direct association with cyclin D1 but not its alternate splice form cyclin D1b[J].Cell Cycle,2011,10(1):73-81.
[27] Yang K,Guo Y,Stacey WC,et al.Glycogen synthase kinase 3 has a limited role in cell cycle regulation of cyclin D1 levels[J].BMC Cell Biol,2006,7:33.

