山蘆桑顆粒劑的超聲提取工藝研究
趙曉曉, 蔡 宇, 蔡天革
(1.暨南大學(xué)藥學(xué)院,廣東廣州510632;2.遼寧大學(xué)生命科學(xué)學(xué)院,遼寧沈陽(yáng)110036)
山蘆桑顆粒劑由山藥、蘆根、桑椹、大棗等六味藥材組成,具有增強(qiáng)免疫的作用,其主要有效部位為多糖。本實(shí)驗(yàn)采用超聲提取方法提取該復(fù)方有效部位,為進(jìn)一步制備成顆粒劑提供基礎(chǔ);通過單因素試驗(yàn)及正交試驗(yàn)[1-2]優(yōu)選其提取工藝,采用苯酚-硫酸法[3]測(cè)定多糖量,以評(píng)價(jià)其提取工藝的合理性。
1 儀器與試劑
TU—1810S紫外-可見分光光度計(jì) (北京普析通用儀器有限公司);SHZ—D(Ⅲ)循環(huán)水式真空泵 (鞏義市英峪予華儀器廠);DZF—6050型真空干燥箱 (上海精宏設(shè)備有限公司);KQ—500E型超聲波清洗器 (昆山市超聲儀器有限公司);DLSB—5/10型低溫冷卻液循環(huán)泵 (鄭州長(zhǎng)城科工貿(mào)有限公司);EYELA型旋轉(zhuǎn)蒸發(fā)儀 (上海愛朗儀器有限公司);山藥、蘆根、桑椹、大棗等六味藥材均購(gòu)自廣州二天堂藥店;無(wú)水乙醇、丙酮等試劑均為分析純,水為純凈水。
2 實(shí)驗(yàn)方法
2.1 多糖的提取工藝 按處方量稱取藥材,加入一定量的水,超聲提取,合并提取液,離心 (3 600 r/min,15 min,4℃),取上清液濃縮至相對(duì)密度0.8,加入適量95%乙醇使含醇量達(dá)到75%,冰箱靜置過夜。過濾,沉淀分別用丙酮和無(wú)水乙醇交替洗滌,干燥,即得到粗多糖。
2.1.1 單因素試驗(yàn) 以該復(fù)方中多糖量為考察指標(biāo),分別考察超聲功率、加水量、提取時(shí)間、提取溫度對(duì)提取得到的多糖量的影響。
2.1.2 正交試驗(yàn) 根據(jù)單因素試驗(yàn)結(jié)果,確定正交試驗(yàn)因素水平,進(jìn)行正交試驗(yàn)。
2.2 多糖的測(cè)定
2.2.1 對(duì)照品溶液的配制 精密稱定已干燥的無(wú)水葡萄糖100 mg,置于100 mL量瓶中,加水溶解并定容至刻度。精密吸取5.0 m L于50 m L量瓶中,加水定容至刻度,即得0.1 mg/mL的對(duì)照品溶液。
2.2.2 5%苯酚溶液的配制 稱取苯酚5 g于100 mL棕色量瓶中,加水充分溶解并定容至刻度,即得。
2.2.3 供試品溶液的配制 精密稱定已干燥的粗多糖樣品10 mg于100 mL量瓶中,加水溶解并定容至刻度,即得供試品溶液。
2.2.4 最大吸收波長(zhǎng)的測(cè)定 精密吸取蒸餾水2.0 m L,加入5%苯酚溶液1.0 mL,迅速加入硫酸5.0 mL,搖勻,80℃水浴中加熱15 min,取出,冷卻,作為空白對(duì)照置于200~800 nm內(nèi)調(diào)零。精密吸取對(duì)照品溶液和供試品溶液,加水補(bǔ)至2.0 mL,同上操作,在200~800 nm波長(zhǎng)范圍內(nèi)掃描,供試品溶液和對(duì)照品溶液均在490 nm處有最大吸收,因此,最終確定最大吸收波長(zhǎng)為490 nm。
2.2.5 線性關(guān)系的考察 精密吸取對(duì)照品溶液0.2、0.4、0.6、0.8、1.0 m L共5份,分別置于10 mL量瓶中,加水補(bǔ)至2.0 mL,再加入5%苯酚溶液1.0 mL,搖勻,迅速加入硫酸5.0 mL,80℃加熱15 min,取出,冷卻至室溫。另以2.0 mL蒸餾水同上平衡操作作為空白對(duì)照,490 nm波長(zhǎng)處測(cè)定吸光度,得回歸方程:A=0.046 4 C+0.033 9,R2=0.999 1(n=5),線性范圍2.5~12.5μg/mL。
2.2.6 精密度實(shí)驗(yàn) 精密吸取對(duì)照品溶液0.4mL于10mL量瓶中,加水補(bǔ)至2.0 mL,按照2.2.5項(xiàng)下操作,重復(fù)測(cè)定6次,490 nm處測(cè)得吸光度值。經(jīng)計(jì)算,RSD為0.45%,表明儀器精密度良好。
2.2.7 樣品中多糖的測(cè)定 精密吸取供試品溶液0.8 mL于10 mL量瓶中,按2.2.5項(xiàng)下操作,490 nm處測(cè)定吸光度,將測(cè)得的吸光度代入線性方程,求得質(zhì)量濃度C,按以下公式計(jì)算多糖量:
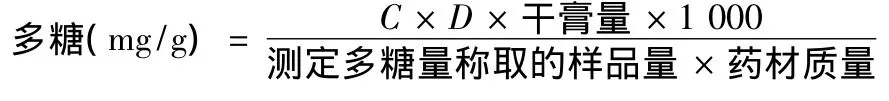
其中,D為稀釋倍數(shù)1 000,藥材量為69 g。
3 結(jié)果
3.1 單因素試驗(yàn)結(jié)果
3.1.1 超聲功率對(duì)多糖的影響 固定加水量12倍,提取溫度50℃,提取時(shí)間20 min,提取次數(shù)1次,考察不同功率 (200W、300 W、400 W、500 W)對(duì)多糖量的影響。
如圖1所示,隨著超聲功率的增加,提取得到的多糖量逐步增加。
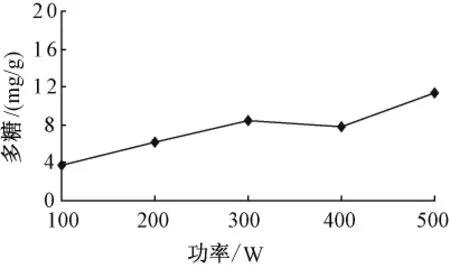
圖1 超聲功率對(duì)多糖的影響
3.1.2 加水量對(duì)多糖的影響 固定超聲功率300 W,提取溫度50℃,提取時(shí)間20 min,提取次數(shù)1次,考察不同的加水量 (6倍,9倍,12倍,15倍,18倍)對(duì)多糖量的影響。如圖2所示,隨著加水量的增加,多糖量逐步增加,加水量為15倍時(shí),多糖量最高,繼續(xù)增加加水量,多糖量反而下降。
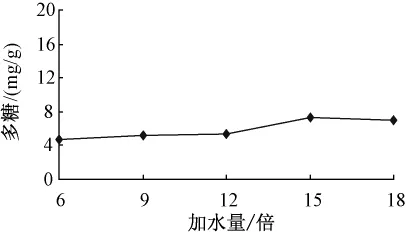
圖2 加水量對(duì)多糖的影響
3.1.3 溫度對(duì)多糖的影響 固定超聲功率300 W,加水量12倍,提取時(shí)間20 min,提取次數(shù)1次,考察不同的溫度 (40℃,50℃,60℃,70℃,80℃)對(duì)多糖量的影響。見圖3所示,隨著提取溫度的增加,多糖量逐步增加。
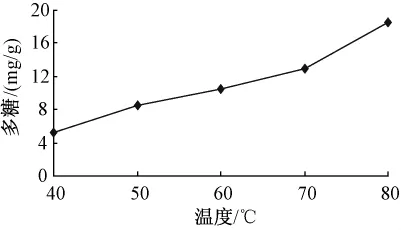
圖3 提取溫度對(duì)多糖的影響
3.1.4 時(shí)間對(duì)多糖的影響 固定超聲功率300 W,加水量12倍,提取溫度50℃,提取次數(shù)1次,考察不同的提取時(shí)間 (10 min,20 min,30 min,40 min,50 min)對(duì)多糖量的影響。見圖4所示,隨著提取時(shí)間的增加,多糖量逐步增加,當(dāng)提取時(shí)間為30 min時(shí),多糖量最高,繼續(xù)增加提取時(shí)間,多糖量下降。

圖4 提取時(shí)間對(duì)多糖量的影響
3.2 正交試驗(yàn)結(jié)果 根據(jù)單因素試驗(yàn)結(jié)果,確定正交試驗(yàn)因素水平,選用L9(34)正交表進(jìn)行正交試驗(yàn)。因素水平表見表1,正交試驗(yàn)結(jié)果見表2及表3。

表1 因素水平

表2 正交試驗(yàn)結(jié)果

表3 方差分析結(jié)果
由極差分析可知,因素的主次順序?yàn)镃>B>A,C(提取次數(shù))為主要影響因素,因素A(加水量)的影響較小;由方差分析可知,因素C具有顯著性差異。綜合極差分析和方差分析結(jié)果可知,超聲提取的最佳方案為A2B2C2,即15倍水提取2次,每次提取時(shí)間為30 min。
3.3 驗(yàn)證性實(shí)驗(yàn) 分別稱取藥材3份,按上述最佳方案進(jìn)行提取,并測(cè)定多糖量,實(shí)驗(yàn)結(jié)果表明,由上述確定的最佳方案提取該復(fù)方多糖量較高,該方案較穩(wěn)定。結(jié)果見表4。

表4 驗(yàn)證性實(shí)驗(yàn)結(jié)果
4 討論
多糖是一類天然大分子化合物,具有多種生物活性,如抗腫瘤活性、抗菌活性、降血脂作用、調(diào)節(jié)免疫等[4-7],因而受到國(guó)內(nèi)外許多學(xué)者的關(guān)注。多糖類物質(zhì)的提取方法較多,如熱水浸提法,酶提取法,超聲提取方法,微波輔助提取方法等[8-11]。其中,超聲提取方法是近年來(lái)常用于提取中草藥有效成分的新方法,其原理是利用超聲波的機(jī)械作用、熱學(xué)作用、空化作用等對(duì)植物細(xì)胞的破碎作用,加速植物有效成分的溶出、擴(kuò)散,具有省時(shí)、節(jié)能、操作簡(jiǎn)便、避免高溫對(duì)有效成分的破壞等優(yōu)點(diǎn)[12]。
山蘆桑顆粒劑是一種以多糖為主要有效部位的復(fù)方制劑,本實(shí)驗(yàn)采用苯酚-硫酸法測(cè)定多糖量,通過單因素試驗(yàn)及正交試驗(yàn)優(yōu)選其超聲提取工藝。其中,單因素試驗(yàn)以多糖量為考察指標(biāo),分別考察了超聲功率、加水量、提取時(shí)間、提取溫度對(duì)多糖提取效果的影響,考慮到成本和時(shí)間,提取次數(shù)一般不超過3次,因此未對(duì)提取次數(shù)進(jìn)行單因素考察。根據(jù)單因素試驗(yàn)結(jié)果,選用加水量、提取時(shí)間、提取次數(shù)為正交試驗(yàn)因素水平,超聲功率為500 W,提取溫度為80℃,進(jìn)行正交試驗(yàn)。對(duì)正交試驗(yàn)結(jié)果進(jìn)行極差分析可知,因素主次順序?yàn)镃>B>A,即提取次數(shù)>提取時(shí)間>加水量,提取次數(shù)對(duì)多糖量的影響最大,加水量的影響最小。由方差分析結(jié)果可知,因素C即提取次數(shù)具有顯著性差異,其余因素均無(wú)顯著性差異。為了節(jié)約濃縮時(shí)的成本,選擇A2,因此最佳提取方案為15倍水超聲提取2次,每次提取時(shí)間為30 min。
本實(shí)驗(yàn)研究確定了該復(fù)方制劑超聲提取的提取方法和相關(guān)條件,為其制備成顆粒劑提供了基礎(chǔ);但采用超聲提取方法超聲提取方法破碎了植物的細(xì)胞,加速了多糖的溶出、擴(kuò)散,故本提取方法提取出的雜質(zhì)也相應(yīng)增加,其中提取出的多糖經(jīng)過醇沉后仍含有少量單糖等雜質(zhì),還有待進(jìn)一步純化。參考文獻(xiàn):
[1]胡斌杰,王 芳,王方林,等.超聲法提取香菇多糖最佳工藝優(yōu)化研究[J].中成藥,2007,29(7):附4-附6.
[2]郝繼偉.超聲法提取蒙山松菇多糖的工藝研究[J].食品工業(yè)科技,2011,32(1):213-218.
[3]張 璐,翁立冬,劉 莉,等.苯酚-硫酸法測(cè)定烏梅多糖的含量[J].中國(guó)實(shí)驗(yàn)方劑學(xué)雜志,2011,17(6):107-109.
[4]Zhang M,Cui SW,Cheung PCK,etal.Antitumor polysaccharides from mushrooms:a review on their isolation process,structural characterisics and antitumor activity[J].Trends in Food Science& Technology,2007,18(1):4-19.
[5]Liu Nan,Chen Xiguang,Park Hyunjin,et al.Effect of MW and concentration of chitosan on antibacterial activity of Escherichia coli[J].Carbohydr Polym,2006,64(1):60-65.
[6]楊小紅,周遠(yuǎn)明,張 瑜.白首烏多糖降血脂作用研究[J].時(shí)珍國(guó)醫(yī)國(guó)藥,2010,21(6):1381-1382.
[7]董宏坡,江明樹,朱偉杰.化橘紅多糖對(duì)小鼠的免疫調(diào)節(jié)作用[J].中成藥,2010,32(3):491-493.
[8]楊 鑫,王鑫淼,高星燁,等.紅松松塔多糖提取工藝優(yōu)化及其含量測(cè)定[J].中成藥,2011,33(2):351-353.
[9]王巖巖,陳東海,車烈權(quán),等.纖維素酶提取枸杞多糖及工藝優(yōu)化[J].食品科技,2007(3):104-106.
[10]葉余原.超聲法提取鐵皮石斛多糖工藝的研究[J].中藥材,2009,32(4):617-620.
[11]覃逸明.微波法提取真姬菇多糖工藝研究[J].中成藥,2009,31(7):1134-1136.
[12]鄔方寧.超聲提取技術(shù)在現(xiàn)代中藥中的應(yīng)用[J].中草藥,2007,38(2):315-316.

