參附注射液對原代培養乳鼠心肌細胞缺氧-復氧損傷的影響
王建剛,田首元
參附注射液(Shen-fu injection,SFI)是臨床上常用的中藥,其主要藥理成分為人參皂苷和烏頭堿,對心肌缺血/再灌注損傷具有保護作用[1,2],但其作用機制還有待探討。本研究采用原代培養的心肌細胞建立缺氧/復氧(hypoxia/reoxygenation,H/R)損傷模型模擬體內缺血/再灌注損傷,研究SFI對體外培養的心肌細胞H/R損傷的保護作用,并對其作用機制進行探討。
1 材料與方法
1.1 主要試劑及儀器 參附注射液(批號:041105,雅安三九藥業有限公司),胎牛血清、低糖DMEM培養基、高糖DMEM培養基(Hyclone公司,美國),胰蛋白酶(Amresco公司,美國),倒置相差顯微鏡(Olympus Optical公司,日本),CO2恒溫細胞培養箱(Forma Scientific公司,美國)。5-溴-2-脫氧尿核苷(5-bromo-2-deoxyuridine,BrDU)。DXC800型全自動生化分析儀、Access2型免疫化學發光分析儀(Beckman公司,美國),超氧化物歧化酶(SOD)和丙二醛(MDA)試劑盒均購自南京建成生物工程研究所。EPICS Elite型流式細胞儀(Beckman coulter公司,美國)。
1.2 原代心肌細胞培養 取出生1d~3dWistar乳鼠,雌雄不限(山西醫科大學動物中心提供),75%酒精浸泡后,無菌條件下取其心臟置于預先盛有D-Hanks液的無菌平皿內,用含抗生素的D-Hanks灌沖洗兩遍。取心室肌剪碎至1mm3~2 mm3大小的組織塊,移入5 0mL離心管中,用適量預溫的0.125%胰蛋白酶和0.01%EDTA 37℃水浴震蕩分次消化,每次約8min,直至組織塊完全消化。收集除第1次以外的單細胞懸液,放入含有10%胎牛血清的DMEM培養液中,終止消化7目篩網過濾去除未消化的組織,在4℃時以1 000r/min離心10min,棄上清,收集沉淀,加入培養液(80%DMEM、20%胎牛血清、青霉素100U/mL、鏈霉素100U/mL和0.1mmol/L Br-DU)混懸。臺盼藍染色計數,調整細胞數至5×106/L。接種到25mL培養瓶中,置37℃培養箱(含95%空氣+5%CO2)中培養2h以純化心肌細胞(差速貼壁法)。接種到24孔培養板中,每24h觀察細胞貼壁及生長情況,并更換培養液。其中BrDU在細胞培養36h內加入以抑制非心肌細胞增殖。接種3d~4d后,用無血清的DMEM培養24h,使細胞周期同步化后行缺氧/復氧干預。
1.3 心肌細胞缺氧/復氧損傷模型建立 參照文獻[3]的方法以及具體實驗條件加以改進。上述原代培養的心肌細胞棄上清,換以經95%N2+5%CO2混合氣體飽和的低糖、無血清DMEM培養液,置于37℃密閉容器內(含95%N2+5%CO2混合氣體)缺氧1h后,取出更換為以95%空氣+5%CO2混合氣體飽和的高糖、含10%胎牛血清的DMEM培養液在37℃孵箱(含95%空氣+5%CO2)中復氧3h。
1.4 實驗分組 將培養的心肌細胞隨機分4組。正常對照組(C組):37℃孵箱中持續孵育4h,未經缺氧/復氧處理;缺氧/復氧損傷模型組(H/R組):給予培養的心肌細胞單純缺氧1h,復氧3h。缺氧/復氧+低劑量SFI組(SFI-L組):在缺氧前30 min加入終濃度為50μmol/mL的SFI,再缺氧1h/復氧3h;缺氧/復氧+高劑量SFI組(SFI-H組):在缺氧前30min加入終濃度為100μmol/mL的SFI,再缺氧1h,復氧3h。
1.5 觀察指標
1.5.1 上清液肌酸激酶同工酶(CK-MB)、心肌肌鈣蛋白I(cTn-I)含量測定 復氧末取細胞上清培養液,置-20℃ 冰箱保存批量待測。分別由Beckman DXC800全自動生化分析儀測定CK-MB含量,化學免疫發光法檢測cTn-I含量。
1.5.2 心肌細胞MDA含量和SOD活性的檢測 用硫代巴比妥法(TBA)測定MDA含量,采用黃嘌呤氧化酶法測定SOD活性。操作步驟按試劑盒說明書進行。
1.5.3 心肌細胞凋亡率測定 采用流式細胞儀檢測75%胰蛋白酶消化貼壁心肌細胞,消化分離后收集到試管中離心10min(1 000r/min),將細胞懸液用1mL空針抽吸兩遍制成單細胞懸液,懸于70%冷乙醇(4℃)過夜。檢測時離心10 min(1 000r/min),PBS洗去乙醇。細胞沉淀用PI 4℃避光染色30min,上機檢測。G期前的亞二倍體峰即代表凋亡峰,反映凋亡細胞的百分比。
1.6 統計學處理 采用SPSS 13.0統計軟件進行統計分析,計量資料以均數±標準差(±s)表示。組間比較采用單因素方差分析,兩兩間比較應用SNK-q檢驗,P<0.05為差異有統計學意義。
2 結 果
與C組比較,H/R組心肌細胞培養液CK-MB、cTn-I含量、心肌細胞內MDA含量以及凋亡指數顯著上升,SOD活性顯著下降 (P<0.01)。與 H/R 組 比 較,SFI-L 組、SFI-H 組 中除SOD活性顯著上升外,上述其他指標均顯著下降(P<0.01)。SFI-L組和SFI-H組比較,差異無統計學意義(P>0.05)。詳見表1。
表1 各組CK-MB、cTn-I、MDA含量、SOD活性及凋亡指數比較(±s)
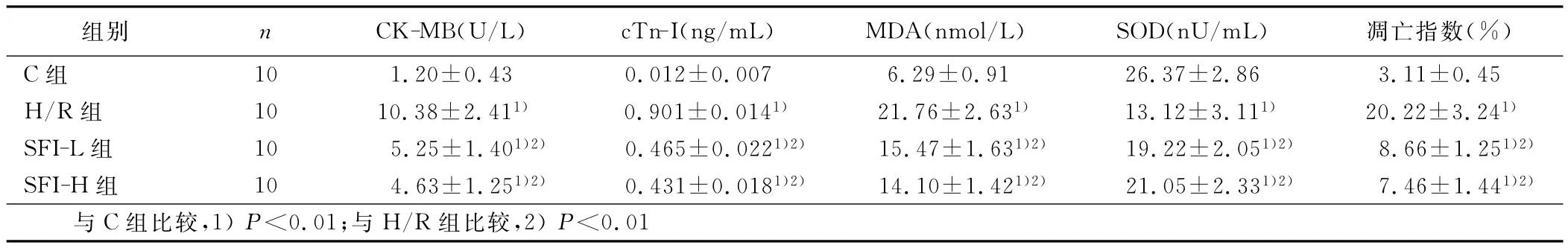
表1 各組CK-MB、cTn-I、MDA含量、SOD活性及凋亡指數比較(±s)
組別 n CK-MB(U/L) cTn-I(ng/mL) MDA(nmol/L) SOD(nU/mL) 凋亡指數(%)C組 10 1.20±0.43 0.012±0.007 6.29±0.91 26.37±2.86 3.11±0.45 H/R組 10 10.38±2.411) 0.901±0.0141) 21.76±2.631) 13.12±3.111) 20.22±3.241)SFI-L組 10 5.25±1.401)2) 0.465±0.0221)2) 15.47±1.631)2) 19.22±2.051)2) 8.66±1.251)2)SFI-H組 10 4.63±1.251)2) 0.431±0.0181)2) 14.10±1.421)2) 21.05±2.331)2) 7.46±1.441)2)與C組比較,1)P<0.01;與 H/R組比較,2)P<0.01
3 討 論
本研究所用SFI為臨床常用針劑型,結合以往研究及預實驗結果,選擇SFI濃度為50μmol/mL和100μmol/mL進行實驗[4,5]。CK-MB和cTn-I正常情況下存在于心肌細胞內,當心肌細胞受損或壞死后就溢出胞外,釋放水平愈高,則代表細胞損傷壞死愈重,是反映心肌損傷的特異性和敏感性均較高的指標[6,7]。本研究結果顯示,H/R組上清液CK-MB、cTn-I含量以及心肌細胞凋亡指數均較C組明顯升高,表明心肌細胞H/R損傷模型制備成功。
從結果可以看出,SFI組上清液CK-MB、cTn-I含量以及心肌細胞凋亡指數均較H/R組顯著下降,表明SFI可通過減少CK-MB和cTn-I的釋放,抑制心肌細胞凋亡,對H/R損傷心肌細胞產生保護作用。心肌細胞H/R損傷發生機制尚未完全闡明,目前認為主要通過黃嘌呤氧化酶途徑產生大量氧自由基聚集,介導膜脂質過氧化反應,使細胞膜流動性和通透性增加,完整性喪失,膜對離子轉運功能障礙,Na+、K+、Ca2+等離子在細胞膜內外分布異常致心肌細胞嚴重腫脹,線粒體功能受損,氧利用率降低。大量Ca2+涌入細胞導致Ca2+超載,通過加速黃嘌呤脫氫酶轉化為黃嘌呤氧化酶,促使氧自由基增多,進一步加重再灌注損傷[8,9]。MDA是氧自由基致脂質過氧化的中間代謝產物,可反映細胞機體內脂質過氧化程度,間接反映細胞受氧自由基攻擊的嚴重程度,SOD可清除機體內超氧自由基,保護細胞,因而SOD高低可間接反映機體清除氧自由基的能力[10,11]。本研究結果顯示,H/R可引起心肌細胞 MDA水平明顯上升而SOD活性明顯下降(P<0.01),SFI則能顯著抑制H/R所致的MDA水平上升和SOD活性下降(P<0.01),說明SFI是通過減少氧自由基產生,抑制機體內脂質過氧化程度,從而對心肌細胞產生保護作用。本研究中SFI選用了兩組濃度,結果顯示增加SFI濃度后心肌保護作用的增強并不具統計學意義。
綜上所述,SFI能顯著降低原代培養心肌細胞CK-MB、cTn-I含量,抑制心肌細胞凋亡,對心肌H/R損傷產生保護作用,其機制可能與提高心肌細胞SOD活性,減少MDA生成量,減輕脂質過氧化反應有關。
[1]曹俊,閔蘇.含不同濃度參附注射液的停跳液對兔離體心臟缺血再灌注損傷的保護作用[J].中華麻醉學雜志,2006,26(1):61-64.
[2]張軍,徐瑞好,周宛麗,等.參附注射液對心肺轉流后患者心肌缺血的保護作用[J].臨床麻醉學雜志,2006,22(5):345-346.
[3]伍靜,姚尚龍,楊艷,等.異丙酚對鼠心肌細胞缺氧/復氧損傷中的保護作用[J].中華麻醉學雜志,2002,22(6):373-374.
[4]張本靜,王焱林,王成夭.參附注射液對缺氧/復氧損傷心肌核因子-κB及腫瘤壞死因子-α、白介素-6的影響[J].中華急診醫學雜志,2007,16(1):42-45.
[5]羅明鳳,張三印,黃秀深,等.參附注射液和生脈注射液Ca2+-ATP酶影響的對比研究[J].天津中醫藥,2008,25(6):487-489.
[6]王萍,房秀生.心肌肌鈣蛋白I對體外循環期心肌損傷的判斷價值[J].中華麻醉學雜志,2000,20(5):265-269.
[7]Garcia C,Julier K,Bestmann L,etal.Preconditioning with sevoflurane decreases PECAM-1expression and improves oneyear cardiovascular outcome in coronary artery bypass graft surgery[J].Br J Anaesth,2005,94:159-165.
[8]Marczin N,El-Habashi N,Hoare GS,etal.Antioxidants in myocardial ischemia-reperfusion injury:Therapeutic potential and basic mechanisms[J].Arch Biochem Biophys,2003,420(2):222-236.
[9]Galagudza MM,Blokhin IO,Shmonin AA,etal.Reduction of myocardial ischemia-reperfusion injury with pre-and postconditioning:Molecular mechanisms and therapeutic targets[J].Cardiovasc Hematol Disord Drug Targets,2008,8(1):47-65.
[10]Lee WH.Influence of pemxynitrite on energy metabolism and cardiac function in a rat ischemia-repefusion model[J].Am J Physiol Heart Circ Physiol,2003,285(4):1385.
[11]Zheng CD,Min S.Cardioprotection of Shenfu Injection against myocardial ischemia/reperfusion injury in open heart surgery[J].Chin J Integr Med,2008,14(1):10-16.

