Pantoea ananatis G-14細菌胞外多糖的體外抗氧化活性及抗腫瘤活性研究
韓 蓓,羅文娟,于 燕,胡森科,張瑞娟*
1西安交通大學醫(yī)學院公共衛(wèi)生系;2陜西省營養(yǎng)與食品安全工程研究中心,西安 710061
多糖,也稱多聚糖(polysaccharide,PS),是一大類在自然界中廣泛存在的生物體所產生的具有多種活性的生物高分子。多數(shù)細菌在生長過程中可向環(huán)境分泌多糖,稱為胞外多糖(exopolysaccharide,EPS),其具有可溶性、可降解性、對人和環(huán)境無毒等特點,并且具有免疫調節(jié)、抗腫瘤、抗氧化、抗炎、抑菌等生理活性[1,2]。近年來,基于細菌胞外多糖的醫(yī)用價值和工業(yè)用途開發(fā)各種生物藥品、功能食品、食品添加劑、多糖疫苗等成為研究熱點。
本實驗室從水果樣品中分離出一株菠蘿泛菌Pantoea ananatis G-14,其高產胞外多糖。P.ananatis被認為是一種可以引起多種植物病害的植物病原細菌,其EPS的合成與該菌對植物的侵襲相關,而該菌及其EPS對人、畜并未顯示出毒害作用[3]。本研究對P.ananatis G-14胞外多糖進行了提取、分離,并對其體外抗氧化活性和抗腫瘤活性進行了分析,為進一步分離新的天然抗氧化劑及抑腫瘤活性物質提供了參考。
1 材料與方法
1.1 細菌及腫瘤細胞系
P.ananatis G-14為陜西省營養(yǎng)與食品安全工程研究中心微生物實驗室分離菌株(GenBank 16s rRNA登錄號為JN974457)[4],現(xiàn)保存于中國典型培養(yǎng)物保藏中心(保藏號為CCTCC M 2012107)。G-14的產多糖發(fā)酵培養(yǎng)基為1.5%蛋白胨,0.5%大豆胰蛋白胨,0.5%NaCl,1%葡萄糖),培養(yǎng)條件為30℃,通氣培養(yǎng)。
人乳腺癌細胞MCF-7為本實驗室保藏。
1.2 G-14產胞外多糖發(fā)酵條件優(yōu)化
分別研究了發(fā)酵時間、發(fā)酵溫度、培養(yǎng)基初始pH對G-14產胞外多糖的影響。基本培養(yǎng)條件為:搖瓶分批發(fā)酵,30℃,200 rpm通氣培養(yǎng),產多糖發(fā)酵培養(yǎng)基(見1.1),自然pH。
1.2.1 最適發(fā)酵時間
50 mL產多糖發(fā)酵培養(yǎng)基(自然pH=7.2)置于250 mL搖瓶中,30℃,200 rpm通氣培養(yǎng)G-14 96 h,其中每24 h取樣測定上清粗多糖濃度(采用苯酚-硫酸法測定[5])以及細菌濃度OD600,確定胞外多糖峰值出現(xiàn)的發(fā)酵時間點。
1.2.2 最佳發(fā)酵溫度
50 mL產多糖發(fā)酵培養(yǎng)基(自然pH=7.2)置于250 mL 搖瓶中,分別在 20、25、30、37、40、45 ℃,200 rpm通氣培養(yǎng)G-14至1.2.1確定的最適發(fā)酵時間,取樣測定上清粗多糖濃度,確定胞外多糖峰值出現(xiàn)的發(fā)酵溫度。
1.2.3 培養(yǎng)基最適初始pH
50 mL產多糖發(fā)酵培養(yǎng)基置于250 mL搖瓶中,利用1M HCl或NaOH 調節(jié)培養(yǎng)基 pH 至4.0、5.0、6.0、7.0、7.2、7.5、8.0、9.0,在 1.2.1 和 1.2.2 確定的最適發(fā)酵時間和最佳發(fā)酵溫度條件下培養(yǎng)G-14,確定胞外多糖峰值出現(xiàn)的培養(yǎng)劑最適初始pH。
1.3 胞外多糖的分離純化
G-14的過夜培養(yǎng)物以1%(V/V)轉接量轉接至搖瓶發(fā)酵培養(yǎng)基中(pH7.5),30 ℃,200 rpm,通氣培養(yǎng)72 h。10000 rpm,4℃,5 min離心除去發(fā)酵液中的菌體,上清中加入3倍體積的95%的預冷乙醇過夜沉淀;10000 rpm,4℃,10 min離心收集多糖沉淀,加入ddH2O溶解多糖,1∶3(V/V)加入Sevage試劑,混勻離心除蛋白,此步驟重復3~5次;EPS溶液在ddH2O透析72 h,最后將透析好的EPS溶液制成凍干粉,室溫干燥保存[2]。
1.4 體外抗氧化活性測定
1.4.1 還原活性
準確稱取20 mg EPS粉末,配置成5.0 mg/mL的EPS溶液。采用倍比稀釋法用雙蒸水將此EPS溶液稀釋成 5.0、2.5、1.25、0.6、0.3、0.15 mg/mL。反應體系包括1 mL不同濃度的EPS溶液,2.5 mL pH 6.6的磷酸鹽緩沖液,2.5 mL 1%鐵氰化鉀溶液,充分混勻,50℃反應20 min;再加入2.5 mL 10%的三氯乙酸,混勻,3000 rpm離心10 min,取上清2.5 mL,與2.5 mL 蒸餾水和 0.5 mL 0.1%FeCl3混勻,室溫反應5 min,測OD700。以維生素C(Vc)做陽性對照,ddH2O做陰性對照。以OD700值表示還原力,OD700值越高,還原力越強[5]。
1.4.2 清除DPPH自由基活性
采用1.4.1所述方法配制不同濃度的EPS溶液。取2 mL 40 mg/L DPPH溶液,分別與2 mL不同濃度的EPS溶液混勻,空白對照組加入2 mL雙蒸水;充分混勻后,避光、室溫反應30 min,測 OD517。以Vc做陽性對照,ddH2O做陰性對照。EPS清除DPPH自由基的能力由清除率反映,其計算公式如下,A0為空白對照的平均吸光度值,A1為樣品的平均吸光度值[5]。

1.4.3 清除羥自由基·OH活性
采用1.4.1所述方法配制不同濃度的EPS溶液。取2 mL EPS溶液,與2 mL 6 mM FeSO4溶液充分混勻,再分別加入2 mL 6 mM H2O2溶液,充分混勻,室溫反應30 min,測OD510。以Vc做陽性對照,ddH2O做陰性對照。EPS清除羥自由基的能力的由清除率反映,其計算公式如下,A0為空白對照的平均吸光度值,A1為樣品的平均吸光度值[5]。

采用1.4.1所述方法配制不同濃度的EPS溶液。25℃水浴中預熱4.5 mL 0.05 mol/L Tris-HCl(pH 8.2),然后分別加入1 mL不同濃度的EPS溶液,0.4 mL 25 mM鄰苯三酚溶液,充分混勻;25℃水浴反應5 min,加入8 mol/L的HCl 1 mL終止反應,測OD299。以Vc做陽性對照,ddH2O做陰性對照。EPS清除超氧陰離子的能力的由清除率反映,其計算公式如下,A0為空白對照的平均吸光度值,A1為樣品的平均吸光度值[5]。

1.4.5 抑制脂質過氧化活性
1∶40 稀釋的卵黃懸液 0.2 mL,25 mM Fe-7H2O 0.2 mL,5.0、2.5、1.25、0.6、0.3、0.15 mg/mL EPS各0.1 mL,與1.5 mL PBS混勻,37 ℃水浴孵育15 min,加入0.5 mL 20% 三氯乙酸終止反應。分別加入1.0 mL硫代巴比妥酸(TBA,0.8%)溶液,100℃水浴15 min,離心取上清測定 OD532。以ddH2O做陰性對照,樣品EPS對卵黃脂蛋白脂質過氧化的抑制率(%)如下計算[6]。

1.5 體外抑制腫瘤細胞增殖(MTT)實驗
將生長狀態(tài)良好,于對數(shù)期生長的MCF-7細胞以2×104接種于96孔板,過夜培養(yǎng)。然后加入0.3、0.6、1.2、3.5、5.25、7 mg/mL EPS,將細胞置37℃、5%CO2中培養(yǎng)48 h,取出腫瘤細胞進行MTT法檢測,每孔加入5 mg/mL MTT溶液(Fluka)20 μL,同樣條件下繼續(xù)培養(yǎng)4 h,取出,離心去上清,每孔加 DMSO(Merck)100 μL,輕柔混勻 5 min,測定每孔培養(yǎng)物OD490,以無菌ddH2O代替EPS作為陰性對照。每組設5個平行孔,每組實驗均重復三次。EPS對腫瘤細胞MCF-7的生長抑制率(%)=[(BA)/A×100%],其中 A為 EPS樣品處理孔的OD490,B為陰性對照孔的
2 結果與討論
2.1 G-14產胞外多糖的最適發(fā)酵條件
一般來講,細菌生長量越大,其此生代謝產物的濃度也會提高,通過測定OD540和上清 胞外多糖濃度,繪制了G-14在發(fā)酵培養(yǎng)基中培養(yǎng)96 h內的生長曲線與產多糖曲線(圖1A)。細菌細胞濃度峰值(OD600=2.8)和胞外多糖產量峰值(121 mg/L)出現(xiàn)的時間重合,都在72 h處,因此可初步確定P.ananatis G-14的產多糖發(fā)酵時間為72 h。該結果與Lee[7]報道的 Bacillus polymyxa KCTC 8648P 產胞外多糖,Raza[6]報道的 Paenibacillus polymyxa SQR-21產胞外多糖的情況一致。
接著我們繼續(xù)摸索了不同培養(yǎng)溫度下的細胞生長和產胞外多糖的情況,最大OD600值出現(xiàn)在30℃的發(fā)酵樣品中,且72 h發(fā)酵液中胞外多糖濃度曲線顯示,30℃的發(fā)酵樣品中的胞外多糖濃度最高,胞外多糖在30℃出現(xiàn)明顯的峰值(圖1B)。據(jù)此可進一步確定P.ananatis G-14的產多糖發(fā)酵最適溫度為30℃。
培養(yǎng)基的初始pH對細胞的生長、營養(yǎng)成分的吸收、各種代謝產物的合成等均有重要的作用,對EPS的合成也不例外,細胞在最適的pH條件下才能迅速生長,并進行相應的代謝[1]。對G-14來講,產胞外多糖的最佳培養(yǎng)基的初始 pH為7.5(圖1C),該結果與 Bacillus polymyxa KCTC 8648P產EPS的最佳培養(yǎng)基的初始pH相同[13]。
2.2 G-14胞外多糖的分離純化
G-14菌株在產糖發(fā)酵固體培養(yǎng)基上的菌苔呈黃色、光滑、濕潤、飽滿(圖2)。
在最佳產糖發(fā)酵條件下(培養(yǎng)基初始pH7.5,30℃,200 rpm通氣培養(yǎng)72 h)進行G-14的產糖發(fā)酵,發(fā)酵液72 h OD600為3.4,上清EPS濃度為129 mg/L。發(fā)酵液上清經(jīng)過濃縮、沉淀、除蛋白、透析后得到P.ananatis G-14胞外多糖粗提多糖干粉。

圖2 P.ananatis G-14在產多糖固體培養(yǎng)基上的生長Fig.2 The growth of P.ananatis G-14 on the solid medium for exopolysaccharide production
2.3 G-14胞外多糖的體外抗氧化作用
2.3.1 G-14胞外多糖的還原能力
抗氧化劑的抗氧化活性有不同的作用機制,包括抑制氧化作用鏈式反應的起始,分解過氧化物,清除自由基,作為金屬離子螯合劑等[8]。還原能力是衡量抗氧化能力的一個重要指標,抗氧化劑通過自身給出電子來清除自由基,還原力越強,抗氧化性越強。圖3可以看出,P.ananatis G-14胞外多糖具有一定的還原能力,且還原能力隨多糖濃度的增加而增加,還原能力與多糖濃度之間存在的顯著的量效關系,但是G-14多糖還原能力低于同濃度的Vc,5 mg/mL EPS的還原力為0.51,約為相同濃度Vc的還原力的1/4(2.1)。
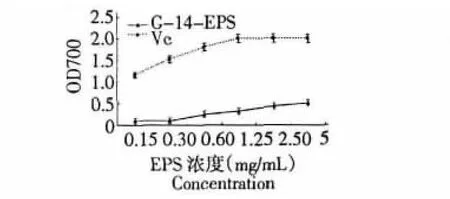
圖3 P.ananatis G-14胞外多糖的體外還原能力,實線代表G-14胞外多糖,虛線代表VcFig.3 Reducing power of P.ananatis G-14 EPS.The solid line was G-14 EPS;the dotted line was Vc
2.3.2 清除DPPH自由基活性
DPPH·(1,1-二苯基-2-苦基肼自由基)是一種很穩(wěn)定的以氮原子為中心的自由基,帶有孤對電子,其乙醇溶液呈深紫色并在517 nm處有強吸收,氫基供體或其它電子供體(比如胞外多糖羥基上的氫),可與DPPH·單電子配對而使其深紫色消失或變淺,并可通過測定吸光度得減弱程度評價抗氧化劑得活性[8]。隨著多糖濃度的增加,其對DPPH·的清除能力也逐漸在增強(表1),在0.15 mg/mL時,EPS對DPPH·的清除率僅為5%,2.5 mg/mL時,清除率達28%,在5 mg/mL時,清除率達48%,對自由基的清除效果表現(xiàn)出濃度依賴性,且這種依賴性在EPS濃度低于2.5 mg/mL時尤為顯著。
2.3.3 G-14胞外多糖清除羥自由基·OH活性
羥基自由基(·OH)被公認是生物系統(tǒng)中最具活性的活性氧化物,能導致生物體內DNA,蛋白質和脂質氧化等的不可逆損傷。羥自由基的有效清除程度可以反映機體抵御疾病的能力。P.ananatis G-14胞外多糖對羥基自由基有一定的清除作用(表1),5.0、2.5、1.25、0.6、0.3、0.15 mg/mL EPS 作用下,反應體系中羥基自由基清除率分別為60.4%、38.7%、20.8%、10.5%、8.0%和5.7%,EPS 對羥基自由基清除率具有顯著的濃度依賴性。目前對于胞外多糖清除羥基自由基的機制還不是非常清楚,有研究稱其可能與O-H鍵的解離能有關[9]。
2.3.5 G-14胞外多糖抑制脂質過氧化活性
脂質過氧化是機體產生的自由基對機體造成損傷的重要途徑之一,該過程可直接干擾和破壞膜的生物功能,許多導致羥自由基增多的因素、紫外輻射都會誘導脂質過氧化,進而誘發(fā)一系列疾病[1]。以卵黃脂蛋白為反應底物的檢測體系主要是通過檢測脂質過氧化中間產物MDA的水平來評價脂質過氧化程度[11],表 1的實驗結果顯示,P.ananatis G-14胞外多糖具有較高的脂質過氧化抑制作用,從0.15 mg/mL到0.6 mg/mL時,脂質過氧化抑制作用隨多糖的濃度增加而顯著增加,當多糖濃度高于1.25 mg/mL時,抑制作用趨于平穩(wěn),在5 mg/mL時,抑制 作用可達35.8%。
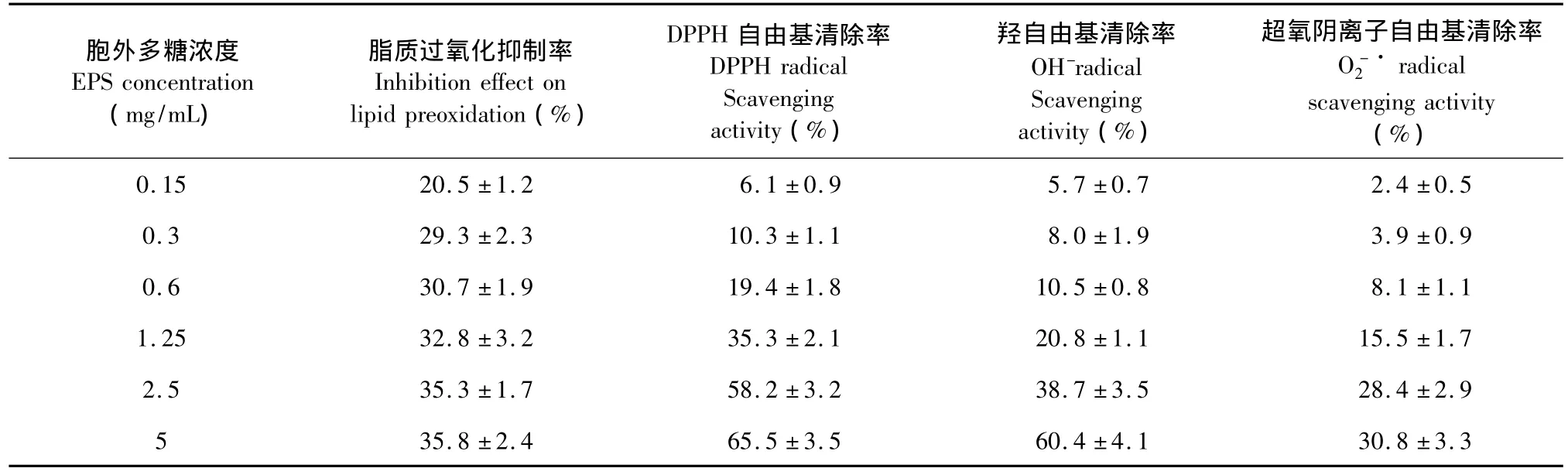
表1 P.ananatis G-14胞外多糖的體外抗氧化活性Table 1 In vitro antioxidant activity of P.ananatis G-14 EPS
2.4 G-14胞外多糖對乳腺癌細胞MCF-7的抑制作用
近年來有很多研究證實細菌的胞外多糖對人腫瘤細胞的增殖具有一定的抑制作用[2],因此越來越多的研究集中在這類天然物質中獲取抗腫瘤成分。本研究以人乳腺癌細胞MCF-7為目標,初步檢測了不同濃度的P.ananatis G-14粗提胞外多糖對其增殖的抑制作用,結果見圖4。G-14的EPS對MCF-7增殖具有一定的抑制作用,而且抑制作用在0.3~7 mg/mL的EPS作用濃度范圍內呈現(xiàn)出濃度相關性,其最高抑制率為69%。大量的體內動物實驗證明多糖主要通過增強機體的免疫系統(tǒng)來抑制動物的腫瘤模型,有研究推測細菌的胞外多糖可能對免疫細胞表面受體具有特異的親和性,從而表現(xiàn)出對腫瘤細胞增殖的抑制作用,而非直接的細胞毒性[11]。目前對多糖結構的研究多集中在初級結構,對其空間構象等的結構測試較少,因此就多糖抗腫瘤活性而言,需要深入研究研究多糖的抗腫瘤構效關系,并通過分子修飾等提高其活性,對該類天然物質充分利用,開發(fā)出新型抗腫瘤藥物。

圖4 P.ananatis G-14胞外多糖對腫瘤細胞MCF-7增殖的濃度依賴性抑制作用Fig.4 Dose-dependent effect of P.ananatis G-14 EPS on the growth of MCF-7
3 結論
綜上可知,P.ananatis G-14粗提胞外多糖具有較明顯的體外抗氧化活性,尤其是清除DPPH自由基和羥自由基,同時該胞外多糖對人乳腺癌細胞MCF-7的增殖具有顯著的抑制作用,今后有必要對P.ananatis G-14粗提胞外多糖進行進一步分離純化,獲得有效活性的物質,并深入研究其抑制腫瘤細胞增殖的作用機理,為拓展新的抗腫瘤藥物的范圍提出新的研究思路。
1 Shih IL.Microbial exo-polysaccharides for biomedical applications.Mini-Rev Med Chem,2010,10:1345-1355.
2 Zhang M,Chen H,Huang J,et al.Effect of Lycium barbarum polysaccharide on human hepatoma QGY7703 cells:Inhibition of proliferation and induction of apoptosis.Life Sci,2005,76:2115-2124.
3 Coutinho TA,Venter SN.Pantoea ananatis:an unconventional plant pathogen.Mol Plant Pathol,2009,10:325-335.
4 Han B(韓蓓),Liang H(梁歡),F(xiàn)u GM(付桂明),et al.Antibiotic resistance analysis and the AR gene transfer in non-pathogens in isolated from ready-to-eat food.Chin J Food Hygiene(中國食品衛(wèi)生雜志),2012,24:412-416.
5 Xu CL(徐春蘭),Qin CG(欽傳光),Niu WN(牛衛(wèi)寧),et al.Antioxidative activity of exopolysaccharide produced by Enterobacter cloacae Z0206.Nat Prod Res Dev(天然產物研究與開發(fā)),2010,22:1098-1102.
6 Raza W,Makeen K,Wang Y,et al.Optimization,purification,characterization and antioxidant activity of an extracellular polysaccharide produced by Paenibacillus polymyxa SQR-21.Bioresour Technol,2011,102:6095-6103.
7 Lee IY,Seo WT,Kim GJ,et al.Optimization of fermentation conditions for production of exopolysaccharide by Bacillus polymyxa.Bioprocess Eng,1997,16:71-75.
8 Liu L,Luo JG,Ye H,et al.Preparation,antioxidant and antitumor activities in vitro of different derivatives of levan from endophytic bacterium Paenibacillu polymyxa EJS-3.Food Chem Toxicol,2012,50:767-772.
9 Tsiapali E,Whaley S,Kalbfleisch J,et al.Glucans exhibit weak antioxidant activity,but stimulate macrophage free radical activity.Free Radic Bio Med,2001,30:393-402.
10 Xu RH,Shang N,Li PL.In vitro and in vivo antioxidant activity of exopolysaccharide fractions from Bifidobacterium animalis RH.Anaerobe,2011,17:226-231.
11 Rice PJ,Kelley JL,Kogan G,et al.Human monocyte scavenger receptors are pattern recognition receptors for(1-->3)-beta-D-glucans.J Leukoc Biol,2002,72:140-146.

