網織紅細胞血紅蛋白量和低色素紅細胞百分比檢測在孕婦缺鐵性貧血篩檢中的作用
蔡 眉,費新娣
(上海交通大學醫學院附屬中國福利會國際和平婦幼保健院,上海 200030)
妊娠早期貧血會引起胎盤激素的釋放,例如促腎上腺皮質激素(ACTH)和皮質醇(cortisol),繼而引發子宮收縮并阻斷胰島生長素(IGF)的釋放,IGF是胎兒生長發育重要的合成代謝激素。貧血和缺氧也可影響胎盤的生長發育,例如非正常的胚胎滋養層入侵和組織缺氧因子(HIF)的釋放[1]。
貧血患者循環血量的減少而導致早產、低體重兒出生率增高或最終增加產后輸血的幾率[2]。妊娠早期貧血以缺鐵性貧血(IDA)最常見。骨髓鐵染色是診斷鐵缺乏的金標準,但具創傷性且存在取樣誤差,不易被孕婦本人及家屬接受[3],臨床上對于缺鐵的篩查,傳統方法主要依賴于常規血液學參數和鐵代謝指標,但是鐵蛋白等生化指標的檢測較昂貴、費時,影響因素較多,結果具有一定的局限性。近年來,隨著全自動血液分析系統的不斷更新,具備網織紅細胞(RET)流式細胞儀法可檢測網織紅細胞血紅蛋白含量(CHr)和低色素性紅細胞百分率(Hypo%)。CHr的檢測被認為是早期診斷鐵缺乏敏感、特異的指標,而國內對Hypo%的研究較少,我們在結合傳統IDA診斷指標的基礎上,對CHr和Hypo%進行重點實驗以探討兩者在單獨及聯合試驗中對IDA的診斷意義。
材料和方法
一、研究對象
研究對象為上海交通大學醫學院附屬國際和平婦幼保健院2008年10月至2009年1月門診產科初診孕婦(孕周12~16周),在本院均經心電圖、B超、實驗室檢查無異常者(肝、腎功能、血糖正常,甲、乙、丙、戊肝炎病毒指標陰性、抗體除外,血常規白細胞(WBC)計數(4.0~10.0)×109/L且中性粒細胞百分比50% ~70%,血小板(PLT)計數(100~300)×109/L,年齡21~40歲。
1.貧血組 貧血患者Hb<110 g/L為238例。其中:(1)IDA孕婦組(妊娠期Hb<110 g/L和血清鐵<10.7 μmol/L的孕婦):78例。妊娠期IDA診斷標準參照《婦產科學》國內標準及《全國臨床檢驗操作規程》(第3版):Hb<110 g/L、血清鐵(SI)<10.7 μmol/L及外周血涂片見紅細胞(RBC)有小細胞低色素性改變,具有明確的缺鐵原因。排除基礎性疾病及腫瘤等慢性貧血患者;(2)非IDA孕婦組(妊娠期Hb<110 g/L和SI≥10.7 μmol/L):160 例。
2.正常孕婦組 妊娠期 Hb≥110 g/L,SI≥10.7 μmol/L 共 100 例。
二、實驗方法
1.血標本采集和處理 (1)乙二胺四乙酸二鉀(EDTA-K2)抗凝血:用抗凝劑EDTA-K2真空試管(江蘇康健醫療用品有限公司,規格13×75 mm)空腹采集靜脈全血2 ml,EDTA-K2濃度為1.8 ~2.2 mg/mL,輕輕顛倒混勻8~10 次;室溫3 h內完成全血細胞計數及CHr測定;余樣6 h內以Hb及 SI對IDA的臨界值制備血涂片;(2)血清:用無添加的真空試管(江蘇康健醫療用品有限公司,規格13×100 mm)空腹采集靜脈全血5 mL,置室溫 1.5~2 h完全凝固后,以 3500~4000×g離心5 min,分離血清,6 h完成血清鐵的測定。
2.檢測儀器和試劑 (1)ADVIA2120血液分析儀(德國BAYER醫療診斷設備有限公司生產);標準品(德國BAYER醫療診斷設備有限公司生產)、質控品(上海市臨床檢驗中心質控品及儀器配套全血五分類質控品)和配套試劑(德國BAYER醫療診斷設備有限公司生產);(2)日立7180全自動生化儀(日本日立公司生產),標準品及質控品(美國德靈診療用品公司生產);SI試劑盒(英國朗道 RANDOX公司生產);(3)瑞-吉(Wright-Giemsa)染色液(珠海貝索生物技術有限公司提供);(4)光學顯微鏡:OLYMPUS光學顯微鏡,型號CX-41(日本奧林巴斯集團提供)。
3.檢測方法 (1)全血細胞計數及CHr測定:ADVIA2120血液分析儀每半年由廠家統一校準,并進行校準驗證;在校準有效期內參加上海市臨床檢驗中心的全市室間質量評價,結果合格。每日檢測臨床標本前采用上海市臨床檢驗中心及儀器配套質控品進行室內質量控制,標本嚴格按照儀器操作規程進行檢測。對于儀器報警、檢測結果有各種異常的標本進行重復測定,必要時鏡檢復核。各項血細胞檢測參數包括CHr、RBC、Hb、Hypo%、平均紅細胞體積(MCV)、平均紅細胞血紅蛋白(MCH)、平均紅細胞血紅蛋白濃度(MCHC)、紅細胞分布寬度(RDW)、網織紅細胞百分比(Ret%);(2)SI測定:日立7180全自動生化儀每年由廠家統一校準,并進行校準驗證;在校準有效期內參加上海市臨床檢驗中心的全市室間質量評價,結果合格。每日檢測臨床標本前采用高、低兩質控品進行室內質量控制。標本嚴格按照儀器操作規程進行檢測;(3)血涂片檢查:具有臨床檢驗中級任職資質并在血常規崗位超過10年的工作人員,按《全國臨床檢驗操作規程》(第3版)的要求以抗凝全血制備1張良好的血涂片,進行瑞特染色,自然干燥后用高倍鏡(必要時油鏡)觀察RBC形態,統計低色素小紅細胞的百分比(約觀察500個RBC)。參照《全國臨床檢驗操作規程》(第3版)的標準,以RBC大小不均,小細胞為主,有明顯的中心淡染區擴大來判斷異常RBC的形態和數量。
三、統計學方法
結 果
一、全血RBC參數測定結果
IDA 組的 RBC、Hb、Hypo%、MCV、MCHC、MCH、RDW與非IDA組和正常孕婦組比較差異有統計學意義(P均<0.05)。非IDA組Hypo%、MCH、Hb與正常孕婦組比較差異有統計學意義(P均<0.05);其余項目2組間差異無統計學意義(P >0.05),見表1。
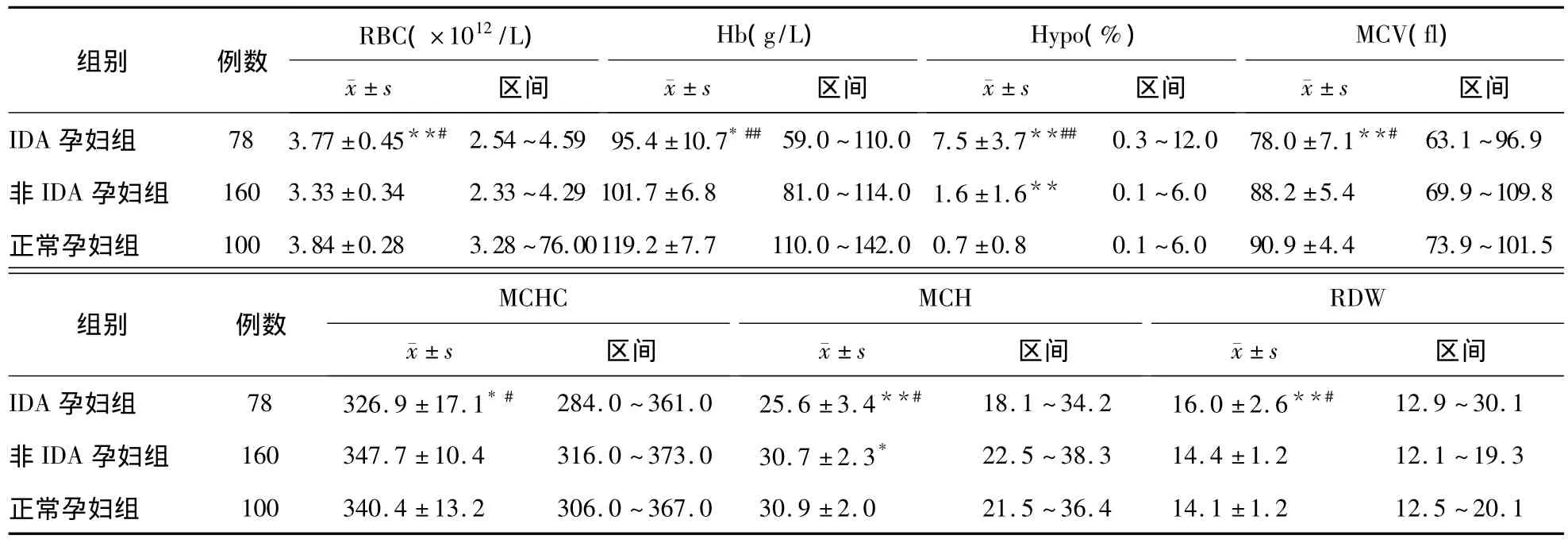
表1 3組RBC參數檢測結果比較
二、各組CHr、Ret%及SI結果比較
IDA組的CHr、SI均低于非IDA組及正常孕婦組(P<0.001);非IDA組3項指標與正常孕婦組比較差異均無統計學意義(P>0.05)。Ret%3組間差異均無統計學意義(P>0.05),見表2。

表2 3組CHr、SI和Ret%檢測結果比較
三、各參數不同臨界值對IDA的診斷效率
按照《婦產科學》國內標準及《全國臨床檢驗操作規程》(第 3版)選擇 CHr、Hypo%、RDW、MCV、MCH臨界值并計算各參數對IDA的診斷效率。結果顯示在CHr<29.0 Pg對IDA的診斷靈敏度為81%,特異性93%,診斷效率89.3%;在Hypo%≥6%分別為78%和95%,診斷效率為89.5%,略高于CHr。同時符合兩者條件時靈敏度72%,而特異性高達99%,大大提高診斷的準確性。MCV、MCH、RDW三者靈敏度均明顯低于CHr和Hypo%。診斷特異性除RDW外,其余參數與CHr和Hypo%無差異。CHr的臨界值越低,其靈敏度越低,特異性越高;Hypo%的臨界值越高,其靈敏度越低,特異性越高,在Hypo%≥8%時其特異性達到100%。
四、血涂片檢查結果
選擇 Hb<110 g/L 和 SI<10.7 μmol/L 的標本共100例,用高倍鏡(必要時油鏡)觀察RBC形態,其中有78例標本鏡下顯示RBC形態明顯大小不均,小細胞為多見,約占40% ~85%且有明顯的中心淡染區擴大,此78例定為IDA組;選擇Hb<110g/L和 SI≥10.7μmol/L的標本共 170例,其中160例鏡下RBC形態無明顯異常,余下10例鏡下RBC形態大小不一,此160例定為NIDA 組;選擇 Hb≥110g/L 和 SI≥10.7μmol/L的標本共100例,鏡下RBC形態均無明顯異常,此100例為正常對照組。
五.ROC曲線
以靈敏度為縱坐標,特異性為橫坐標,給出了各種參數在曲線下的面積(W)和標準誤(SE)。ROC曲線面積最大者為Hypo%,W=0.933,標準誤 SE=0.019,P < 0.0001;其次為 CHr,W=0.929,標準誤 SE=0.019,P <0.0001;MCV 為 W=0.911,SE=0.021,P < 0.0001;MCH、MCV、RDW 均為 W=0.778,SE=0.031,P < 0.0001,ROC曲線見圖1~2。

圖1 CHr、MCV、MCH 診斷孕婦IDA的ROC曲線分析
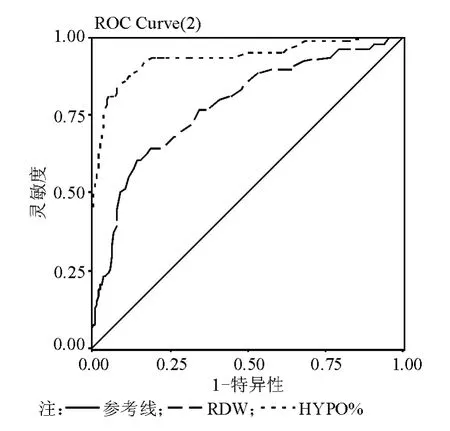
圖2 Hypo%、RDW診斷孕婦IDA的ROC曲線分析
討 論
IDA的定義是正常人體內的儲存鐵缺乏或超出需求引起的血細胞容積持續性降低而導致的Hb濃度下降,屬小細胞低色素性貧血,是最常見的營養缺如之一[4]。妊娠期IDA是由于胎兒生長發育及妊娠期血容量的增加,對鐵的需要量增加,孕婦對鐵攝取不足或吸收不良所引起。正常成年婦女體內鐵總量在2~2.5 g,一般儲存的有效鐵為300 mg,懷孕后增至1 g,其中包括胎兒和胎盤所需的300 mg以及排泄掉的200 mg,另外懷孕期血容量平均擴充至50%,世界衛生組織(WHO)建議在孕早期需額外補充60 mg/d的鐵劑預防IDA的發生[4]。缺鐵過程分3個階段,首先鐵缺少但Hb仍處于正常水平(鐵缺乏ID);隨著鐵進一步缺少,Hb水平開始降低但紅細胞壓積仍保持正常(缺鐵性紅細胞生成期IDE);最后導致IDA的發生。孕婦IDA的發生率與所處的社會經濟、營養保健有密切關聯,發達國家約有19%~44%的孕婦鐵缺乏但Hb仍處于正常水平,6% ~28%的孕婦患有IDA;發展中國家高達75%的孕婦患有IDA。妊娠期IDA也可能與早孕反應惡心嘔吐等原因有關,因飲食受限,鐵的吸收量減少;同時胃腸道功能差,沒有及時增加含鐵食物或者適當補充鐵劑所引起,或者也有遺傳的因素等[4]。
臨床上對于缺鐵的篩查,傳統方法主要依賴于常規血液學參數和鐵代謝指標,骨髓鐵染色是診斷鐵缺乏的金標準[3],但具創傷性,不易被孕婦接受,不能作為常規診斷指標使用。傳統RBC指標如MCV、MCH、MCHC在患者可能發生貧血甚至已經發生時仍然沒有變化或變化很小。由于成熟RBC生存時間約120 d,每天約20 mL RBC被更新(相當于血循環的1%),限制了RBC各項指標(如MCV、MCH、MCHC)及時反應其活性變化的能力,如MCV是平均紅細胞體積,小體積RBC要達到一定比例才足以明顯影響這個指標[9],因此,僅根據 Hb、MCV、MCH、MCHC 極易漏診早期鐵缺乏。目前實驗室推薦有血清鐵蛋白(SF)、轉鐵蛋白(sTfR)、SI、CHr、Hypo% 的檢測,然而在某些情況下如潛在感染,SF本身是急性時相反應的標志物,生理變異較大,且易受感染、炎癥、肝臟疾病以及腫瘤多種因素影響,懷孕階段SF與其他鐵參數相關性不好。本實驗研究重點是CHr和Hypo在孕期IDA時的改變。CHr比RET濃度和體積更穩定,隨著RET成熟其體積會縮小,Hb濃度也會隨著體積的減小而增加,但RET Hb含量變化很小[5],CHr是鐵缺乏早期敏感指標,與Hb含量相關性好,本研究Hb和CHr的(r=0.516,P <0.001),也印證了這一關系。Hypo在已經缺鐵但還未發生貧血時就開始增加[6],長期鐵缺乏會緩慢刺激RBC使細胞內Hb濃度下降,形成低色素性RBC,而且Hypo增加不受其他因素(例如感染或炎癥)干擾[7],當Hb含量降低時,Hypo%會增加,與Hgb含量呈負相關。Bayer ADVIA2120血液分析儀通過專用鞘流系統檢測參數CHr和Hypo%,兩者可用于臨床評估制造RBC的鐵含量,監測鐵及促RBC生成素(EPO)治療進展,以及腎性貧血缺鐵診斷。尤其是Hypo%參數已被美國腎臟病與透析患者生存質量指導指南收錄并推薦其作為診斷IDA的檢測指標。
實驗結果顯示,當 CHr<29.0 pg時,其靈敏度為80%略高于Hypo%≥6%的表現78%;其特異性93%略低于Hypo%≥6%的95%;同時滿足兩者條件,靈敏度下降至73%,但特異性提高到99%,其余指標MCV,MCH,RDW的靈敏度和特異性均不如CHr和Hypo%的改變,說明兩者可作為IDA的輔助診斷指標。以不同臨界值計算,兩者敏感性都不很高,但在Hypo%≥8%時特異性可達100%。國外文獻報道有學者傾向首選CHr用于篩檢IDA,有的則注重Hypo%,將兩者聯合起來的文章較少報道。國內多關注CHr而較少提及Hypo%。本研究結果認為參數Hypo%在篩檢IDA時的作用并不亞于CHr,甚至其診斷效率還略優于CHr。瑞士學者 A.Krafft[7]明確闡述過 Hypo 可以作為IDA篩選的首選指標,意大利學者Nicola Tessitore[8]認為在Hypo% >10%時診斷IDA有絕對特異性,應首選指標Hypo%。而本實驗結果Hypo%≥8%時特異性頗高,可明確輔助診斷IDA,并顯示Hgb和Hypo%呈負相關(r=-0.512,P<0.001);CHr和 Hypo%也呈良好負相關(r=-0.773,P <0.001)。
由于實驗例數有限,在結果統計上沒有很好的達到預期效果。另外在收集原始資料時,沒有對初診孕婦做到詳細詢問,譬如在抽血前一段時間內的飲食情況,或者是否在妊娠早期或準備懷孕之前補充過鐵劑等,可能會影響檢測結果(尤其是SI),出現Hb和CHr明顯下降,Hypo%明顯上升,但SI含量仍然正常甚至很高的現象。在本實驗N-IDA組160例中,有4例這樣的情況,但是例數很少不足以說明問題。另外,鑒于我們暫不開展針對鐵缺乏試驗特異性高的生化指標如SF、sTfR等測定,在某種程度上可能影響我們實驗分組的準確性,盡管SF不夠穩定,但到目前為止其仍然是IDA的確診試驗之一。國內北京協和醫院血液科李淑蘭等[3]研究顯示在 CHr<29.0 pg時其靈敏為93.3%,特異性為86.7%,與本實驗CHr<29.0 pg的靈敏度80%和特異性93%有一定差異,這可能與研究對象不同和判斷IDA標準不同有關(北京協和醫院的研究對象是血液科患者、IDA判斷標準是RBC系統參數及SF;本實驗研究對象是早孕婦女、IDA判斷標準是RBC系統參數及SI)。需要指出的是,參數Hypo%測定對溫度,標本放置時間要求較高(一般要求3 h內測定,否則可能會引起血細胞體積變化而影響Hb濃度,繼而干擾低色素紅細胞檢測[8]),而且只能在Bayer ADVIA系列儀器上進行檢測,國內ADVIA儀器很少應用于檢驗科,所以極大限制了其臨床應用。目前為止,國內參考文獻較少查閱到關于針對參數Hypo%的實驗與分析,我們的實驗結果缺少與國內同行橫向比較,懇請各位同行提出寶貴建議。
[1]Breymann C.Iron deficiency and anaemia in pregnancy:modern aspects of diagnosis and therapy[J].Blood Cells Mol Dis,2005,29(3):506-516.
[2]Engmann C,Adanu R,Lu TS,et al.Anemia and iron deficiency in pregnant Ghanaian women from urban areas[J].Int J Gynecol Obstet,2008,101(1):62-66.
[3]李淑蘭,辛麗亞,張 立,等.CHr在缺鐵性貧血中的診斷意義[J].中國實驗診斷學,2009,13(7):930-931.
[4]Bashiri A,Burstein E,Sheiner E.Anemia during pregnancy and treatment with intravenous iron:review of the literature[J].Eur J Obstet Gynecol Reprod Biol,2003,110(1):2-7.
[5]Luo D,Chen Y,Wu W,et al.Reticulocyte hemoglobin content in the diagnosis of iron deficiency in Chinese pre-menopausal women[J].Chin Med J,2007,120(11):1010-1012.
[6]Ervasti M,Sankilampi U,Heinonen S,et al.Novel red cell Indices indicating reduced availability of iron are associated with high erythropoietin concentration and low ph level in the venous cord blood of newborns[J].Pediatr Res,2008,64(2):135-140.
[7]Krafft A,Huch R,Breymann C.Impact of parturition on iron status in nonanaemic iron deficiency[J].Eur J Clin Invest,2003,33(10):919-923.
[8]Tessitore N,Solero GP,Lippi G,et al.The role of iron status markers in predicting response to intravenous iron in haemodialysis patients on maintenance erythropoietin[J].Nephrol Dial Transplant,2001,16(7):1416-1423.
[9]丁文軍.妊娠期婦女鐵營養[J].臨床薈萃,2011,26(10):918-920.

