納他霉素-蛋白質復合物制備及其抑菌效果評價
趙曄,顧沁,張延杰,周戈,徐學明
1(江南大學食品學院,江蘇 無錫,214122) 2(咀香園健康食品(中山)有限公司,廣東 中山,528437)3(浙江老藝人生物科技有限公司,浙江 麗水,323000)
納他霉素(natamycin),又名匹馬霉素或游鏈霉素(pimaricin),是一種多烯大環內酯類抗真菌劑,分子式為C33H47O13,分子量為665.75,是一種兩性物質,分子中有1 個堿性基因和1 個酸性基因,其電離常數pKa 值為8.35 和4.6,相應的等電點為6.5,熔點為280 ℃[1],微溶于水和甲醇,難溶于大部分有機溶劑;在水中的溶解度為50 ~100 mg/L。高溫、紫外線、氧化劑及重金屬等會影響其穩定性[2]。
納他霉素是一種高效、安全、天然的抗真菌試劑,具有低劑量、高效率、抗菌作用時間長的特點,能夠專性抑制酵母菌和霉菌,阻止絲狀真菌中黃曲霉素的形成。1982 年7 月,美國FDA 正式批準納他霉素可用作食品防腐劑;1997 年3 月我國食品添加劑使用衛生標準將其作為增補品種批準使用,批準使用范圍為乳酪制品、肉類制品(肉湯、西式火腿)、廣式月餅、糕點表面、果汁原漿表面、易發酵食品加工器皿表面、發酵酒、沙拉醬等[3]。納他霉素的抑菌機理為溶解的納他霉素與細胞膜中的甾醇類物質結合,改變細胞膜的通透性,從而達到抑真菌效果[1]。因而低水溶性就成為限制納他霉素抑真菌效果的主要因素[4-5]。
蛋白質作為一種生物大分子,能與多種小分子物質,如有機小分子染料、藥物、無機離子等形成復合物。作用方式主要是次級鍵,如氫鍵、范德華力、疏水作用力等。據報道,蛋白質如β-乳球蛋白(β-LG)可與多種疏水小分子及兩性物質形成復合物,有效地提高疏水分子的水溶性及穩定性[6]。本文主要制備納他霉素及大豆分離蛋白的復合物來提高納他霉素的溶解性,并對復合物的抑菌效果進行評價。
1 材料與方法
1.1 材料及設備
納他霉素(含量95%),浙江銀象生物科技有限公司;大豆分離蛋白(SPI),江南大學食品學院提供。
菌種:啤酒酵母(Saccharomyces cerevisiae Hansen)青霉(Penicitlium sp. )、黑曲霉(Aspergilla sp. )、根霉(Rhizopus),江南大學食品學院微生物基礎實驗室。
細菌采用牛肉膏蛋白胨培養基:牛肉膏3 g ,蛋白胨10 g ,瓊脂20 g ,NaCl 5 g ,加水至1 000 mL ,pH 7.2 ~7.6。
酵母菌采用YPED 培養基:酵母膏10 g,蛋白胨20 g,葡萄糖20 g,瓊脂20 g,加水至1 000 mL,自然pH。
霉菌采用PDA 培養基:馬鈴薯200 g,葡萄糖20 g,瓊脂12 ~15 g,蒸餾水1 000 mL,自然pH。
MEB 液體培養基:麥芽浸膏20 g,加雙蒸水至1 000 mL,調pH 至6.9 ±0.2。上述培養基121 ℃高壓滅菌20 min,備用。
TU1901 紫外可見分光光度計,北京普析通用;ZHWY-211C 恒溫振蕩器,上海智城分析儀器制造有限公司;ARA520 電子精密天平,美國OHAUS(奧豪斯)公司;生化培養箱;超凈工作臺(HS-3)。
1.2 實驗方法
1.2.1 標準曲線的繪制
取適量納他霉素,加甲醇溶解,配制成一定的濃度,另取適量的大豆分離蛋白配成溶液,分別用紫外分光光度計在200 ~400 nm 掃描,得紫外光譜圖。精密稱取納他霉素對照品100 mg,置于100 mL 容量瓶中,加適量甲醇∶水∶乙酸(60∶40∶5)溶液溶解并定容至刻度,作為儲備液。精密量取儲備液,用甲醇∶水∶乙酸(60∶40∶5)溶液分別稀釋為0.5、1、2、3、4、5、6、10、20 mg/L。在λ319nm和λ303nm處測定吸光度,用雙波長法繪制標準曲線[7]。
1.2.2 納他霉素-大豆蛋白復合物制備方法
(1)0.5 g 納他霉素溶于80 mL 水(用4 mol/L NaOH 調pH 至11.5);(2)大豆分離蛋白溶于去離子水5% (w/w);(3)5 mL 上述大豆分離蛋白溶液加入80 mL 納他霉素溶液中攪拌一定時間;(4)用4 mol/L HCl 調pH 至5.8,加去離子水至100 mL。
1.2.3 大豆蛋白水解及水解度測定
水解樣品通過木瓜蛋白酶限制水解大豆分離蛋白制備:用去離子水配制1% SPI 溶液,室溫下攪拌2 h,使其充分水合,80 ℃下水浴10 min 后降溫至55 ℃,用NaOH 溶液調pH 至7.0,加入木瓜蛋白酶(E/S=3 %)開始酶解,在不同時間下取樣,樣品在90 ℃滅酶5 min,冷卻至室溫,調pH 至7.0,用pHstat 法測定大豆蛋白水解度,4 500 r/min 離心20 min后取上清液凍干。
1.2.4 評價指標及測定方法
納他霉素或復合物在pH =5.8 ~6.0 平衡溶解24 h 后,4 000 r/min 離心20 min,取上清液稀釋一定倍數后用雙波長紫外分光光度法測定溶解度。
1.2.5 納他霉素-蛋白質復合物抑菌圈測定[8]
取直徑6 mm 的圓形濾紙片,滅菌。吸取20 μL不同復合物樣品滴到濾紙片上,無菌風干備用。將滅過菌的培養皿、培養基放入超凈工作臺中冷卻至60℃后倒平板。每皿約20 mL,水平放置。用移液槍取0.2 mL 菌懸液加在平板上,用涂布棒均勻涂開。無菌鑷子夾取已風干的濾紙片放在接過種的平板上。每皿放3 片,呈正三角形。每個樣品做3 組平行,放入培養箱中,倒置培養24 h。拍照記錄并測量抑菌圈大小。
1.2.6 納他霉素-蛋白質最小抑菌濃度測定
1.2.6.1 納他霉素及納他霉素-大豆分離蛋白原液的制備
納他霉素原液:準確稱量0.032 g 納他霉素溶于10 mL 無菌水,制得3 200 mg/L 納他霉素溶液懸濁液,吸取1 mL 上述溶液稀釋100 倍,制得32 mg/L 納他霉素原液,記為溶液①。
納他霉素-SPI 復合物原液:準確稱量0.032 g 納他霉素溶于10 mL 無菌水,用4mol/L NaOH 溶液調pH 至11.5 ~12,加0.32 mL 5%(w/w)SPI 溶液,反應一段時間后調pH 至5.8,制得含納他霉素3200 mg/L 溶液,吸取上述溶液1 mL 稀釋100 倍,制得32 mg/L 納他霉素-SPI 原液,記為溶液②
1.2.6.2 試管二倍稀釋培養
取7 只滅菌的13 mm×100 mm 試管,編號為1 ~7,其中7 號為對照管。每只試管分裝1 mL 滅菌的MEB 液體培養基。按照表1 進行操作。28 ℃培養3 d,觀察記錄結果。終點判定標準:肉眼觀察法。按以下標準記錄MIC 結果,+ + +:菌生長較生長對照輕度減少;+ +:菌生長較生長對照明顯減少;+ :只有薄層菌生長;—:清晰透明。記錄結果,以清晰透明組對應的抑霉菌劑濃度為最小抑菌濃度,即MIC。
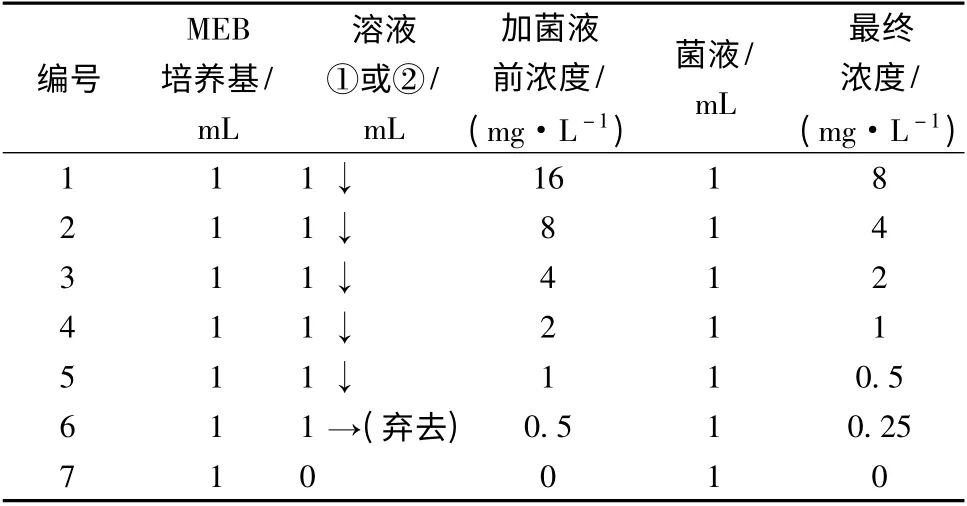
表1 試管二倍稀釋法操作表Table 2 Operation method of two times dilution method
2 結果與討論
2.1 紫外光譜掃描圖
如圖1,納他霉素及納他霉素-大豆蛋白復合物的紫外光譜顯示,在λ 為290,303,319 nm 處有3 個尖銳的最大吸收峰,這是納他霉素結構中的環狀四烯結構產生的共軛峰。大豆蛋白的紫外光譜顯示,在λ280nm附近有寬峰。大豆蛋白在納他霉素最大吸收波長303nm,319 nm 處的吸收值分別基本沒有變化,且與納他霉素的吸收值相差較大,因此可以選定303 nm,319 nm 做為納他霉素含量測定波長,在此處蛋白質吸收的ΔAλ1-λ2≈0,可以最大限度地減少蛋白質吸收的干擾。
圖2 為納他霉素的標準曲線,得到納他霉素的一元線性回歸方程為:ΔA = 0.0213C - 0.0009,R2=0.9998,式中:ΔA 為303 nm、319 nm 吸光度差值;C為濃度,μg/mL。結果表明,納他霉素吸光值差值與質量濃度在0.5 ~20 mg /L 內呈良好的線性關系。
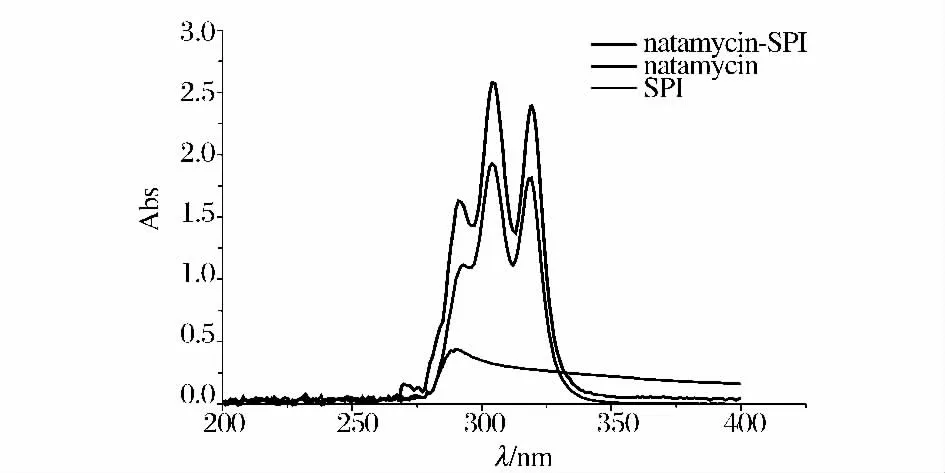
圖1 納他霉素、納他霉素-大豆蛋白復合物及大豆蛋白紫外光譜圖Fig.1 UV spectra of natamycin,natamycin-SPI and SPI

圖2 雙波長紫外分光光度法標準曲線Fig.2 The standard curve of double wavelength UV spectrophotometry
2.2 納他霉素-大豆蛋白復合物制備條件優化
2.2.1 大豆蛋白水解度對納他霉素-大豆蛋白復合物溶解度的影響
分別取方法1.2.3 制得的水解度DH% =0,2.5,5.43,6.24,6.76,7.43,8.21,9.01 的大豆分離蛋白制備復合物,所得復合物的溶解度結果見圖3。
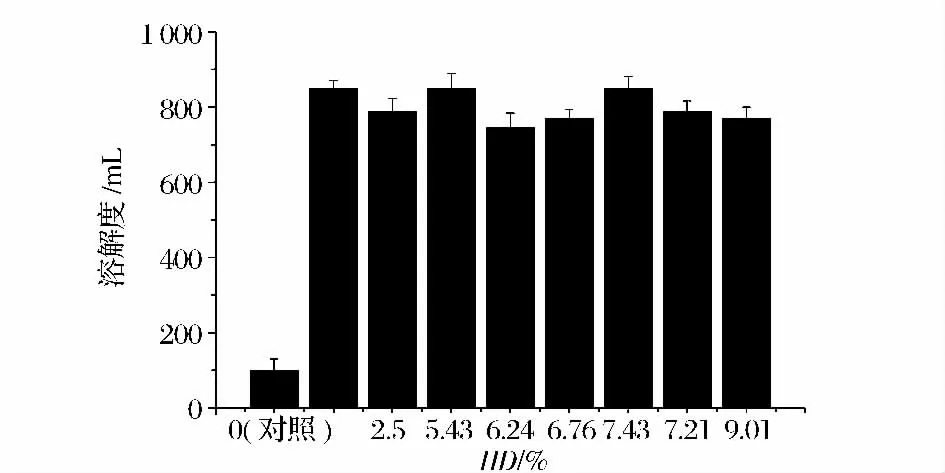
圖3 蛋白質水解度對復合物溶解度的影響Fig.3 Influence of different hydrolysis degree of SPI on solubility of natamycin-SPI complex
由圖3 可知,蛋白質水解度與復合物中納他霉素溶解度變化的P >0.05,差異不顯著,總體趨于平穩。因此使用商品性SPI 直接制備蛋白質納他霉素復合物就工藝而言更簡單。
2.2.2 反應時間對納他霉素-大豆蛋白復合物溶解度的影響
反應時間分別為10,30,60,90,120,150 min,用方法1.2.2 制備復合物,所得復合物的溶解度結果見圖4。
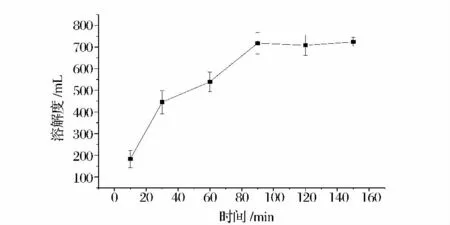
圖4 不同反應時間對復合物溶解度的影響Fig.4 Influence of different reaction time on solubility of natamycin-SPI complex
由圖4 可知,隨著反應時間增加,納他霉素溶解度逐漸升高,當反應時間大于120 min 時,復合物溶解度變化不大,趨于平穩。因此選取120 min 作為反應時間。
2.2.3 反應溫度對納他霉素-大豆蛋白復合物溶解度的影響
選取反應溫度分別為30,40,50,60℃按方法1.2.2 反應120 min 制備復合物,所得復合物的溶解度結果見圖5。
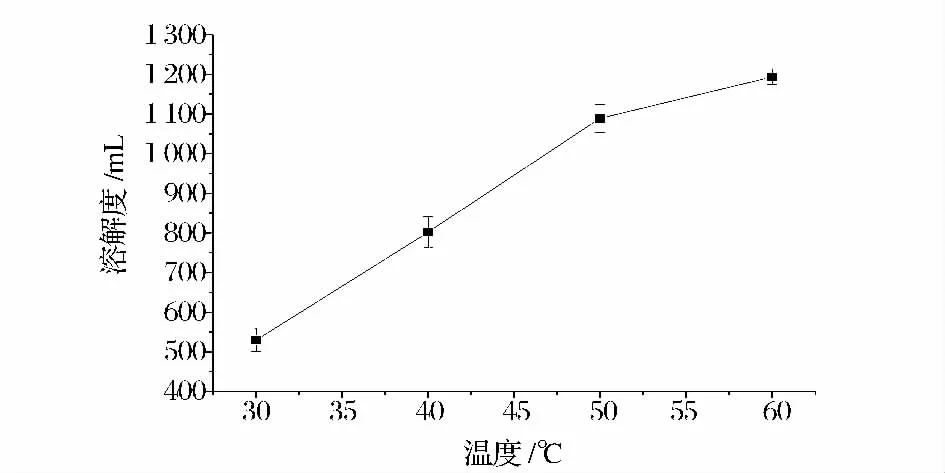
圖5 不同反應溫度對復合物溶解度的影響Fig.5 Influence of different reaction temperature on solubility of natamycin-SPI complex
由圖5 可知,反應溫度對納他霉素溶解度影響較大,隨著反應溫度的升高,納他霉素溶解度升高,考慮到納他霉素熱穩定性較差,尤其在大于100℃環境中會很快失活[9],選取40℃作為反應溫度。
2.2.4 反應濃度對納他霉素-大豆蛋白復合物溶解度的影響
納他霉素濃度分別為1,2.5,5,7.5,10,12.5 g/L,以m(納他霉素)∶m(大豆蛋白)=2∶1 添加大豆蛋白溶液,按方法1.2.3 在40 ℃下反應120 min 制備復合物,所得復合物的溶解度結果見圖6。
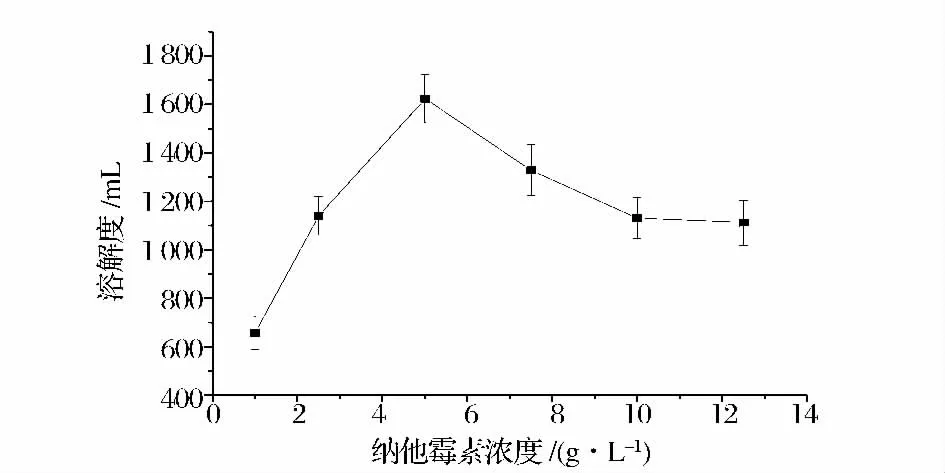
圖6 不同底物濃度對復合物溶解度的影響Fig.6 Influence of different concentration on solubility of natamycin-SPI complex
由圖6 可知,隨著反應體系中納他霉素濃度的增加,復合物溶解度逐漸升高,當納他霉素濃度大于5 g/L 時,復合物溶解度又隨之降低。選取5 g/L 作為反應濃度。
2.2.5 不同配比對納他霉素-大豆蛋白復合物溶解度的影響
以納他霉素5 g/L 作為反應濃度,分別以納他霉素∶蛋白質(N∶SPI)=10∶1,8∶1,4∶1,2∶1,1∶1,1∶2 的配比添加5% (w/w)大豆分離蛋白溶液,按方法1.2.2 在40 ℃下反應120 min 制備復合物,所得復合物的溶解度結果見圖7。
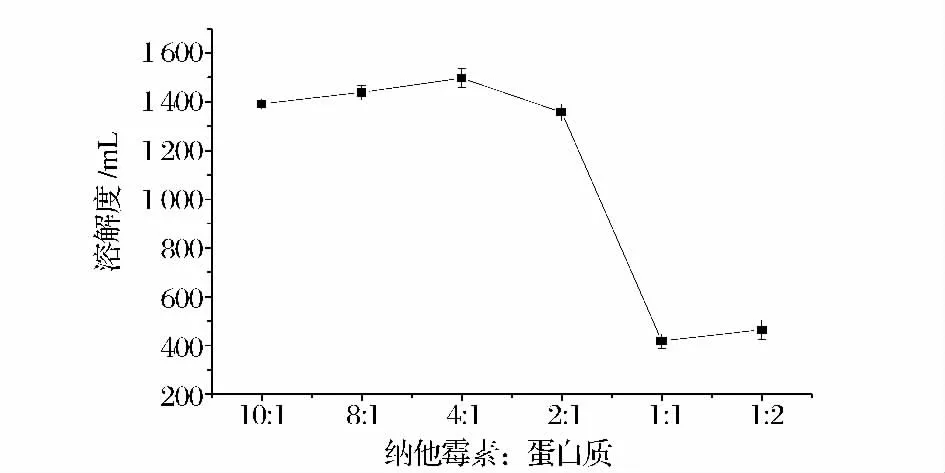
圖7 不同配比對復合物溶解度的影響Fig.7 Influence of different proportioning on solubility of natamycin-SPI complex
由圖7 可知,隨著N∶SPI 的增大,復合物溶解度增大,但當N∶SPI 大于4∶1 時,復合物溶解度不再隨配比增大而增大,因此選取納他霉素∶蛋白質=4∶1作為反應配比。
2.2.6 反應pH 值對納他霉素-大豆蛋白復合物溶解度的影響
反應pH 分別設置為9.5,10,10.5,11,11.5,12,12.5,13,以納他霉素5 g/L 作為反應濃度,以納他霉素∶蛋白質(N∶SPI)=4∶1 的配比添加5%(w/w)大豆分離蛋白溶液,按方法1.2.2 在40 ℃下反應120 min 制備復合物,所得復合物的溶解度結果見圖8。
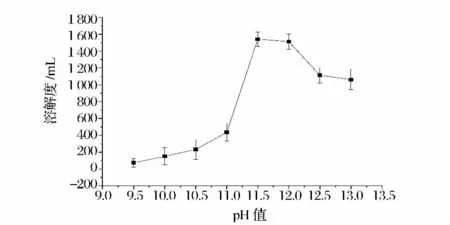
圖8 不同反應pH 值對復合物溶解度的影響Fig.8 Influence of different reaction pH on solubility of natamycin-SPI complex
由圖8 可知,反應pH 對復合物溶解度影響較大,在反應pH >11.5 時,復合物溶解度均較高,考慮到納他霉素在pH >12 的環境中易分解失活,選取pH=11.5 作為反應pH。
2.3 納他霉素及納他霉素-大豆蛋白復合物的抑菌圈
納他霉素及納他霉素-大豆蛋白復合物對霉菌和酵母抑制活性的測定結果如表2。由表2 可以看出,以納他霉素及納他霉素-大豆蛋白復合物對黑曲霉、青霉、根霉及啤酒酵母的抑菌圈直徑分別比較,經顯著性分析,P 值分別為0.000 5、0.000 3、0.000 05、0.005,在P <0.05 水平上有顯著性差異。
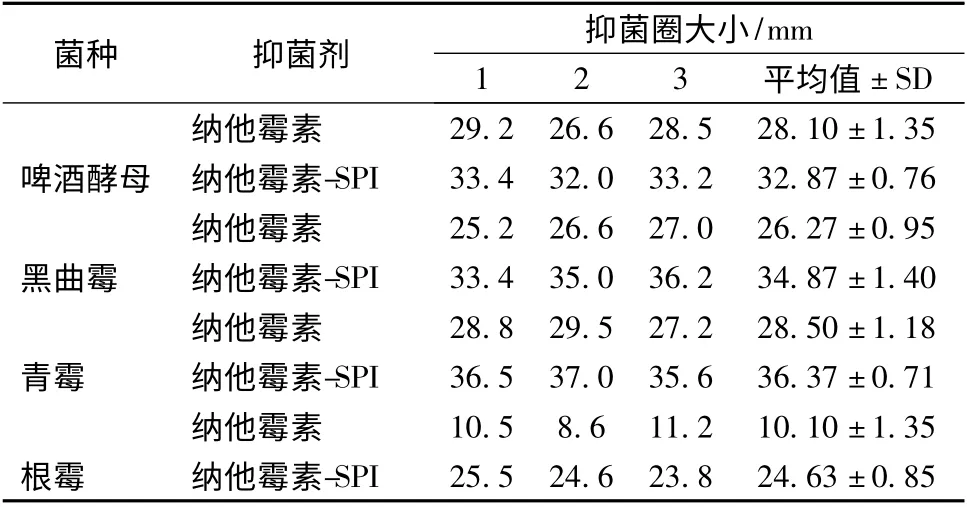
表2 納他霉素、納他霉素-大豆分離蛋白復合物的酵母菌抑菌圈比較(單位:mm)Table 2 Inhibition zone of natamycin,natamycin-SPI
2.4 納他霉素及納他霉素-大豆分離蛋白復合物的最小抑菌濃度
如表3 培養結果所示,霉菌或酵母總數為104~105個/mL 時,納他霉素-大豆分離蛋白復合物對啤酒酵母的最低抑菌濃度是2 mg/L,對青霉的最低抑菌濃度是2 mg/L,對根霉的最低抑茵濃度是4 mg/L,對黑曲霉的最低抑茵濃度是2 mg/L,比納他霉素的最小抑菌濃度降低1 倍。
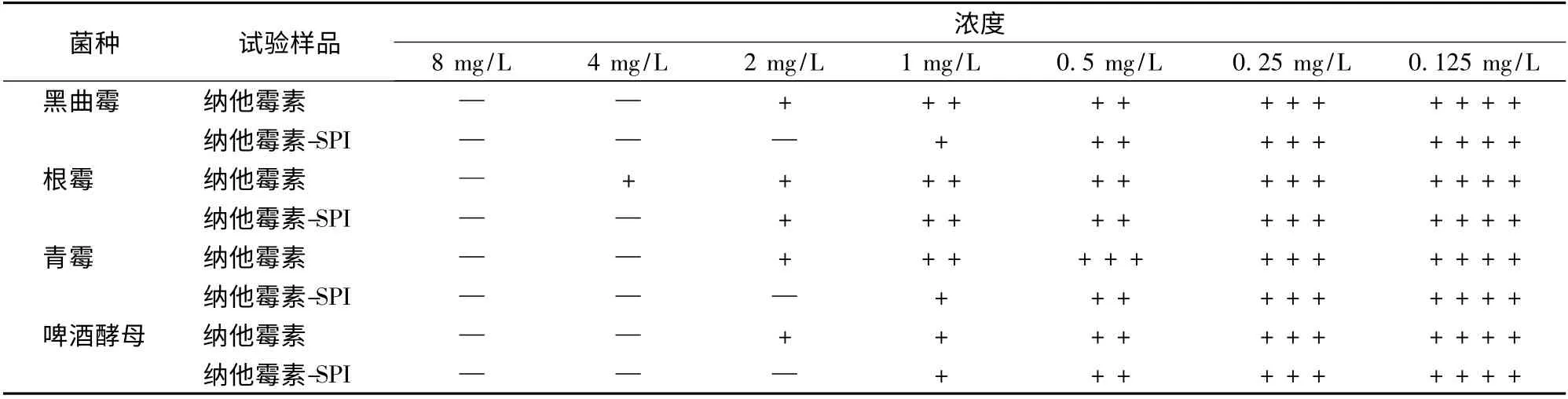
表3 試管二倍稀釋法培養結果記錄Table 3 Results recorde of minimum inhibitory concentration
3 結論
納他霉素-大豆蛋白復合物對納他霉素的增溶效果顯著,經過制備條件的優化,在一定配比反應一定時間后,溶解度能夠提高16 倍,達到1 600 mg/L;同時,在此制備條件下得到的納他霉素-大豆蛋白復合物的抑菌效果好于納他霉素的抑菌效果,最小抑菌濃度降低1 倍。
[1] 董堅慧,李紅飛,高維娟. 納他霉素藥理學研究進展及其應用[J]. 中國抗生素雜志,2009,34(9):520-525.
[2] 朔影,邱德清. 納他霉素的穩定性研究[J]. 中國食品添加劑,2011(1):69 -71.
[3] 李東,杜連祥,路福平. 納他霉素的抑菌譜及最小抑菌濃度[J]. 食品工業科技,2004(7):143 -144.
[4] John L. Koontz ,Joseph E. Marcy. Formation of natamycin:CD inclusion complex and their characterization[J].Journal of Food Agricultrural and Chemistry,2003,51(24):7 106 -7 110.
[5] John L Koontz,Joseph E Marcy,William E Barbeau Eds.Stability of natamycin and it's CD inclusion complexes in aqueous solution[J]. Journal of Food Agricultrural and Chemistry. 2003,51(24):7 111 -7 114.
[6] Li Liang,Vanessa Tremblay-Hébert,Muriel Subirade.Characterisation of the β-lactoglobulin/a-tocopherol complex and its impact on β-tocopherol stability[J]. Food Chemistry ,2011,126(3):821 -826.
[7] 梁景樂,呂忠良,趙愛華. 雙波長紫外分光光度法快速測定發酵液中納他霉素含量[J]. 食品與發酵工業,2007,33(4):126 -132.
[8] 張佳,王瑩,張峰. 濾紙片法測定黃花蒿提取物對霉菌的抑制活性[J]. 湖北農業科學,2009,48(5):1 153-1 154
[9] 明飛平,黃樂天,梁淑娃. 納他霉素的耐光和耐熱性初步研究[J]. 中國食品添加劑,2008(5):105 -107.

