膀胱癌中MMP-2及TIMP-2的表達與病理分期和預后的相關性
張金平,孫發林,周大海
膀胱癌在泌尿系腫瘤中發病率最高,其腫瘤的生物學行為比較復雜,病變的發生發展受多種基因的控制和調節。復發是導致膀胱癌患者多次接受手術的主要原因,而轉移是導致膀胱癌患者病死的主要原因。如何界定膀胱癌的惡性程度,早期將具有復發和轉移潛能的患者篩選出來,給予密切的隨訪和積極、合理的治療,有重要意義。近年來認為腫瘤侵襲和轉移過程的形成受多個基因調控。基質金屬蛋白酶(MMPs)具有降解細胞外基質(EMC)的能力,與腫瘤轉移密切相關,金屬蛋白酶組織抑制劑(TIMPs)是體內天然存在的MMPs抑制劑。本研究采用免疫組化方法對膀胱癌組織和癌旁組織MMP-2和TIMP-2的表達與病理學分級、分期和預后情況的相關性進行分析,了解其是否能對提高膀胱癌惡性程度的認識、預后的情況預測具有臨床價值。
1 資料與方法
1.1 一般資料 40份標本全部來自青島大學附屬醫院和解放軍第 401醫院泌尿外科 2009 ̄01—2010 ̄06行開放手術治療的膀胱癌患者,另選擇正常膀胱黏膜10例作為對照組。40例中膀胱部分切除術32例,膀胱全切除術8例。男28例,女12例;年齡37~76歲,平均60.2歲;第1次發病25例,復發15例。UICC TNM標準病理分期,Tis~T1期22例,T2~T3期18例。WHO分類標準進行病理分級,G1級11例,G2級13例,G3級16例,全部為移行細胞癌。膀胱部分切除術的患者,手術切除范圍:包括癌腫及基底部膀胱壁和距離癌緣2 cm的黏膜及膀胱壁[1];術中取癌組織和癌旁2 cm組織各1塊;膀胱全切標本在離體5 min內進行取材。標本取材后分別放入10%甲醛液中固定。患者術后常規經尿道膀胱灌注絲裂霉素。術后對12例行膀胱部分切除術患者進行膀胱鏡檢查1次/3個月,以后進行膀胱鏡檢查1次/6個月。對8例行膀胱全切術患者術后10個月行盆腔超聲檢查。
1.2 實驗方法 鼠抗人MMP-2單克隆抗體、鼠抗人TIMP-2單克隆抗體、3%H2O2去離子水、EDTA抗原修復液 (pH9.0)、APES、PBS 緩沖液(pH7.4,0.01 mol/L)、免疫組化試劑及染色試劑均購自北京中杉金橋生物技術有限公司。載玻片防脫片劑處理:選擇APES,撈片后置烤箱58~60℃ 5 min,以使切片緊密粘附;切片脫蠟;新鮮配制3%雙氧水,室溫5~10 min以滅活內源性酶;蒸餾水洗3次;pH9.0 EDTA抗原修復液行微波抗原修復。全部標本均常規石蠟包埋、切片及染色。應用免疫組化SP法。一抗選用鼠抗人MMP-2、TIMP-2單克隆抗體,MMP-2、TIMP-2、SP試劑購買自北京中杉金橋生物技術有限公司。 抗體稀釋度效價分別為 1∶800、1∶500、1∶100,切片常規脫蠟、水化,pH9.0 EDTA抗原修復液行微波抗原修復。用已知胃癌切片作陽性對照,陰性對照一抗用PBS取代。常規SP技術操作,DAB染色。顯微鏡觀察。以PBS代替一抗作為陰性對照,用已知陽性的胃癌切片作為陽性對照,按上述步驟操作。
1.3 結果判定 ①MMP-2和TIMP-2染色陽性信號均呈棕色定位于細胞胞漿內;判定方法為在鏡下觀察,根據棕色反應的陽性強度及面積判定結果;②評分標準[2]:MMP-2:無陽性細胞為(-);陽性細胞數≤10%為(+),10%~75%為(++),>75%為(+++);TIMP-2:0分為陰性,1分為局限性 (<0%的腫瘤細胞或間質組織)弱陽性,2分為彌漫性(<10%的腫瘤細胞或間質組織)弱陽性或局限性(>10%的腫瘤細胞或間質組織)強陽性,3分為彌漫性強陽性。
1.4 統計學處理 所有數據輸入計算機,用統計軟件SPSS11.5處理。不同部位、病理分級、臨床分期的蛋白表達的顯著性分析均采用χ2檢驗法,以P<0.05為有顯著性差異。
2 結 果
2.1 MMP-2和TIMP-2在正常膀胱黏膜組織及膀胱癌 (BTCC)組織中的表達 10例正常膀胱黏膜MMP-2和 TIMP-2的表達均為陰性,細胞質內無深棕色顆粒。在BTCC組織中MMP-2及TIMP-2的表達詳見表1;癌旁組織中MMP-2及TIMP-2的表達詳見表2。經過χ2檢驗證實BTCC組織中MMP-2和TIMP-2的陽性率顯著高于癌旁組織(P<0.01)。
2.2 BTCC組織中MMP-2和TIMP-2的表達與BTCC病理分級分期的關系 在BTCC組織中MMP-2和TIMP-2的表達與BTCC病理分級分期的關系詳見表1。經過χ2檢驗證實,MMP-2的陽性表達與臨床分期、分級呈正相關(P<0.01);TIMP-2的陽性表達與臨床分期、分級無明顯相關(P>0.05),見表1。
2.3 癌旁組織中MMP-2和TIMP-2的表達與BTCC病理分級、分期關系 在癌旁組織中MMP-2和TIMP-2的表達與BTCC病理分級、分期關系詳見表2。經過χ2檢驗證實,MMP-2的陽性表達率與臨床分期、分級呈正相關(P<0.05);TIMP-2的陽性表達率與臨床分期、分級相關性不顯著(P>0.05),見表2。
2.4 MMP-2、TIMP-2的表達與膀胱癌1年內及2年內復發的關系 40例患者之中有32例行膀胱部分切除術,對這32例患者術后常規膀胱灌注絲裂霉素化療,復查膀胱鏡1次/3~6個月,結果12例膀胱癌1年內復發,其余28例患者2年內未復發。這12例膀胱癌復發患者的BTCC組織和癌旁組織中MMP-2和 TIMP-2的表達率 91.6%(11/12),33.3%(4/12)與 66.7%(8/12),16.7%(2/12)。 經過 χ2檢驗證實BTCC組織和癌旁組織中MMP-2的表達率與膀胱癌1年內復發率呈正相關 (P<0.01);BTCC組織和癌旁組織中TIMP-2的表達率與膀胱癌1年內復發率呈負相關(P<0.05)。
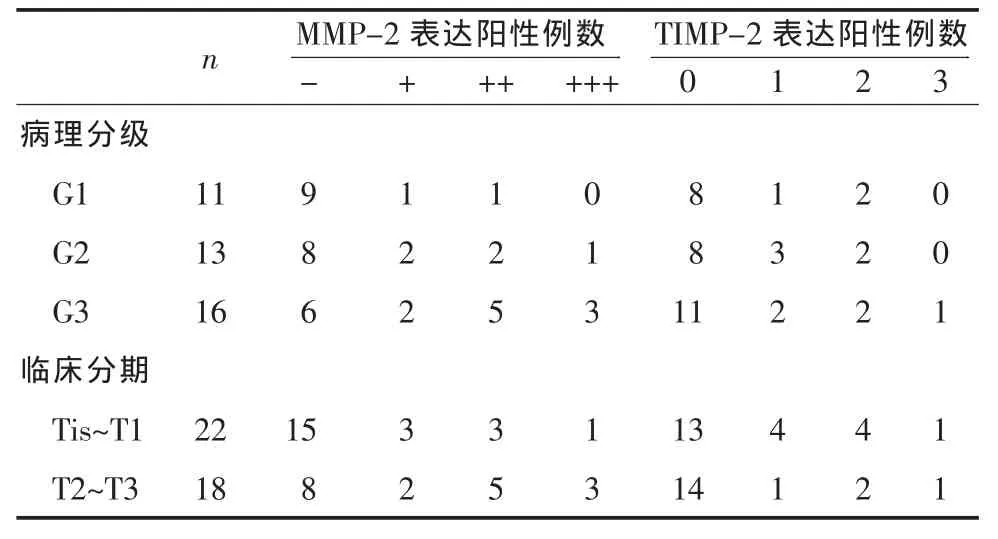
表 1 BTCC組織中MMP-2和TIMP-2的表達與臨床分期的關系
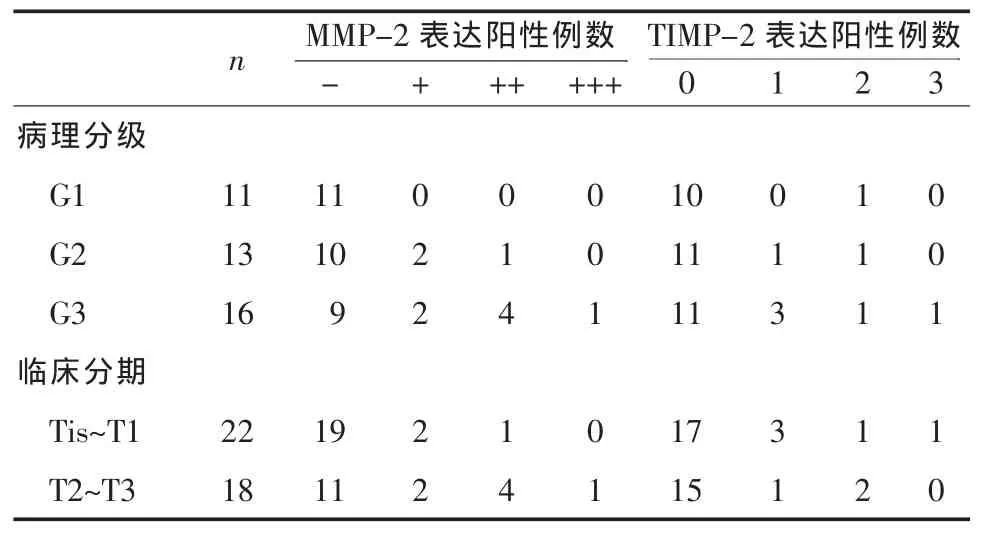
表 2 癌旁組織中MMP-2和TIMP-2的表達與臨床分期的關系
3 討 論
3.1 MMP-2和TIMP-2在惡性腫瘤組織中的表達及意義 腫瘤的侵襲和轉移是惡性腫瘤的基本生物學特征,是一個多步驟、多因素參與的極其復雜的過程[3]。腫瘤細胞的浸潤和轉移必須首先脫離原發灶,黏附在細胞外基質上,爾后降解基質并通過降解的基質進行移動,穿透基底膜進入間質或體液循環而發揮作用[4]。腫瘤細胞從原發瘤脫離后,必須穿透原發瘤周邊的ECM,才能進入血管和淋巴管,ECM是阻止腫瘤細胞移動的生理屏障,其完整與否是影響腫瘤轉移的關鍵環節。大量實驗證明,瘤細胞穿透基底膜的這種侵襲能力的獲得與其產生或誘導產生蛋白酶,降解ECM有關,其中最重要的一組蛋白酶是基質金屬蛋白酶(MMPs),它幾乎能降解細胞外基質和基底膜的所有成分,對腫瘤的浸潤與轉移起著極為重要的作用[5]。Ⅳ型膠原酶是MMPs家族中主要成員之一,它分為兩個亞型,即MMP-2(72 kD,明膠酶 A)和 MMP-9(92 kD,明膠酶 B)。Ⅳ型膠原是基底膜的主要結構蛋白,MMP-2是Ⅳ型膠原的降解酶,TIMP-2通過與MMP-2形成復合物,從而抑制MMP-2的降解活性。BTCC組織通過高表達MMP-2和(或)低表達TIMP-2,降解Ⅳ型膠原,Ⅳ型膠原降解加快,基底膜破壞,有助于膀胱癌細胞發生浸潤和轉移。在癌旁組織中MMP-2呈局灶狀表達,尤其是在癌巢的邊緣或血管的周圍染色特別深,這被認為是腫瘤侵襲和轉移的前期工作。
Liotta等[6]首先報道了MMP-2在癌細胞轉移中的作用,Talvens uari-Matlila等[7]采用免疫組化方法測定177例原發性乳腺癌患者組織樣本,發現84%MMP-2陽性,且陽性者生存期明顯短于陰性者,在前10年隨訪中,患者病死危險性明顯增加,認為MMP-2陽性為乳腺癌患者低生存率的獨立預后因素。國內對乳腺癌患者組織樣本研究表明,MMP-2總陽性表達率為68%,有淋巴結轉移的30例乳腺癌組織中有24例MMP-2陽性(80%),而無淋巴結轉移的30例乳腺癌組織中有17例MMP-2陽性(56.7%),臨床分期越晚MMP-2的陽性表達越高,MMP-2可能具有促進乳腺癌細胞發生轉移的作用;5年隨訪結果,MMP-2陽性組生存率明顯低于MMP-2陰性組。提示MMP-2可作為乳腺癌不良預后判定指標,且獨立應用有意義。
TIMPs是MMPs的特異性抑制劑,目前已知的TIMPs主要有四種:TIMP-1、2、3 和 TIMP-4,TIMP-2對MMP-2活性的抑制特別重要[8]。TIMP-2可與MMP-2 酶原及其活化形式形成 1∶1(mol)穩定復合物,從而抑制MMP-2的產生及其活性,TIMP-2與膠原酶由同一個細胞分泌,因此只有當活化的膠原酶量超過TIMP-2時,才有膠原的水解,MMP-TIMP在維持ECM穩態中起關鍵作用。TIMPs除了具有抑制MMPs降解活性,保持基底膜完整,另外還有抑制腫瘤新生血管形成的作用[9,10]。
3.2 MMP-2和TIMP-2的表達失衡是癌腫局部侵犯、遠處轉移及復發的原因之一 基底膜是阻止腫瘤細胞侵襲轉移的天然屏障,Ⅳ型膠原是基底膜的主要結構蛋白,MMP-2是Ⅳ型膠原的降解酶,TIMP-2通過與MMP-2形成復合物,從而抑制MMP-2的降解活性。在正常組織中兩者是平衡的,共同參與Ⅳ型膠原的代謝調節,維持基底膜的正常結構和生理功能。惡性腫瘤組織通過高表達MMP-2和(或)低表達TIMP-2,降解Ⅳ型膠原,破壞基底膜,從而有助于腫瘤細胞的浸潤轉移。國內許可慰等[11]研究報道HER-2與MMP-2的表達密切相關,兩者在膀胱癌的浸潤性生長和轉移過程中相互促進。實驗結果表明,TIMP-2陽性表達與惡性腫瘤的臨床分期、淋巴結轉移情況呈負相關,與患者生存率呈正相關,MMP-2和TIMP-2在惡性腫瘤組織中的表達呈負相關,TIMP-2可通過對MMP-2的抑制作用,成為惡性腫瘤細胞轉移的阻抑因素。MMP-2和TIMP-2作為分子生物學指標,聯合檢測能更有效地判定早期惡性腫瘤患者的預后,以便為患者選擇更合理的治療[12,8]。
3.3 癌旁組織癌標的表達與癌復發的關系 癌旁組織易發生不同程度的惡變傾向,是否癌變及癌變的范圍大小,不僅與腫瘤的惡性程度有關,亦影響手術方式的選擇及治療后的效果[1]。Igawa[13]通過美藍對膀胱黏膜進行染色后取組織進行組織病理學檢查的結果表明,Ta、T1膀胱癌癌旁組織的組織病理學有惡變傾向的惡變率為21.1%,T2惡變率50.0%,T3惡變率64.7%。淺表性膀胱癌癌旁組織距癌緣2 cm處有癌變及癌前病變占20%左右,其中距癌緣2 cm處原位癌和異型增生各占1/2。浸潤性膀胱癌癌旁有癌變及癌前病變高達50%以上,癌變組織距癌緣2 cm以外占20%以上;T2浸潤性癌距癌緣2 cm以外接近20%,T3浸潤性癌距癌緣2cm以外接近30%;其中癌旁癌變、原位癌和不典型性增生約各占1/3。國內馬文香等[14]對26例膀胱癌進行圖像分析,主要以癌旁原位癌為主。在行膀胱癌手術時,不僅要考慮腫瘤的浸潤深度,更要高度重視手術切除范圍;在2 cm處發現惡變,提示在行膀胱部分切除術時要擴大切除范圍。對于T3 G3期膀胱移行細胞癌應多以膀胱全切為主,對于分級、分期稍低的膀胱癌若行膀胱部分切除術亦應擴大切除范圍才獲得較好的預后。
本研究采用免疫組化方法測定膀胱移行細胞癌組織中MMP-2和TIMP-2的表達,并以正常膀胱黏膜組織為對照。結果顯示在正常膀胱組織中MMP-2和TIMP-2不表達;而在膀胱癌組織中,兩者均呈局灶狀或斑片狀表達。MMP-2的陽性表達與臨床分期、分級呈正相關;TIMP-2的陽性表達與臨床分期、分級相關不顯著,MMP-2表達普遍高于TIMP-2表達。本組實驗證實BTCC組織和癌旁組織中MMP-2的表達率與膀胱癌1年內復發率呈正相關;BTCC組織和癌旁組織中TIMP-2的表達率與膀胱癌1年內復發率呈負相關。MMP-2失去TIMP-2對它的抑制,能夠順利降解Ⅳ型膠原,破壞基底膜,從而有助于腫瘤細胞的浸潤轉移。MMP-2和TIMP-2兩者表達失衡,導致癌細胞周圍基底膜降解、為腫瘤侵襲和轉移提供了便利條件。MMP-2和TIMP-2的表達失衡也是膀胱癌在膀胱部分切除術后短期內復發的原因之一。
[1]Patrick CW,Alan BR,Thomas AS,et al.Campell’s urology[M]:sixth edition.USA,W.B:Saunders Company Hareourt Brace Jovanovich Inc,1992.2767.
[2]Grignon DJ,Sakr W,Toth M,et al.High levels of tissue inhibitor of metalloproteinase-2(TIMP-2) expression are associated with poor outcome in invasive bladder cancer[J].Cancer Res,1996,56(16):1654-1659.
[3]曾益新.腫瘤學[M].北京:人民衛生出版社,1999.174-176.
[4]Ray JM,Stetler-Stevenson WG.The role of matrix metalloproteinases and their inhibitors in tumor invasion,metastasis and angiogenesis[J].Eur Respir J,1994,7(20):2062.
[5]Bhuvarahamurthy V,Kristiansen GO,Johannsen M,et al.In situ gene expression and localization of metalloproteinases MMP1,MMP2,MMP3,MMP9,and their inhibitors TIMP1 and TIMP2 in human renal cell carcinoma[J].Oncol Rep,2006,15(5):1379-1384.
[6]Liottal A,Tryggvason K,Garbisa S,et al.Metastatic potential correlates with enzymatic degradation of bacement membrane collagen[J].Nature,1980,284(1):67-68.
[7]Talvensasri-Mattila A,Pcakkop P,Hoyhtyam M,et al.Matrix metalloproteinase-2immunoreactive protein.A marker of aggressiveness in breast carcinoma[J].Cancer,1998,83(6):1153.
[8]Ben Davidson,Iris Goldberg,Juri Kopolovic,et al.MMP-2 and TIMP-2 expression correlates with poor prognosis in cervical carcinoma[J].Gynecol Oncol,1999,73(3):372-382.
[9]Gomez DE,Alonso DF,Yoshiji H,et al.Tissue inhibitors of metalloproteinases structure,regulation and biological functions[J].Eur J Cell Biol,1997,74(2):111-122.
[10]Murphy AN,Unsworth EJ,Stetler-Stevenson WG.Tissure inhibitor of metalloproteinase-2 inhibitors bFCF-induced human microvascular endothelial cell proliferation[J].J Cell Physiol,1993,157(3):351-358.
[11]許可慰,李海剛,黃 健,等.HER-2和MMP-2在膀胱移行上皮癌組織中的表達及意義[J].中華腫瘤防治雜志,2007,14(10):769-771.
[12]班麗英,譚小新,喬京京.MMP-2和TIMP-2表達與乳腺浸潤性導管癌轉移及預后相關性的研究[J].醫師進修雜志(外科版),2004,27(6):27-29.
[13]Igawa M.Studies on multiple mucosal biopsy in patients with bladder cancer.Evaluation of the results of multiple methylene blue staining[J].Hinyokika Kiyo,1986,32(11):1617-1631.
[14]馬文香,王乃寧,顧方六,等.膀胱癌生物學特性的研究[J].中華泌尿外科學雜志,1989,10(4):217-220.

